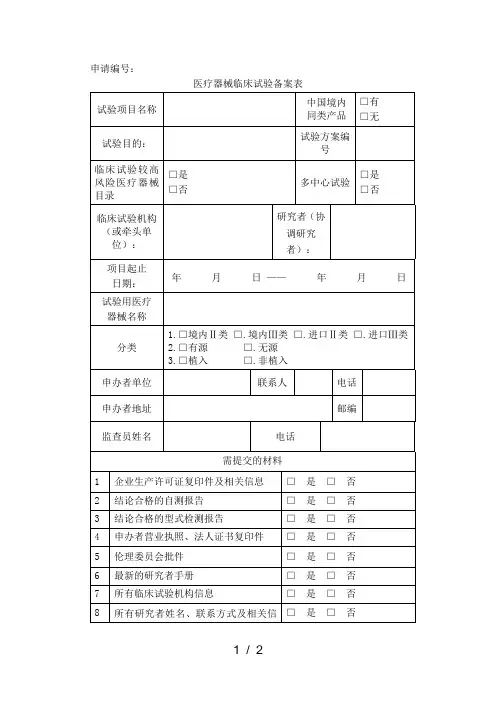
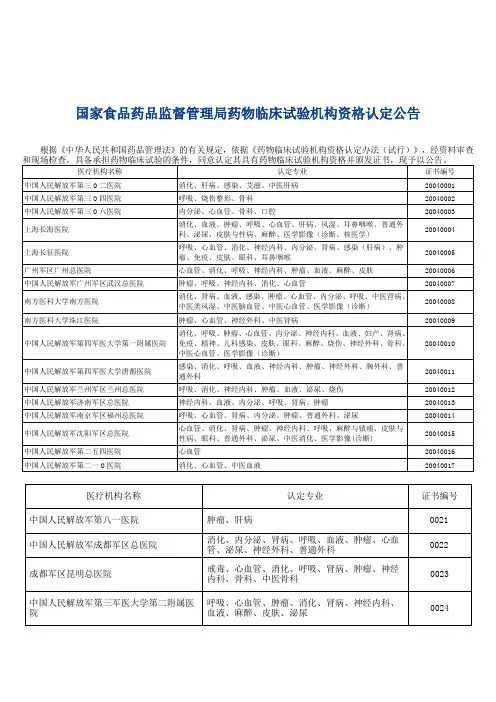
医疗器械临床试验机构汇总表
- 格式:doc
- 大小:25.00 KB
- 文档页数:1

医疗器械临床试验机构汇总表1.北京协和医院北京协和医院,成立于1921年,是中国著名的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有先进的医疗设备和临床试验研究团队,为科研人员和医疗器械企业提供临床试验的场地和平台。
2.北京大学人民医院北京大学人民医院是国内一流的综合性医院之一,其临床试验中心设备先进,临床试验团队经验丰富。
医院积极参与临床试验,为患者提供更多、更好的医疗器械选择。
3.上海交通大学医学院附属瑞金医院上海交通大学医学院附属瑞金医院是上海市的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有完善的设备和专业的临床试验团队,为医疗器械的研究和开发提供支持。
4.广州中山大学附属第一医院中山大学附属第一医院是广州市的综合性医院之一,也是医疗器械临床试验机构的成员之一、医院拥有一流的设备和临床试验团队,为医疗器械的临床试验提供优质的环境和支持。
5.复旦大学附属华东医院复旦大学附属华东医院是上海市的综合性医院之一,具有临床试验资质。
医院设备先进,专业临床试验团队经验丰富,为医疗器械临床试验提供专业支持。
6.浙江大学医学院附属第一医院浙江大学医学院附属第一医院是杭州市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院积极参与临床试验工作,为医疗器械的研发和临床应用提供支持。
7.南京医科大学附属第一医院南京医科大学附属第一医院是江苏省的综合性医院之一,拥有完善的设备和专业的临床试验团队。
医院参与多项临床试验,为医疗器械的发展和应用提供支持。
8.四川大学华西医院四川大学华西医院是成都市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院设备齐全,临床试验团队经验丰富,为医疗器械的研究和应用提供支持。
9.中山大学附属第三医院中山大学附属第三医院是广州市的综合性医院之一,也是医疗器械临床试验机构的重要成员之一、医院设备先进,临床试验团队经验丰富,为医疗器械的研究和应用提供专业支持。



医疗器械临床试验
方案范本
1
2020年4月19日
附件4
医疗器械临床试验方案
方案编号:
G y r o G u i d e临床试验方案
试验用医疗器械名称:基于陀螺仪的简易神经外科手术导航系统型号规格:
试验用医疗器械的管理类别:
需进行临床试验审批的第三类医疗器械是□否□
中国境内同类产品有□无□
方案版本号和日期:V1.0
临床试验机构:浙江大学第二附属医院
研究者:方路平、潘清、高坤
申办者:方路平
代理人:高成龙
2
2020年4月19日
填写说明:
1.对于多中心临床试验,封面上的临床试验机构只填写牵头单位,其它机构在方案内容中列出。
2.对于多中心临床试验,封面上的研究者填写协调研究者。
3
2020年4月19日。

附件415.(2.5.P.)临床试验信息汇总表本套格式申报资料主要适用于以药动学参数为终点评价指标的生物等效性试验资料的申报。
对于需要进行临床试验的特殊制剂等,信息汇总表应参照注册分类3的格式撰写。
基于目前的认识制定本套格式申报资料,可根据化合物的性质和试验特点做适当优化和补充。
须按时间顺序提交所进行的每项生物等效性试验的相关信息。
应以下级目录形式逐个研究项目填写“生物等效性试验信息汇总表”(“如2.5.P.1空腹生物等效性试验;2.5.P.2餐后生物等效性试验”),共用内容集中填写于首个试验项目中,其余项目参见首个试验,并注明标题编号。
2.5.P.1 XX药的空腹生物等效性试验表1(注:依次编号,下同):基本信息表xx:试验药物信息表xx: 处方信息(举例)应提交所有规格的处方信息表xx:体外溶出试验概要6应提交受试制剂和参比制剂所有规格的溶出试验结果。
7表xx: 试验设计表xx: 试验报告及生物样品储存信息表xx: 完成生物等效性试验的受试者信息(举例)表xx:不良事件发生率统计(举例)表xx: 受试者退出试验情况人原因)等。
表xx: 方案偏离情况表xx: 试验结果表xx:调整评价标准的生物等效性试验数据汇总表(若适用)表xx:生物样品分析方法学验证结果(举例)表xx:生物样品分析的标准曲线和质控数据概要*(举例)表xx :试验样品重复测定情况表xx:餐后生物等效性试验中试验餐的组成表xx:浓度数据汇总表(适用于采用体内药代法进行的生物等效性试验)(代码的定义详见后续表格)a)受试制剂组的药物浓度1718b)参比制剂组的药物浓度1920表xx:药动学参数汇总表(表格中代码的定义详见后续表格)(举例)a)受试制剂药动学参数21max22b)参比制剂药动学参数23max24注:生物样品浓度数据表中的代码定义如:N_FIRST=10 指“第10个”采样时间点而不是10小时N_FIRST=24 指“第24个”采样时间点而不是24小时个体药动学参数数据表中的代码定义表xx:试验备案及临床试验登记平台登记情况小结表**药物临床试验登记与信息公示平台网址:/表xx:预试验汇总表(若适用)表xx:参考资料列表。
临床试验机构职责(医疗器械)
1目的:明确我院临床试验机构在医疗器械临床试验中的职责,规范其运行管理模式。
2范围:适用于本临床试验机构。
3内容:
3.1组织研究者承担医疗器械临床试验项目,包括国家市场监督管理总局批准的项目及对上市医疗器械的临床再评价项目。
3.2开展医疗器械临床试验咨询及信息交流。
3.3组织机构管理人员与医疗器械临床试验专业研究者的培训及经验交流。
3.4确保医疗器械临床试验遵循《医疗器械临床试验质量管理规范》进行。
试验前对所申请的项目进行审批并签署协议;试验中对项目进行监督质控;试验结束后对总结报告进行审核,相关材料验收归档。
3.5负责参加医疗器械临床试验的各科室的工作协调,做到职责明确,相互配合。
3.6接受严重不良事件报告,协调医疗器械临床试验专业组对受试者进行及时适宜的医疗处理,并协同伦理委员会在规定时间内上报相关部门。
医疗器械临床试验机构汇总表
日期:2014-02-10 浏览次数:2216 字号:[ 大中小 ] 视力保护色:
医疗器械临床试验机构汇总表说明
(仅供参考,如有差错以原文为准)
《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)第二十一条“承担医疗器械临床试验的医疗机构,是指经过国务院食品药品监督管理部门会同国务院卫生行政部门认定的药品临床试验
基地”。
附件《医疗器械临床试验机构汇总表》系国家食品药品监督管理局药物临床试验机构资格认定公告及复核检查公告的收集汇编。
根据国家食品药品监督管理局关于印发《药物临床试验机构资格认定办法(试行)》的通知(国食药监安[2004]44号)文件规定:对已取得药物临床试验机构资格的医疗机构每3年进行一次资格认
定复核检查,对复核检查不合格的医疗机构,取消其药物临床试验机构的资格并予以公告。
选择临床试验机构是请注意该机构的资质是否有效。
附件:医疗器械临床试验机构汇总表.xls。