高三化学第一轮复习物质的量浓度演讲稿.ppt
- 格式:pdf
- 大小:2.95 MB
- 文档页数:36
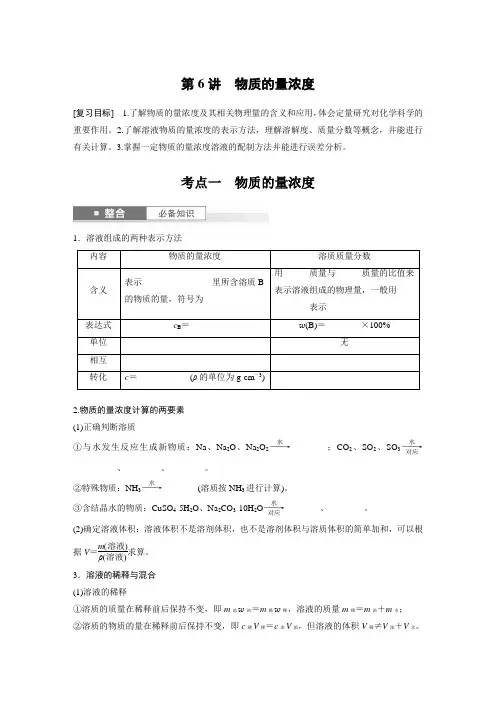
第6讲 物质的量浓度[复习目标] 1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.了解溶液物质的量浓度的表示方法,理解溶解度、质量分数等概念,并能进行有关计算。
3.掌握一定物质的量浓度溶液的配制方法并能进行误差分析。
考点一 物质的量浓度1.溶液组成的两种表示方法内容物质的量浓度溶质质量分数含义表示________________里所含溶质B 的物质的量,符号为______用______质量与______质量的比值来表示溶液组成的物理量,一般用________表示表达式 c B =______w (B)=________×100%单位 无 相互转化 c =____________(ρ的单位为g·cm -3)2.物质的量浓度计算的两要素 (1)正确判断溶质①与水发生反应生成新物质:Na 、Na 2O 、Na 2O 2――→水________;CO 2、SO 2、SO 3――→水对应__________、________、________。
②特殊物质:NH 3――→水________(溶质按NH 3进行计算)。
③含结晶水的物质:CuSO 4·5H 2O 、Na 2CO 3·10H 2O ――→水对应________、________。
(2)确定溶液体积:溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V =m (溶液)ρ(溶液)求算。
3.溶液的稀释与混合 (1)溶液的稀释①溶质的质量在稀释前后保持不变,即m 浓w 浓=m 稀w 稀,溶液的质量m 稀=m 浓+m 水; ②溶质的物质的量在稀释前后保持不变,即c 稀V 稀=c 浓V 浓,但溶液的体积V 稀≠V 浓+V 水。
(2)溶液(溶质相同)的混合①物质的量浓度不同(分别为c 1、c 2)的两溶液:混合前后溶质的物质的量保持不变,即c 1V 1+c 2V 2=c 混V 混。




1.物质的量浓度(1)概念物质的量浓度表示单位体积的溶液里所含溶质B 的物质的量,也称为B 的物质的量浓度,符号为c B 。
(2)表达式:c B =n B V ,变形: n B =c B ·V ;V =n Bc B。
(3)常用单位:mol·L -1或mol·m -3,有时也用mmol·L -1。
(4)特点:对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数均不变,但所含溶质的质量、物质的量因体积不同而改变。
2.溶质的质量分数【易错】1.正确判断溶液的溶质并计算其物质的量(1)与水发生反应生成新的物质,如Na 、Na 2O 、Na 2O 2――→水NaOH ;SO 3――→水H 2SO 4;NO 2――→水HNO 3。
(2)特殊物质:如NH 3溶于水后溶质为NH 3·H 2O ,但计算浓度时仍以NH 3作为溶质。
(3)含结晶水的物质:CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
01 了解物质的量浓度的概念。
2.准确计算溶液的体积c =nV 中的V 是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和,不能用水的体积代替溶液的体积,应根据V =mρ计算。
.1.1 mol·L -1的NaCl 溶液是指此溶液中含有1 mol Na +( )2.从100 mL 5 mol·L -1 H 2SO 4溶液中取出了10 mL ,所得硫酸的物质的量浓度为0.5 mol·L -1( )3.将62 g Na 2O 溶于水中,配成1 L 溶液,所得溶质的物质的量浓度为1 mol·L -1( )4.0.5 mol·L -1的稀硫酸中,c (H +)为1.0 mol·L -1( )5.将25 g CuSO 4·5H 2O 晶体溶于75 g 水中所得溶质的质量分数为25%( )6.用100 mL 水吸收0.1 mol HCl 气体所得溶液的物质的量浓度恰好是1 mol·L -1( )7.1 L 水中溶解5.85 g NaCl 所形成的溶液的物质的量浓度是0.1 mol·L -1( )答案 1.× 2.× 3.× 4.√ 5.× 6.× 7.×一、物质的量浓度与质量分数的计算1.将标准状况下的a L 氯化氢气体溶于100 g 水中,得到的盐酸的密度为b g ·mL -1,则该盐酸的物质的量浓度(mol ·L -1)是( )A.a22.4 B.ab 22 400 C. 1 000ab2 240+36.5aD.ab 22 400+36.5a【答案】 C 【解析】 n (HCl)=a22.4 mol ,m (溶液)=(36.5a 22.4+100)g ,V (溶液)=(36.5a 22.4+100)g÷(b g·mL -1×1 000 mL·L -1),则该盐酸的物质的量浓度=n (HCl )V (溶液)=1 000ab2 240+36.5amol·L -1。



化学高三复习第一章认识化学科学第4讲 物质的量浓度及溶液的配制1.宏观辨识与微观探析:由宏观数据——溶液的体积、物质的量浓度与溶质微粒数目的关系多视角层次地认识溶液。
2.科学探究与创新意识:从实验实际出发,设计配制一定物质的量浓度溶液的方案,分析实验过程中存在的误差问题,发展学生的实验探究意识与批判意识。
1.了解溶液的含义。
2.了解溶解度、饱和溶液的概念。
3.了解溶液浓度的表示方法。
理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
4.掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
一、物质的量浓度及相关计算(1)物质的量浓度单位体积mol·L -11.溶液组成的两种表示方法(2)质量分数⑵溶质的浓度和离子的浓度不一定相同,要依据化学式进行分析计算。
如:0.5 mol·L -1Al 2(SO 4)3溶液中, c (Al 3+)=0.5 mol·L -1×2=1.0 mol·L -1、c (SO 42-)=0.5 mol·L -1×3=1.5 mol·L -12、溶液的特征⑴从一定物质的量浓度溶液中取出任意体积的溶液,其浓度相同、所含溶质的物质的量不同。
⑶溶液具有电中性,阳离子所带的正电荷总数之和等于阴离子所带的负电荷总数之和。
3、物质的量浓度及计算①正确判断溶液的溶质②准确计算溶液的体积中的V是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和,不能用水的体积代替溶液的体积,应根据计算。
思考:1体积水能溶解500体积的氯化氢气体(标况下),形成的溶液的密度为ρ g•cm-3的盐酸溶液,试求得到的盐酸溶液的物质的量浓度c。
⑴概念:在一定温度下,某固体物质在100 g 溶剂(通常是水)里达到饱和状态时所溶解的质量,叫做这种物质在该溶剂里的溶解度,其单位为“g”。
4、固体溶解度m S 100 g m 溶质溶剂=。


