玻璃
- 格式:doc
- 大小:76.50 KB
- 文档页数:6

建筑装饰材料-玻璃建筑装饰材料-玻璃玻璃是一种常见的建筑装饰材料,具有透明、耐久、美观等特点。
本文将详细介绍玻璃的种类、用途、制作工艺及施工要点等内容,旨在为建筑装饰领域的从业者提供参考和指导。
一、玻璃种类及特点1. 硅酸盐玻璃:是一种常用的透明玻璃,具有较高的透光性和抗压性能,广泛应用于建筑中。
其特点是抗酸碱性强,不易受化学物质的侵蚀,适用于室内和室外装饰。
2. 钢化玻璃:经过特殊处理的玻璃,通过加热后迅速冷却,使其表面形成压应力,提高抗冲击、抗弯曲和抗热性能。
钢化玻璃安全性较高,一旦破裂,会裂成小颗粒而不会产生尖锐的碎片。
3. 夹层玻璃:由两层玻璃中间夹层而成,夹层材料一般为聚合物,可以增强玻璃的安全性和隔音性能。
夹层玻璃具有较好的抗冲击和安全性能,适用于高层建筑或需要防盗和隔音的场所。
4. 隔热玻璃:通过在玻璃中加入金属氧化物,可以降低热的传导和辐射,提高建筑的节能性能。
隔热玻璃在夏季可以减少室内热量的吸收,冬季可以减少室内热量的散失。
二、玻璃的用途1. 门窗:玻璃作为门窗的主要材料之一,可以实现室内外互通的效果,同时具有透光性能,让室内更加明亮。
2. 幕墙:玻璃幕墙是高层建筑的常用外观装饰,可以提供良好的隔热、隔音和防水性能。
3. 隔断:玻璃隔断在办公场所中应用广泛,既可以保持空间的通透性,又可以实现隔音效果。
4. 天花板:玻璃天花板可以增加室内采光,让空间更加明亮,同时增添美观的效果。
三、玻璃的制作工艺1. 熔化:将原材料中的石英砂、碳酸钠等加热至高温,使其熔化成液体。
2. 成型:将熔化的玻璃液流入模具中,通过冷却或挤压等方式使其成型。
3. 钢化:对已成型的玻璃进行加热处理,并迅速冷却,以增加玻璃的耐冲击性。
4. 涂层:在玻璃表面涂覆不同种类的涂料,以实现防紫外线、防反射等功能。
四、玻璃的施工要点1. 玻璃安装:根据玻璃种类的不同,采用钢架、密封胶等不同的安装方式。
注意安装时要保持玻璃与框架之间的间隙,以避免温度变化引起的开裂。

常见玻璃材料特性大全1. 硅酸钠玻璃(石英玻璃)- 主要成分:二氧化硅(SiO2)- 特性:+ 高熔点:约为1710℃+ 耐高温:可在高温环境下使用+ 耐酸碱:抗腐蚀性强+ 透明度高:光线透过性好+ 机械强度高:较硬,不易破裂+ 电绝缘性:不导电+ 高压缩强度:使用于高压环境下+ 红外透明:可用于红外光学器件2. 硼硅酸盐玻璃(波尔兰玻璃)- 主要成分:硼砂(B2O3)、二氧化硅(SiO2)- 特性:+ 较低的熔点:约为820℃+ 热膨胀系数低:抗热震性好+ 耐酸碱性较强+ 光线透过性好:可制作光学器件+ 电绝缘性+ 耐高温:款型可在高温环境下使用3. 硼硅酸盐玻璃(钠钙玻璃)- 主要成分:硼砂(B2O3)、二氧化硅(SiO2)、碳酸钠(Na2CO3)- 特性:+ 透明度高:对光线有较好的透过性+ 机械强度较高+ 电绝缘性好+ 耐热震性较差+ 耐酸碱性较差:不能与酸或碱接触4. 硼硅酸盐玻璃(硼硅酸盐光纤)- 主要成分:硼砂(B2O3)、硅酸盐(SiO2)- 特性:+ 透明度高:用于传输光信号+ 低损耗:光线传输损耗小+ 大传输带宽+ 抗电磁干扰性:光纤传输不受电磁干扰影响+ 耐高温性好:可在高温环境下使用5. 碱化铝硅酸盐玻璃(玻璃陶瓷)- 主要成分:氧化铝(Al2O3)、硅酸盐(SiO2)- 特性:+ 低熔点:约为750℃+ 高硬度+ 良好的绝热性能+ 耐热性强:可在高温环境下使用+ 耐酸碱性好+ 良好的抗磨性能以上是常见玻璃材料的特性概述,每种玻璃材料都有其独特的特点和应用领域。
在使用时,请根据具体需求选择适合的玻璃材料。
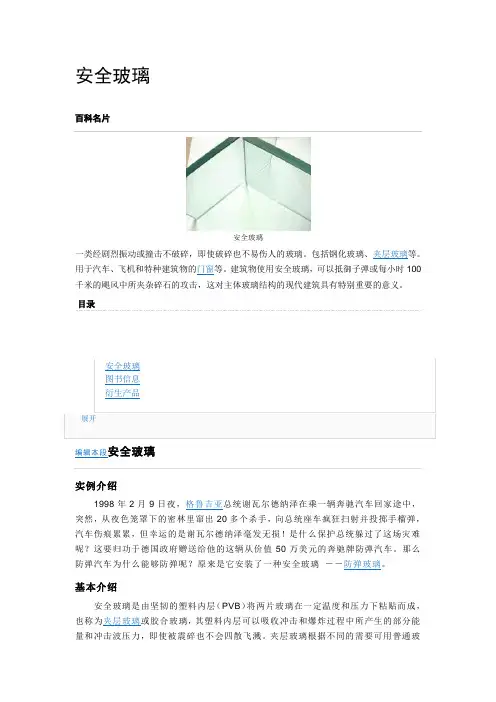
安全玻璃百科名片安全玻璃一类经剧烈振动或撞击不破碎,即使破碎也不易伤人的玻璃。
包括钢化玻璃、夹层玻璃等。
用于汽车、飞机和特种建筑物的门窗等。
建筑物使用安全玻璃,可以抵御子弹或每小时100千米的飓风中所夹杂碎石的攻击,这对主体玻璃结构的现代建筑具有特别重要的意义。
目录安全玻璃图书信息衍生产品展开编辑本段安全玻璃实例介绍1998年2月9日夜,格鲁吉亚总统谢瓦尔德纳泽在乘一辆奔驰汽车回家途中,突然,从夜色笼罩下的密林里窜出20多个杀手,向总统座车疯狂扫射并投掷手榴弹,汽车伤痕累累,但幸运的是谢瓦尔德纳泽毫发无损!是什么保护总统躲过了这场灾难呢?这要归功于德国政府赠送给他的这辆从价值50万美元的奔驰牌防弹汽车。
那么防弹汽车为什么能够防弹呢?原来是它安装了一种安全玻璃--防弹玻璃。
基本介绍安全玻璃是由坚韧的塑料内层(PVB)将两片玻璃在一定温度和压力下粘贴而成,也称为夹层玻璃或胶合玻璃,其塑料内层可以吸收冲击和爆炸过程中所产生的部分能量和冲击波压力,即使被震碎也不会四散飞溅。
夹层玻璃根据不同的需要可用普通玻璃、钢化玻璃、热增强玻璃来制成,也可制成中空玻璃。
安全玻璃具有良好的安全性,抗冲击性和抗穿透性,具有防盗、防弹、防爆功能。
针对住宅和商业区的经常发生盗窃,盗贼的目标往往是那些易于得手且不易被发现的目标。
玻璃门窗通常是受攻击的目标,安全玻璃能抵御锤子、铁棍和砖头击打,犯罪分子常用作盗窃工具的无声玻璃切割刀,可有效地阻止或延迟罪犯盗窃和强行侵人,大大提高了防范效果。
使用地点安全玻璃通常用在一些重要设施,如银行大门、贵重物品陈列柜、监狱和教养所的门窗等。
这些部位有可能遭到持各式各样凶器的群匪连续袭击。
而高强度安全玻璃能在一段时间内抵御穿透,为其他装置作出反应赢得足够的时间。
世界上一些最著名的文物,如《蒙娜丽莎》和《独立宣言》就是用安全玻璃保护的。
防弹玻璃是由多层玻璃与多层PVB中间膜粘结加工而成,它可抵御住手枪、步枪甚至炸弹爆炸的强烈冲击。

一、玻璃基础知识1.1 玻璃的概念1.1.1 玻璃的概念玻璃,英文名称Glass,在中国古代亦称琉璃,日语汉字以硝子代表。
是一种较为透明的固体物质,在熔融时形成连续网络结构,冷却过程中粘度逐渐增大并硬化而不结晶的硅酸盐类非金属材料。
普通玻璃化学氧化物的组成为Na2O•CaO•6SiO2,主要成份是二氧化硅。
玻璃在日常环境中呈化学惰性,亦不会与生物起作用,因此用途非常广泛。
玻璃一般不溶于酸(例外:氢氟酸与玻璃反应生成SiF4,从而导致玻璃的腐蚀),但溶于强碱,例如氢氧化铯。
制造工艺是将各种配比好的原料经过融化,迅速冷却,各分子因为没有足够时间形成晶体而形成玻璃。
玻璃在常温下是固体,它是一种易碎的东西,摩氏硬度6.5。
1.1.2 玻璃的历史玻璃最初由火山喷出的酸性岩凝固而得。
公元前3700年前,古埃及人已经能制造出玻璃装饰品和简单的玻璃器皿。
当时只有有色玻璃。
公元前1000 年前,中国制造出无色玻璃公元12世纪,出现了用于交换的商品玻璃,并开始成为工业材料。
18世纪,为适应研制望远镜的需要,制出光学玻璃。
1873年,比利时率先制造出平板玻璃。
1906年,美国研制出平板玻璃引上机。
1959年英国皮尔金顿玻璃公司向世界宣告平板玻璃的浮法成型工艺研制成功,这是对原来的有槽引上成型工艺的一次革命。
此后,随着玻璃生产的工业化和规模化,各种用途和各种性能的玻璃相继问世。
现代,玻璃已成为日常生活、生产和科学技术领域的重要材料之一。
1.2 玻璃的原料构成玻璃原料比较复杂,按其作用可分为主要原料与辅助原料。
主要原料构成玻璃的主体并确定玻璃的主要物理化学性质,辅助原料赋予玻璃特殊性质和给生产工艺带来方便。
1.2.1 玻璃的主要原料1、硅砂或硼砂。
硅砂或硼砂引入玻璃的主要成分是氧化硅或氧化硼,它们在燃烧中能单独熔融成玻璃主体,决定了玻璃的主要性质,相应地称为硅酸盐玻璃或硼酸盐玻璃。
2、纯碱或芒硝。
纯碱和芒硝引入玻璃的主要成分是氧化钠,它们在煅烧中能与硅砂等酸性氧化物形成易熔的复盐,起了助熔作用,使玻璃易于成型。

玻璃的基本介绍
1. 玻璃的定义:玻璃是一种非晶态固体材料,由无定形的熔融硅酸盐、氧化金属、碳酸盐等原料经过冷却而形成。
2. 玻璃的特性:玻璃具有透明、硬度高、化学稳定等特点,同时也具有不易导电、不易导热、不易燃等特点。
3. 玻璃的分类:
(1)按成分分类:石英玻璃、硼玻璃、铅玻璃、硅酸钙玻璃等。
(2)按用途分类:建筑玻璃、家具玻璃、电子玻璃、汽车玻璃等。
(3)按制作方法分类:浮法玻璃、现代玻璃、应力玻璃等。
4. 玻璃的制作:
(1)玻璃材料的准备:将氧化物、碳酸盐等原料混合,加入适当的助剂,放入玻璃熔炉中加热至熔化状态。
(2)玻璃吹制或浇铸:将熔融的玻璃直接吹制成形或在模具中浇铸成形。
(3)玻璃淬火:将制作好的玻璃加热至特定温度,然后急速冷却,以增加其强度和韧性。
5. 玻璃的应用:
(1)建筑玻璃:玻璃幕墙、窗户、隔断等。
(2)家具玻璃:玻璃桌面、玻璃门、玻璃柜等。
(3)电子玻璃:液晶显示器、太阳能板等。
(4)汽车玻璃:挡风玻璃、侧窗玻璃、后窗玻璃等。
综上所述,玻璃是一种重要的非晶态固体材料,具有透明、硬度高、化学稳定等特点,并可根据成分、用途和制作方法等多种方式进行分类。
玻璃的制作包括材料准备、吹制或浇铸以及淬火等步骤,而其应用于建筑、家具、电子设备和汽车等方面,具有极其广泛的用途。


玻璃的计算公式(最新版)目录一、玻璃的概述二、玻璃的计算公式1.面积计算公式2.体积计算公式3.密度计算公式4.折射率计算公式三、公式的应用实例四、总结正文一、玻璃的概述玻璃是一种无定形的固体物质,主要由硅酸盐类物质组成。
它在建筑、家具、日用品等领域中有着广泛的应用。
玻璃具有透明、坚硬、耐腐蚀等特点,其性质与原料、生产工艺和成分比例等因素密切相关。
二、玻璃的计算公式1.面积计算公式玻璃的面积计算公式为:面积 = 长×宽。
其中,长和宽分别表示玻璃的长度和宽度。
2.体积计算公式玻璃的体积计算公式为:体积 = 面积×厚度。
其中,面积表示玻璃的一个面的面积,厚度表示玻璃的厚度。
3.密度计算公式玻璃的密度计算公式为:密度 = 质量÷体积。
其中,质量和体积分别表示玻璃的质量和体积。
4.折射率计算公式玻璃的折射率计算公式为:折射率 = (折射角 - 入射角) ÷入射角。
其中,折射角和入射角分别表示光线在玻璃中的折射角和入射角。
三、公式的应用实例例如,一块长为 1 米、宽为 0.5 米的玻璃,其面积为 0.5 平方米;若厚度为 0.1 米,则体积为 0.05 立方米。
假设玻璃的质量为 2 千克,体积为 0.05 立方米,可以计算出其密度为 40 千克/立方米。
对于光的折射,假设光线以 45 度入射到玻璃表面,折射角为 30 度,可以计算出折射率为 0.577。
四、总结了解玻璃的计算公式有助于我们更好地了解玻璃的性质和特点,为实际应用提供依据。

玻璃
玻璃是一种无规则结构的非晶态固体,通常指硅酸盐玻璃,以石英砂、纯碱、长石及石灰石等为原料,经混和、高温熔融、匀化后,加工成形,再经退火而得。
广泛用于建筑、日用、医疗、化学、电子、仪表、核工程等领域
玻璃有很高的化学稳定性,可以抵抗除氢氟酸以外所有酸类的侵蚀,硅酸盐玻璃一般不耐碱。
在生产过程中加入不同的物质,调整玻璃的化学组成,可以制得具有不同性能和用途的玻璃。
例如,生产时向普通玻璃中加入一定量的B2O3,可制得更耐高温和抗化学腐蚀的硼酸盐玻璃,可用于制造高级的化学反应容器;加入PbO后可制得光学折射率高的铅硅酸盐玻璃,可用来制造眼镜和光学仪器的镜片;加入某些金属氧化物,可以制成彩色玻璃。
将熔融玻璃直接制成纤维,或是将熔融玻璃先制成直径20mm的玻璃球或棒,再以多种方式加热重熔后制成直径为 3~80μm的甚细纤维,都可以制得玻璃纤维。
玻璃纤维比有机纤维耐高温,不易燃,抗腐蚀性好,隔热、隔音性好,抗拉强度高,电绝缘性好。
但性脆,耐磨性较差。
其中用石英玻璃制成的玻璃纤维被称作石英玻璃纤维。
石英玻璃纤维传导光的能力特别强,所以又称为光导纤维,简称光纤。
将很多经过技术处理的光纤绕在一起就得到了光缆。
光缆能同时传输大量信息,并且抗干扰性能好,通信质量高,还可以防窃听,此外,光缆的质量小且细,耐腐蚀,铺设也很方便,所以光缆被大量运用于通信医疗、医疗、信息处理、传能传向、遥测遥控和照明等多个方面。

一、玻璃:
一种较为透明的固体物质,在熔融时形成连续网络结构,冷却过程中粘度逐渐增大并硬化而不结晶的硅酸盐类非金属材料。
1、特点:
一种透明、强度及硬度颇高,不透气的物料。
玻璃在日常环境中呈化学惰性,也不会与生物起作用,故此用途非常广泛。
玻璃一般不溶于酸,但溶于强碱。
2、性质:
在常温下是固体,它是一种易碎的东西。
摩氏硬度为6.5 玻璃其实是液体。
当液体冷却之后,原先动荡而纷乱的分子最终会形成有序、固定的晶体结构。
3、应用:
广泛用于建筑、日用、医疗、化学、电子、仪表、核工程等领域。
其他玻璃:
玻璃砖:
二、陶瓷:
1、特点:
陶瓷材料一般硬度较高,但可塑性较差。
完全不吸水且耐高温耐腐蚀。
陶瓷原料是地球原有的大量资源黏土经过淬取而成。
而粘土的性质具韧性,常温遇水可塑,微干可雕,全干可磨;
2、性质:
陶瓷材料的成份主要是氧化硅、氧化铝、氧化钾、氧化钠、氧化钙、氧化镁、氧化铁、氧化钛等。
常见的陶瓷原料有粘土、石英、钾钠长石等。
烧至
900度可成陶器能装水;烧至1230度则瓷化,
3、应用:
在食器、装饰的使用上,在科学、技术的发展中亦扮演重要角色。
其用法之弹性,在今日文化科技中尚有各种创意的应用。
外墙面砖
内墙面砖
地砖。


玻璃的物理知识点总结1. 玻璃的结构特点玻璃的结构特点是其非晶态结构。
在晶体结构中,原子或分子按照一定的规则排列,而在非晶体结构中,原子或分子的排列无序,没有明显的晶格结构。
这使得玻璃呈现出均匀、透明的外观,并且具有良好的光学性能。
玻璃的非晶态结构也使得其具有较高的抗拉强度和抗冲击性,是一种较为牢固的材料。
2. 玻璃的光学性质玻璃具有较好的透明性和折射性能。
在入射光线垂直于玻璃表面时,玻璃的折射率大约为1.5左右,这使得光线可以在玻璃内部进行传播,呈现出较好的透明性。
同时,玻璃的折射率变化范围较大,这也为制备各种光学器件提供了基础条件。
此外,玻璃还具有较好的光学均匀性和抗老化性能,可以长时间保持良好的光学性能。
3. 玻璃的热学性质玻璃在一定温度范围内呈现出较好的热稳定性。
一般情况下,玻璃的软化温度约为600-800摄氏度,而玻璃的熔化温度约为1000-1500摄氏度。
这使得玻璃可以在一定温度范围内进行加工和应用。
同时,玻璃的线膨胀系数较小,热膨胀性能较好,不易受温度变化的影响。
4. 玻璃的力学性质玻璃具有较高的硬度和抗拉强度。
一般情况下,玻璃的硬度在5-7摩氏硬度之间,这使得玻璃可以抵御一定程度的划伤和磨损。
同时,玻璃的抗拉强度和弯曲强度也较高,一般情况下可以承受较大的力学载荷。
综上所述,玻璃作为一种非晶体固体材料,具有一系列独特的物理性质和特点,这使得其在各个领域具有广泛的应用价值。
通过对玻璃结构的理解,可以更好地掌握玻璃的制备、加工和应用技术,为玻璃的进一步研究和开发提供了基础条件。
同时,玻璃的物理性质也为其在建筑、光学、仪器等领域的应用提供了理论支持和技术保障。
希望本文对于玻璃的物理知识有所帮助,欢迎批评指正。
玻璃定义:熔融后冷却至固态未析晶的无定形物质。
一种较为透明的固体物质,在熔融时形成连续网络结构,冷却过程中粘度逐渐增大并硬化而不结晶的硅酸盐类非金属材料。
普通玻璃化学氧化物的组成(Na2O·CaO·6SiO2),主要成份是二氧化硅。
广泛应用于建筑物,用来隔风透光,属于混合物。
玻璃是一种无规则结构的非晶态固体,其原子不像晶体那样在空间具有长程有序的排列,而近似于液体那样具有短程有序。
玻璃像固体一样保持特定的外形,不像液体那样随重力作用而流动。
玻璃具有四项基本通性:(1)各向同性:玻璃的原子排列是无规则的,其原子在空间中具有统计上的均匀性。
在理想状态下,均质玻璃的物理、化学性质(如折射率、硬度、弹性模量、热膨胀系数、导热率、电导率等)在各方向都是相同的。
(2)无固定熔点:玻璃由固体转变为液体是一定温度区域(即软化温度范围)内进行的,它与结晶物质不同,没有固定的熔点。
软化温度范围Tg~T1,Tg为转变温度,T1为液相线温度,对应的黏度分别为10dPa·s、10 dPa·s。
(3)介稳性:玻璃态物质一般是由熔融体快速冷却而得到,从熔融态向玻璃态转变时,冷却过程中黏度急剧增大,质点来不及做有规则排列而形成晶体,没有释出结晶潜热,因此,玻璃态物质比结晶态物质含有较高的内能,其能量介于熔融态和结晶态之间,属于亚稳状态。
从力学观点看,玻璃是一种不稳定的高能状态,比如存在低能量状态转化的趋势,即有析晶倾向,所以,玻璃是一种亚稳态固体材料。
(4)渐变性与可逆性:玻璃态物质从熔融态到固体状态的过程是渐变的,其物理、化学性质的变化也是连续的和渐变的。
这与熔体的结晶过程明显不同,结晶过程必然出现新相,在结晶温度点附近,许多性质会发生突变。
而玻璃态物质从熔融状态到固体状态是在较宽温度范围内完成的,随着温度逐渐降低,玻璃熔体黏度逐渐增大,最后形成固态玻璃,但是过程中没有新相形成。
相反玻璃加热变为熔体的过程也是渐变的。
各种玻璃特性详细介绍玻璃是一种非晶态无机非金属材料,具有独特的特性和广泛的应用领域。
下面将详细介绍玻璃的各种特性。
1.透明性:玻璃具有良好的透明性,可以透过可见光谱范围内的大部分光线,使室内外景色清晰可见,同时也为人们提供了充足的自然光照。
2.硬度:玻璃的硬度较高,具有一定的耐刮擦性能,不容易被表面物体划伤。
3.耐化学性:玻璃对大部分化学物质具有较好的耐腐蚀性能,不易受酸、碱腐蚀,因此常用于储存和盛装化学物质。
4.耐热性:玻璃具有较高的耐热性,能够在高温下保持结构的完整性和稳定性,不易熔化、软化或变形。
5.导电性:一些特殊类型的玻璃,如导电玻璃,具有优良的导电性能,可被用作导电板或触摸屏等电子器件的基底。
6.绝缘性:一般的玻璃具有很高的绝缘性能,可以有效阻隔电流的流动,不易导电。
7.吸音性:玻璃表面的平整度对声音具有一定的吸收能力,能够减少室内外噪音的传递和反射。
8.抗紫外线:玻璃能够吸收或反射大部分紫外线辐射,起到一定的防晒作用,保护人体免受紫外线的伤害。
9.可塑性:在一定温度范围内,玻璃具有一定的可塑性,可以通过热加工或冷加工改变其形状。
10.易加工性:玻璃制品可以通过切割、打磨、抛光、冷加工等多种工艺进行加工,制成不同形状和尺寸的成品。
11.耐磨性:玻璃具有较好的耐磨性,不容易被表面摩擦或磨损。
12.环保性:玻璃是一种可重复利用和回收的无害材料,可以降低环境污染和资源消耗。
13.光学性能:玻璃具有良好的光学性能,如折射、透射、反射等,可以用于制造光学仪器、光学镜片等。
14.物理稳定性:玻璃的化学成分稳定,在一般的自然环境下不易发生变化和分解。
总之,玻璃因其独特的特性成为一种广泛应用的材料,被用于建筑、家具、电子、光学、化学等领域,并且随着现代科技的发展和创新,不断出现各种新型玻璃,如夹层玻璃、电触摸屏玻璃、防弹玻璃等,拓展了玻璃的应用领域和功能。
浙江大学材料系3 玻璃体1、说明熔体中聚合物形成过程?答:聚合物的形成是以硅氧四面体为基础单位,组成大小不同的聚合体。
可分为三个阶段初期:石英的分化;中期:缩聚并伴随变形;后期:在一定时间和一定温度下,聚合和解聚达到平衡。
2、简述影响熔体粘度的因素?答:影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
3、SiO2熔体中随着Na2O加入量的不同,粘度如何变化,为什么?SiO2熔体中加入Na2O,粘度随着Na2O增多,使O/Si值上升,m下降,[SiO4]从网络变成孤岛状,粘度迅速下降。
4、名词解释(并比较其异同)⑴晶子学说和无规则网络学说⑵单键强⑶分化和缩聚⑷网络形成剂和网络变性剂答:⑴晶子学说:玻璃内部是由无数“晶子”组成,微晶子是带有晶格变形的有序区域。
它们分散在无定形介中质,晶子向无定形部分过渡是逐渐完成时,二者没有明显界限。
无规则网络学说:凡是成为玻璃态的物质和相应的晶体结构一样,也是由一个三度空间网络所构成。
这种网络是由离子多面体(三角体或四面体)构筑起来的。
晶体结构网是由多面体无数次有规律重复构成,而玻璃中结构多面体的重复没有规律性。
⑵单键强:单键强即为各种化合物分解能与该种化合物配位数的商。
⑶分化过程:架状[SiO4]断裂称为熔融石英的分化过程。
缩聚过程:分化过程产生的低聚化合物相互发生作用,形成级次较高的聚合物,次过程为缩聚过程。
⑷网络形成剂:正离子是网络形成离子,对应氧化物能单独形成玻璃。
即凡氧化物的单键能/熔点﹥0.74kJ/mol.k 者称为网络形成剂。
网络变性剂:这类氧化物不能形成玻璃,但能改变网络结构,从而使玻璃性质改变,即单键强/熔点﹤0.125kJ/mol.k者称为网络变形剂。
5、试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?答:利用X—射线检测。
晶体SiO2—质点在三维空间做有规律的排列,各向异性。
SiO2熔体—内部结构为架状,近程有序,远程无序。
SiO2玻璃—各向同性。
硅胶—疏松多孔。
6、玻璃的组成是13wt%Na2O、13wt%CaO、74wt%SiO2,计算桥氧分数?解:Na2O CaO SiO2wt% 13 13 74mol 0.21 0.23 1.23mol% 12.6 13.8 73.6R=(12.6+13.8+73.6 ×2)/ 73.6=2.39∵Z=4 ∴X=2R﹣Z=2.39×2﹣4=0.72Y=Z﹣X= 4﹣0.72=3.28氧桥%=3.28/(3.28×0.5+0.72)=69.5%7、有两种不同配比的玻璃,其组成如下:试用玻璃结构参数说明两种玻璃高温下粘度的大小?解:对于1:Z=4 R1=O/Si=2.55∴ X1=2R1﹣4=1.1 Y1=Z﹣X1= 4﹣1.1=2.9对于2:R2= O/Si=2.45∴ X2=2R2﹣4=0.9 Y2= 4﹣X2= 4﹣0.9=3.1∵Y1﹤Y2∴序号1的玻璃组成的粘度比序号2的玻璃小。
的熔体,要加热到什么温度?解:根据lnη=A+B/T,727℃时,η=108P0,1156℃时,η=104P0,∴A=-5.32,B=13324,当η=107P0时,则t=80℃。
10、在Na2O—SiO2系统及RO—SiO2系统中随着SiO2含量的增加,熔体的粘度将升高而表面张力则降低,说明原因。
解:Na2O-SiO2系统中,SiO2含量增加,η增大,ς减小;因为SiO2含量增加,聚合离子团尺寸增大,迁移阻力增大,η增大,e/r减小,相互作用力减小,ς减小;RO-SiO2系统中,SiO2含量增加,η增大,ς减小;因为无SiO2时RO-O2系统η很低,表面张力大;加入SiO2,系统中出现聚合离子团,SiO2增加,聚合离子团尺寸增大,数目增大,η增大,ς减小。
11、简述硅酸盐晶体结构分类的原则,及其各类硅酸盐晶体结构的特点。
答:硅酸盐晶体结构分类是按[SiO4]四面体的连接方式进行分类,分为岛状、组群状、链状、层状和架状。
各类硅酸盐晶体结构特点参见表3-1。
12、试从结构上比较硅酸盐晶体和硅酸盐玻璃的区别。
3、硅酸盐玻璃在结构上与相应的硅酸盐晶体有显著的区别:(1)在晶体中,[SiO4]按一定的对称规律排列;在玻璃中则是无序的。
(2)在晶体中,骨架外的M+或M2+金属阳离子占据了点阵的固定位置;在玻璃中则是统计均匀地分布在骨架的空腔内,并起着平衡非桥氧负电荷的作用。
(3)在晶体中,只有当骨架外的阳离子半径相近时,才能发生同晶置换;在玻璃中则不论半径如何,只要遵守静电价规则,骨架外阳离子均能发生相互置换。
(4)在晶体中(除固溶体外),氧化物之间有固定的化学计量;在玻璃中氧化物可以非化学计量的任意比例混合。
13、在SiO2中应加入多少Na2O,使玻璃的O/Si=2.5,此时析晶能力是增强还是削弱?解:设加入x mol的Na2O,而SiO2的量为y mol。
则O/Si=(x+2y)/ y =2.5∴x=y/2 即二者的物质量比为1:2时,O/Si=2.5。
因为O/Si增加了,粘度下降,析晶能力增强了。
14、有一种平板玻璃组成为14Na2O—13CaO—73SiO2(wt%重量百分比),其密度为2.5g/cm3,计算玻璃的原子堆积系数(AFP)为多少?计算该玻璃的结构参数值?解:该玻璃的平均分子量GM=0.14×62+0.13×56+0.73×60.02=59.77在1Å3中原子数为n=ρNo/GM=2.5×10-24×6.02×1023/59.77 =0.252个/Å3在1Å3原子所占体积V=0.0252×4/3π[0.14×2×0.983+0.13×1.063+0.73×0.393+(0.14+0.13+0.73×2)×1.323]=0.4685∴AFP=0.46结构参数:Na2O CaO SiO2wt% 14 13 73mol 0.23 0.23 1.22mol% 13.7 13.7 72.6R=(13.7+13.7+72.6 ×2)/ 72.6=2.38∵Z=4 ∴X=2R﹣Z=2.38×2﹣4=0.76Y=Z﹣X= 4﹣0.76=3.2415、说明在一定温度下同组成的玻璃比晶体具有较高的内能及晶体具有一定的熔点而玻璃体没有固定熔点的原因。
解:玻璃的介稳性:熔体转变为玻璃过程中,是快速冷却,使玻璃在低温下保留了高温时的结构状态,玻璃态是能量的介稳态,有自发放热而转变为晶体的趋势;玻璃无固定熔点:熔体结晶过程中,系统必有多个相出现,有固定熔点;熔体向玻璃体转变时,其过程是渐变的,无多个相出现,无固定的熔点,只有一个转化温度范围。
16、某窗玻璃含14Na2O-14CaO-72SiO2(重量百分数),求非桥氧百分数。
17、网络外体(如Na2O)加到SiO2熔体中,使氧硅比增加,当O/Si≈2.5~3时,即达到形成玻璃的极限,O/Si>3时,则不能形成玻璃,为什么?解:在熔体结构中,不O/Si比值对应着一定的聚集负离子团结构,如当O/Si比值为2时,熔体中含有大小不等的歪扭的[SiO2]n聚集团(即石英玻璃熔体);随着O/Si比值的增加,硅氧负离子集团不断变小,当O/Si比值增至4时,硅-氧负离子集团全部拆散成为分立状的[SiO4]4-,这就很难形成玻璃。
18、按照在形成氧化物玻璃中的作用,把下列氧化物分为网络变体,中间体和网络形成体:SiO2,Na2O,B2O3,CaO,Al2O3,P2O5,K2O,BaO。
解:网络变体Na2O CaO K2O BaO 中间体Al2O3网络形成体SiO2 B2O3 P2O519、试述微晶学说与无规则网络学说的主要观点,并比较两种学说在解释玻璃结构上的共同点和分歧。
解:微晶学说:玻璃结构是一种不连续的原子集合体,即无数“晶子”分散在无定形介质中;“晶子”的化学性质和数量取决于玻璃的化学组成,可以是独立原子团或一定组成的化合物和固溶体等微晶多相体,与该玻璃物系的相平衡有关;“晶子”不同于一般微晶,而是带有晶格极度变形的微小有序区域,在“晶子”中心质点排列较有规律,愈远离中心则变形程度愈大;从“晶子”部分到无定形部分的过渡是逐步完成的,两者之间无明显界限。
无规则网络学说:玻璃的结构与相应的晶体结构相似,同样形成连续的三维空间网络结构。
但玻璃的网络与晶体的网络不同,玻璃的网络是不规则的、非周期性的,因此玻璃的内能比晶体的内能要大。
由于玻璃的强度与晶体的强度属于同一个数量级,玻璃的内能与相应晶体的内能相差并不多,因此它们的结构单元(四面体或三角体)应是相同的,不同之处在与排列的周期性。
微晶学说强调了玻璃结构的不均匀性、不连续性及有序性等方面特征,成功地解释了玻璃折射率在加热过程中的突变现象。
网络学说强调了玻璃中离子与多面体相互间排列的均匀性、连续性及无序性等方面结构特征。
20、试比较硅酸盐玻璃与硼酸盐玻璃在结构与性能上的差异。
答:结构差异:硅酸盐玻璃:石英玻璃是硅酸盐玻璃的基础。
石英玻璃是硅氧四面体[SiO4]以顶角相连而组成的三维架状结构。
由于Si—O—Si键角变动范围大,使石英玻璃中[SiO4]四面体排列成无规则网络结构。
SiO2是硅酸盐玻璃中的主要氧化物。
硼酸盐玻璃:B和O交替排列的平面六角环的B—O集团是硼酸盐玻璃的重要基元,这些环通过B—O—B链连成三维网络。
B2O3是网络形成剂。
这种连环结构与石英玻璃硅氧四面体的不规则网络不同,任何O—B三角体的周围空间并不完全被临接的三角体所填充,两个原子接近的可能性较小。
性能差异:硅酸盐玻璃:试剂和气体介质化学稳定性好、硬度高、生产方法简单等优点。
硼酸盐玻璃:硼酸盐玻璃有某些优异的特性。
例如:硼酐是唯一能用以制造有吸收慢中子的氧化物玻璃;氧化硼玻璃的转化温度比硅酸盐玻璃低得多;硼对中子射线的灵敏度高,硼酸盐玻璃作为原子反应堆的窗口对材料起屏蔽中子射线的作用。
21、解释硼酸盐玻璃的硼反常现象?答:硼反常现象:随着Na2O(R2O)含量的增加,桥氧数增大,热膨胀系数逐渐下降。
当Na2O含量达到15%—16%时,桥氧又开始减少,热膨胀系数重新上升,这种反常现象就是硼反常现象。
硼反常现象原因:当数量不多的碱金属氧化物同B2O3一起熔融时,碱金属所提供的氧不像熔融SiO2玻璃中作为非桥氧出现在结构中,而是使硼转变为由桥氧组成的硼氧四面体。
致使B2O3玻璃从原来二度空间层状结构部分转变为三度空间的架状结构,从而加强了网络结构,并使玻璃的各种物理性能变好。