化学平衡常数(K)全解
- 格式:ppt
- 大小:1.46 MB
- 文档页数:27




化学平衡常数kc计算《化学平衡常数Kc计算》同学们,今天咱们来唠唠化学平衡常数Kc的计算。
不过呢,在这之前,咱们得先把一些基础概念弄明白,就像盖房子得先打地基一样。
咱们先说说化学平衡。
这化学平衡啊,就好比是一场拔河比赛。
反应物和生成物呢,就像两队人。
在比赛开始的时候啊,两边的力量可能不一样,就像化学反应刚开始的时候,正反应和逆反应的速率不一样。
但是随着比赛进行呢,总会有个时候,两边的力量相等了,绳子就不动了,这就相当于在化学反应里,正反应速率和逆反应速率相等了。
而且啊,这时候两边的人数也不再变了,在化学里就是反应物和生成物的浓度不再变化了,这个状态就是化学平衡。
那化学键又是啥呢?咱们可以把化学键想象成原子之间的小钩子。
离子键就像是带正电和带负电的原子,它们就像超强磁铁一样吸在一起。
比如说氯化钠,钠原子失去一个电子带正电,氯原子得到一个电子带负电,这两个原子就像磁铁两极一样紧紧吸住,这就是离子键。
共价键呢,是原子共用小钩子连接。
就像两个人共同拉着一个东西,谁也不松手,像氢气分子,两个氢原子共用一对电子,就靠这个共价键结合在一起了。
分子的极性也很有趣。
咱们可以把它类比成小磁针。
比如说水,水是极性分子,氧一端就像磁针的南极,带负电,氢一端就像北极,带正电。
而二氧化碳呢,它是直线对称的,就像两边完全一样,是个非极性分子,就像一个没有极性的小棒,两边都一样,不存在像小磁针那样有正负电分布不均匀的情况。
还有配位化合物,这个概念有点绕,不过咱们一比喻就好理解了。
中心离子就像是聚会的主角,周围的配体呢,就像是提供孤对电子共享的小伙伴。
比如说在[Cu(NH₃)₄]²⁺这个配位化合物里,铜离子就是主角,氨分子就是小伙伴,氨分子把自己的孤对电子拿出来和铜离子共享,就像小伙伴把自己的好东西拿出来和主角分享一样。
再说说氧化还原反应中的电子转移。
这就像做买卖一样,比如说锌和硫酸铜反应。
锌原子就像一个慷慨的卖家,把自己的电子给了铜离子这个买家。


化学平衡常数及其计算【知识精讲】1.化学平衡常数(1)平衡常数只与温度有关,与反应物或生成物的浓度、反应速率无关,但与转化率有关。
反应物或生成物中有固体或纯液体时,由于其浓度可看作“1”而不代入平衡常数公式。
(2)化学平衡常数是指在一定温度下,某一具体的可逆反应的平衡常数。
若反应方向改变,则平衡常数也改变;若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也改变。
(3)平衡常数越大,反应向右进行的程度越大。
化学平衡常数与转化率紧密相联。
定性来讲,K 值越大,反应物的转化率越大,反应进行的程度越大;定量来讲,转化率的计算离不开化学平衡常数,可以通过平衡常数表达式求得平衡时物质的物质的量浓度,从而求得转化率。
(4)浓度商Q与平衡常数K的关系:①Q>K,反应向逆反应方向进行;②Q=K,反应处于平衡状态;③Q<K,反应向正反应方向进行。
2.有关化学反应速率及平衡的计算,如果不能一步得出答案,一般可用“三部曲”(始态、反应、终态)进行求解,但应该注意:(1)参加反应消耗或生成的各物质的浓度比一定等于化学方程式中对应物质的化学计量数之比,由于始态时,是人为控制的,故不同物质的始态、终态各物质的量的比值不一定等于化学方程式中的化学计量数之比;若反应物始态时各反应物的浓度成计量数比,则各反应物的转化率相等,且终态时,反应物的浓度也成计量数比。
(2)始态、反应、终态中的物理量要统一,要么都用物质的量,要么都用物质的量浓度,要么都用气体的体积。
(3)计算化学平衡常数时,一定要运用各物质的“平衡浓度”来计算,且勿利用各物质的“物质的量”或“非平衡时的浓度”进行计算。
(4)平衡常数的表达式与方程式的书写形式有关,对于同一个反应,当化学方程式中的计量数发生变化时,平衡常数的数值及单位均发生变化,当方程式逆写时,平衡常数是原平衡常数的倒数。
【经典例析】例1. (1) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g)其化学平衡常数K和温度T的关系如下表:T/℃700 800 830 1000 1200K 0.6 0.9 1.0 1.7 2.6①该反应的化学平衡常数表达式为K= 。
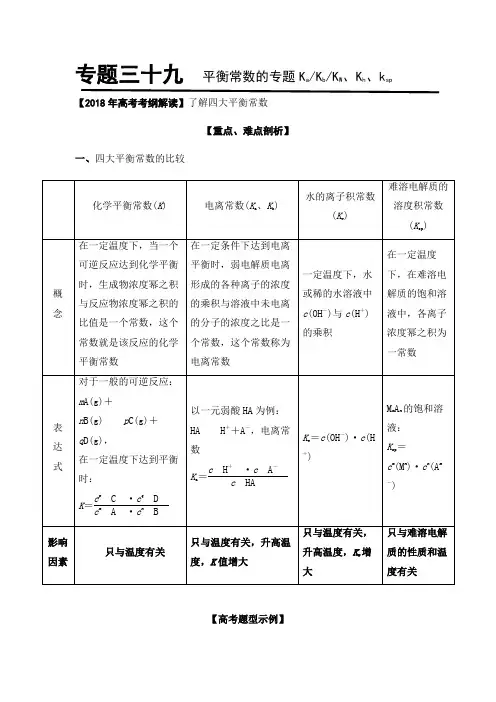
专题三十九平衡常数的专题K a/K b/K W、K h、k sp 【2018年高考考纲解读】了解四大平衡常数【重点、难点剖析】一、四大平衡常数的比较对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=c p C·c q Dc m A·c n B以一元弱酸HA为例:HA H++A-,电离常数Ka=c H+·c A-c HA【高考题型示例】例1、(2018全国III卷)用0.100 mol·L-1 AgNO滴定50.0 mL 0.05003mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是()(AgCl)的数量级为10-10A.根据曲线数据计算可知KspB.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K(AgCl)spC.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【解析】A.选取横坐标为50mL的点,此时向50mL 0.05mol/L的Cl-溶液中,溶液,所以计算出此时溶液中过量的Ag+浓度为加入了50mL 0.1mol/L的AgNO30.025mol/L(按照银离子和氯离子1:1沉淀,同时不要忘记溶液体积变为原来(AgCl)约2倍),由图示得到此时Cl-约为1×10-8mol/L(实际稍小),所以KSP为0.025×10-8=2.5×10-10,所以其数量级为10-10,选项A正确。
(AgCl)极小,所以向溶液滴加硝酸银就会有沉淀析出,溶液一直是B.由于KSP氯化银的饱和溶液,所以c(Ag+)·c(Cl-)=K(AgCl),选项B正确。
SPC.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a点对应的是15mL,选项C错误。

各种平衡常数之间的关系平衡常数是化学反应中描述反应平衡程度的指标,它们之间存在着一定的关系。
在本文中,我们将探讨各种平衡常数之间的关系。
我们来介绍平衡常数的概念。
平衡常数(K)是指在给定温度下,反应物和生成物的浓度之比的稳定值。
在化学反应中,平衡常数越大,表示生成物的浓度相对较高,反应趋向右侧;平衡常数越小,表示反应物的浓度相对较高,反应趋向左侧。
一、浓度平衡常数和压力平衡常数在气相反应中,我们通常使用压力来描述气体浓度。
浓度平衡常数(Kc)是指反应物和生成物浓度之比的稳定值,而压力平衡常数(Kp)是指反应物和生成物分压之比的稳定值。
它们之间的关系可以通过理想气体状态方程推导得出。
二、溶解度平衡常数和离子积在溶液中,溶解度平衡常数(Ksp)是指溶解物的溶解度的稳定值,也可以看作是反应物和生成物的浓度之比的稳定值。
离子积是指溶液中各离子浓度的乘积,也是反应物和生成物离子浓度之比的稳定值。
它们之间存在着一定的关系,可以通过溶解度平衡常数和离子浓度之间的关系推导得出。
三、酸碱平衡常数和pH值酸碱平衡常数(Ka或Kb)是指酸或碱的解离常数,它描述了酸或碱在溶液中的离解程度。
pH值是指溶液的酸碱性的负对数,用来描述溶液中氢离子的浓度。
酸碱平衡常数和pH值之间存在着一定的关系,可以通过酸碱平衡常数和氢离子浓度之间的关系推导得出。
四、氧化还原平衡常数和电位氧化还原平衡常数(K)是指氧化还原反应中电子转移的稳定值,它描述了氧化还原反应的进行程度。
电位是指溶液中电子的流动方向和速率,用来描述氧化还原反应的进行程度。
氧化还原平衡常数和电位之间存在着一定的关系,可以通过氧化还原平衡常数和电子转移方向之间的关系推导得出。
通过以上的介绍,我们可以看出各种平衡常数之间存在着一定的关系。
这些关系反映了不同反应类型之间的相互作用和平衡状态的变化,对于理解化学反应的平衡过程具有重要的意义。
同时,通过研究这些关系,我们可以更好地预测和控制化学反应,为实际应用提供理论基础。

化学平衡常数的概念和含义化学平衡常数是描述化学反应平衡的一个重要物理量,它是在一定温度下,化学反应达到平衡时,反应物和生成物浓度(或者是压力)的比值的一个恒定值。
平衡常数的大小和反应的速率无关,而只与反应物种类和温度有关。
本文将介绍化学平衡常数的概念和含义,并探讨它在化学反应中的重要性。
一、化学平衡和平衡常数在化学反应中,当反应开始进行后,反应物逐渐消耗,生成物逐渐增加,直到达到一种相对稳定的状态,这种状态被称为化学平衡。
在平衡状态下,反应物和生成物之间的浓度或者压力保持不变,但反应仍会继续进行,只是反应速率相互之间相等,处于动态平衡的状态。
化学平衡常数K是描述化学反应平衡的定量指标。
对于一般的化学反应aA + bB ↔ cC + dD,平衡常数K的表达式为K = [C]^c[D]^d /[A]^a[B]^b ,其中[A]、[B]、[C]、[D]分别表示反应物和生成物的浓度。
二、平衡常数的含义1. 平衡常数的大小决定了反应的方向当K>1时,平衡常数较大,表示在平衡时生成物浓度较高,反应偏向生成物的一方;而当K<1时,平衡常数较小,表示在平衡时反应物浓度较高,反应偏向反应物的一方。
当K=1时,反应物和生成物的浓度相等,反应处于平衡状态。
2. 温度对平衡常数的影响平衡常数K随温度的变化而变化,在不同温度下反应的平衡位置可能发生变化。
根据Le Chatelier原理,当温度升高时,反应向吸热方向移动以补偿其附近的热量;而当温度降低时,反应向放热方向移动以补偿其附近的热量。
因此,温度的改变会影响平衡常数的值。
3. 平衡常数与反应速率无关平衡常数只与反应物和生成物的浓度有关,而与反应的速率无关。
即使某个反应速率很快,但若平衡常数很小,则反应在达到平衡时生成物浓度仍然很低;反之,若平衡常数很大,则反应在达到平衡时生成物浓度较高。
三、应用举例1. 酸碱中和反应的平衡常数酸碱中和反应是化学中常见的反应类型,它们的平衡常数被称为酸解离常数Ka和碱解离常数Kb。

化学平衡与标准平衡常数(最新)引言化学平衡是化学领域中的一个核心概念,它描述了在一定条件下,化学反应达到的一种动态平衡状态。
标准平衡常数则是量化这种平衡状态的重要参数。
本文将深入探讨化学平衡的基本原理、标准平衡常数的定义及其在化学反应中的应用,并结合最新的研究进展,提供全面而丰富的内容。
一、化学平衡的基本概念1. 化学平衡的定义化学平衡是指在封闭系统中,一个可逆化学反应的正反应速率和逆反应速率相等,反应物和生成物的浓度不再随时间变化的状态。
此时,系统处于动态平衡,尽管反应仍在进行,但宏观上观察不到任何变化。
2. 可逆反应与不可逆反应可逆反应:反应可以在正反两个方向上进行,且在一定条件下可以达到平衡。
例如,氢气和氧气生成水的反应: 2H_2(g) + O_2(g) \rightleftharpoons 2H_2O(g)不可逆反应:反应只能在一个方向上进行,无法达到平衡。
例如,燃烧反应通常是不可逆的。
3. 化学平衡的特征动态平衡:正逆反应速率相等,但反应并未停止。
宏观不变性:反应物和生成物的浓度保持恒定。
微观可变性:分子层面的反应仍在进行。
二、化学平衡的原理1. 勒夏特列原理勒夏特列原理(Le Chatelier's Principle)指出,当一个处于平衡状态的系统受到外界条件(如温度、压力、浓度)的改变时,系统会自发地调整,以抵消这种改变,重新达到新的平衡状态。
温度变化:升高温度有利于吸热反应,降低温度有利于放热反应。
压力变化:增加压力有利于体积减小的反应,减小压力有利于体积增大的反应。
浓度变化:增加反应物浓度或减少生成物浓度,平衡向生成物方向移动;反之亦然。
2. 平衡常数平衡常数(K)是描述化学平衡状态的一个重要参数,定义为在平衡状态下,生成物浓度的幂次方乘积与反应物浓度的幂次方乘积的比值。
对于一般反应:\[aA + bB \rightleftharpoons cC + dD\]平衡常数表达式为:\[K = \frac{[C]^c[D]^d}{[A]^a[B]^b}\]其中,[A]、[B]、[C]、[D]分别表示各物质的平衡浓度。

化学反应的平衡常数计算公式和例题化学反应的平衡常数是描述反应在达到平衡状态下各物质浓度的数值。
在化学反应中,平衡常数是非常重要的指标,可以帮助我们了解反应的进行方向和程度。
本文将介绍平衡常数的计算公式和通过例题来解释其应用。
一、平衡常数的基本概念和计算公式在化学反应中,平衡常数(K)定义为在特定温度下,反应物和生成物浓度的乘积之比。
对于一般的反应方程式:aA + bB ⇌ cC + dD,平衡常数计算公式如下:K = [C]^c[D]^d / [A]^a[B]^b其中,方括号表示物质的浓度,上标表示物质的摩尔系数。
平衡常数是与温度密切相关的,反应在不同温度下其平衡常数也会有所不同。
此外,平衡常数与反应物和生成物的物质摩尔比有关,可以通过确定平衡浓度来计算。
平衡常数的数值可以告诉我们反应的方向和程度。
当K大于1时,表示反应向生成物的方向进行,生成物浓度高于反应物浓度;当K小于1时,表示反应向反应物的方向进行,反应物浓度高于生成物浓度;当K等于1时,反应物和生成物的浓度相等,反应处于平衡状态。
二、平衡常数计算公式的应用举例下面通过例题来进一步说明平衡常数计算公式的应用。
例题1:对于反应方程式H2(g) + I2(g) ⇌ 2HI(g),在25℃下,平衡浓度为[H2] = 1.0mol/L,[I2] = 0.5mol/L,[HI] = 2.0mol/L,请计算平衡常数K的数值。
根据平衡常数计算公式K = [HI]^2 / [H2][I2],代入浓度数值得:K = (2.0mol/L)^2 / (1.0mol/L)(0.5mol/L) = 8.0mol/L因此,在25℃下,反应H2(g) + I2(g) ⇌ 2HI(g)的平衡常数K为8.0mol/L。
例题2:对于反应方程式2NO2(g) ⇌ N2O4(g),在特定温度下,平衡常数为K = 2.0。
已知平衡时,[NO2] = 0.1mol/L,请计算平衡时[N2O4]的浓度。
化学平衡常数计算公式化学平衡常数,这可是高中化学里的一个重要知识点哟!咱们先来说说化学平衡常数到底是啥。
简单来讲,化学平衡常数就是用来衡量化学反应进行程度的一个数值。
它就像一把尺子,能告诉我们反应进行到啥地步啦。
那化学平衡常数的计算公式是啥呢?它的表达式一般是生成物浓度的幂之积除以反应物浓度的幂之积。
这里的幂呢,就是化学方程式中各物质的化学计量数。
比如说,对于一个化学反应 aA + bB ⇌ cC + dD ,化学平衡常数 K 就等于 [C]^c × [D]^d / [A]^a × [B]^b 。
举个例子吧,咱来看看合成氨的反应 N₂ + 3H₂⇌ 2NH₃。
假如在一定条件下,氮气、氢气和氨气的平衡浓度分别是 1mol/L 、3mol/L 和2mol/L ,那化学平衡常数 K 就等于 (2)^2 / (1 × 3³) 。
我记得之前有一次给学生讲这个知识点的时候,有个学生特别迷糊,怎么都搞不明白。
我就给他打了个比方,我说这化学平衡常数就像咱们班的成绩排名,成绩好的同学(生成物)占比越高,排名(化学平衡常数)就越高,说明咱们班整体学习情况(反应进行程度)越好。
这么一说,他好像有点开窍了。
那化学平衡常数有啥用呢?它能帮助我们判断反应的方向。
如果计算出来的浓度商 Q 小于化学平衡常数 K ,反应就会朝着正反应方向进行;要是 Q 大于 K ,反应就朝着逆反应方向进行;要是 Q 等于 K ,那反应就达到平衡状态啦。
而且通过化学平衡常数,咱们还能了解温度对反应的影响。
一般来说,温度改变,化学平衡常数也会跟着改变。
如果温度升高,化学平衡常数增大,说明反应是吸热的;要是温度升高,化学平衡常数减小,那反应就是放热的。
在做题的时候,咱们可得注意单位的统一,还有就是要搞清楚物质的状态。
如果是固体或者纯液体,它们的浓度通常看作是常数 1 ,在计算的时候就不用考虑啦。
化学平衡常数这东西,虽然看起来有点复杂,但只要咱们多做几道题,多琢磨琢磨,就一定能掌握好。
化学反应的平衡常数计算式在化学的世界里,化学反应的平衡常数是一个极其重要的概念。
它就像是化学反应的“指南针”,能够帮助我们理解和预测化学反应进行的程度和方向。
那么,什么是化学反应的平衡常数?它的计算式又是怎样的呢?要理解化学反应的平衡常数,首先得知道什么是化学平衡。
当一个化学反应进行到一定程度时,反应物和生成物的浓度不再发生明显的变化,就好像这场“化学战斗”进入了一个相持阶段,双方势均力敌,这就是化学平衡。
而平衡常数,就是用来定量描述这种平衡状态的一个重要参数。
平衡常数的计算式并不是随意给定的,而是基于化学反应的方程式和各物质的浓度。
对于一个一般的化学反应:aA + bB ⇌ cC + dD其平衡常数(K)的表达式为:K = C^c × D^d / A^a × B^b这里的A、B、C和D分别代表物质 A、B、C 和 D 在平衡时的浓度。
需要注意的是,浓度通常以摩尔每升(mol/L)为单位。
为了更好地理解这个计算式,我们来举个简单的例子。
比如合成氨的反应:N₂+ 3H₂⇌ 2NH₃假设在某一温度下,达到平衡时氮气(N₂)的浓度是 1 mol/L,氢气(H₂)的浓度是 3 mol/L,氨气(NH₃)的浓度是 2 mol/L。
那么,这个反应的平衡常数 K 就可以计算出来:K = NH₃^2 /(N₂ × H₂^3) =(2)^2 /(1 × 3^3) = 4 / 27通过这个计算,我们得到了合成氨反应在特定条件下的平衡常数。
平衡常数的大小有着重要的意义。
如果 K 值很大,通常意味着反应进行得比较彻底,生成物在平衡体系中的浓度相对较高;反之,如果K 值很小,说明反应进行的程度有限,反应物在平衡体系中占主导地位。
另外,平衡常数还与温度密切相关。
对于给定的化学反应,温度发生变化,平衡常数也会随之改变。
一般来说,吸热反应,温度升高,平衡常数增大;放热反应,温度升高,平衡常数减小。
平衡常数k之间的运算1. 平衡常数的定义与表达式- 对于一般的可逆反应aA + bB⇌ cC + dD,在一定温度下达到化学平衡时,平衡常数K=([C]^c[D]^d)/([A]^a[B]^b),其中[A]、[B]、[C]、[D]分别表示各物质的平衡浓度。
- 如果反应是气体反应,对于反应aA(g)+bB(g)⇌ cC(g)+dD(g),还可以用分压表示平衡常数K_p=frac{p_{C}^c× p_{D}^d}{p_{A}^a× p_{B}^b},其中p_{A}、p_{B}、p_{C}、p_{D}分别表示各气体的平衡分压。
2. 平衡常数K之间的运算关系- 多重平衡规则- 如果一个反应可以由几个反应相加(或相减)得到,则这个反应的平衡常数等于几个反应平衡常数之积(或商)。
- 例如:反应A + B⇌ C,K_1=([C])/([A][B]);反应C + D⇌ E,K_2=([E])/([C][D])。
- 那么反应A + B+D⇌ E(反应 = 反应+反应),其平衡常数K_3 = K_1×K_2=([C])/([A][B])×([E])/([C][D])=([E])/([A][B][D])。
- 反应系数变化与平衡常数的关系- 若反应aA + bB⇌ cC + dD的平衡常数为K,那么反应2aA + 2bB⇌ 2cC + 2dD的平衡常数K'与K的关系为K' = K^2。
- 一般地,对于反应n(aA + bB)⇌ n(cC + dD),其平衡常数K'' = K^n。
- 逆反应的平衡常数- 对于反应aA + bB⇌ cC + dD,其平衡常数为K,那么它的逆反应cC + dD ⇌ aA + bB的平衡常数K_{逆}=(1)/(K)。
化学反应的平衡常数与浓度反应物与生成物浓度的平衡常数计算化学反应中存在着反应物与生成物之间的平衡关系,这个关系可以用平衡常数来描述。
平衡常数通常用K来表示,是反应物浓度与生成物浓度的比值的指数乘积,与反应物与生成物的摩尔比有关。
在化学反应中,平衡常数的计算对于了解反应的平衡性质以及控制反应过程具有重要的意义。
下面将介绍平衡常数的计算方法。
1. 平衡常数与反应物与生成物的浓度之间的关系化学反应的平衡常数与反应物与生成物的浓度之间存在着特定的关系。
对于一般的化学平衡反应,假设其反应方程式为:aA + bB ⇌ cC + dD其中,A、B为反应物,C、D为生成物,a、b、c、d为反应物与生成物的系数。
根据这个反应方程式,可以建立平衡常数K的表达式:K = [C]^c [D]^d / [A]^a [B]^b其中,[A]、[B]分别表示反应物A、B的浓度,[C]、[D]分别表示生成物C、D的浓度。
平衡常数K的值只与温度相关,与浓度无关。
2. 计算平衡常数的步骤计算平衡常数的步骤通常如下:(1)根据化学反应方程式确定反应物与生成物的系数a、b、c、d。
(2)根据反应物与生成物的浓度,代入平衡常数公式,计算平衡常数K的值。
(3)根据计算结果判断化学反应的平衡特性,判断反应是向左还是向右进行,以及平衡位置的靠近程度。
3. 平衡常数的意义平衡常数描述了反应的平衡性质。
当平衡常数K大于1时,表示生成物的浓度较高,反应向右较为倾斜;当平衡常数K小于1时,表示反应物的浓度较高,反应向左较为倾斜;当平衡常数K等于1时,表示反应物与生成物的浓度相等,反应处于平衡状态。
平衡常数还可以用来预测反应的方向和平衡位置的变化。
当改变反应体系中反应物或生成物的浓度、温度、压力等条件时,平衡常数会发生变化,从而导致反应方向的改变。
总结:化学反应的平衡常数是反应物浓度与生成物浓度的比值的指数乘积,用于描述反应的平衡性质。
计算平衡常数的方法需要根据反应方程式以及反应物与生成物的浓度,通过代入平衡常数公式来计算。