4.海洋是人类未来开发利用资源的主要场所。下列操作不能
用来淡化海水的是( )
A.过滤
B.蒸馏
C.低温多效蒸馏
D.多级闪急蒸馏
【解析】选A。海水中的可溶性物质在过滤时,能穿透滤纸,
达不到淡化海水的目的。
5.下列有关海水晒盐的几种说法,错误的是( ) A.海水成为食盐的饱和溶液后才能析出晶体 B.盐场必须建在阳光充足、雨量少的地区 C.结晶池中析出盐后的母液没有用途,为防止污染须排入大 海 D.盐场利用日晒、风吹晒盐,采取的是蒸发结晶的方法 【解析】选C。海水晒盐后的母液中,盐类的浓度较大,可从 中提取许多化工原料,例如将MgCl2的浓缩液用于海水制镁。
水滴 ___________
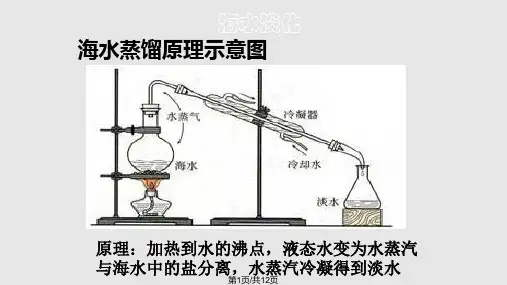
【实验结论】采用蒸馏法可得到不含盐的蒸无馏白水色。沉淀
2.海水淡化的方法:主要是膜法和热法,膜法又称反渗透法, 热法中较为常用的是_低__温__多__效__蒸__馏__法__和_多__级__闪__急__蒸__馏__法__。
考点 1 海水制镁 【典例】(2013·淄博中考)海洋是人类巨大的资源宝库,从海 水中提取金属镁的过程如下所示。
【实验步骤与现象】
实验步骤
实验现象
①按上图组装仪器,将导管放入 水中,并手捂试管检查装置的气 密性
导管口有_气__泡__,松手后导 管口处有水柱上升并保持
不下降
②向A中试管加入食盐水,塞好 水_____,A中试管内壁上
橡皮塞,用酒精灯加热
有_沸__腾__
③往B中试管里的冷凝水中滴加 几滴硝酸银溶液
③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③①
B.③②④①⑤
C.】选D。用海水制镁应先加入Ca(OH)2,Ca(OH)2与 MgCl2反应产生Mg(OH)2沉淀,过滤后得到Mg(OH)2固体, 然后加入盐酸,反应得到MgCl2溶液,浓缩结晶得MgCl2固体, 电解即得镁,故选D。