《离子晶体》
- 格式:ppt
- 大小:1.78 MB
- 文档页数:31





第三章——第三节——离子晶体要点一、离子晶体1.离子晶体(1)定义:由阳离子和阴离子通过离子键结合而成的晶体。
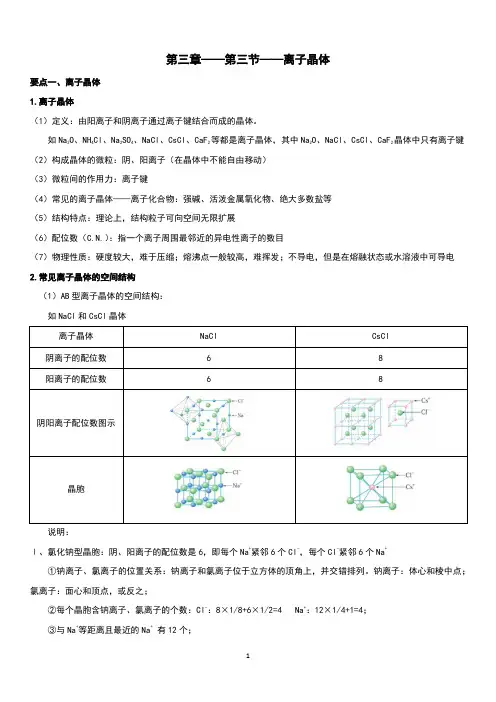
如Na2O、NH4Cl、Na2SO4、NaCl、CsCl、CaF2等都是离子晶体,其中Na2O、NaCl、CsCl、CaF2晶体中只有离子键(2)构成晶体的微粒:阴、阳离子(在晶体中不能自由移动)(3)微粒间的作用力:离子键(4)常见的离子晶体——离子化合物:强碱、活泼金属氧化物、绝大多数盐等(5)结构特点:理论上,结构粒子可向空间无限扩展(6)配位数(C.N.):指一个离子周围最邻近的异电性离子的数目(7)物理性质:硬度较大,难于压缩;熔沸点一般较高,难挥发;不导电,但是在熔融状态或水溶液中可导电2.常见离子晶体的空间结构(1)AB型离子晶体的空间结构:如NaCl和CsCl晶体说明:Ⅰ、氯化钠型晶胞:阴、阳离子的配位数是6,即每个Na+紧邻6个Cl-,每个Cl-紧邻6个Na+①钠离子、氯离子的位置关系:钠离子和氯离子位于立方体的顶角上,并交错排列。
钠离子:体心和棱中点;氯离子:面心和顶点,或反之;②每个晶胞含钠离子、氯离子的个数:Cl-:8×1/8+6×1/2=4 Na+:12×1/4+1=4;③与Na+等距离且最近的Na+有12个;④Na+、Cl-比例为1︰1,化学式为NaCl,属于AB型离子晶体。
Ⅱ、氯化铯型晶胞:阴、阳离子的配位数是8,即每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+每个Cs+周围最邻近的Cl-有8个,每个Cl-周围最邻近的Cs+有8个,则Cs+、Cl-的配位数都是8。
因此整个晶体中,Cs+、Cl-比例为1︰1,化学式为CsCl,属于AB型离子晶体。
同是AB型离子晶体, CsCl与NaCl的晶体结构和配位数不一样(2)CaF2晶体的空间结构由图可知,Ca2+的配位数为8,F-的配位数是43.决定离子晶体结构的主要因素:(1)几何因素:正、负离子的半径比的大小晶体的阴、阳离子所带的电荷数相同的AB型离子晶体的几何因素与配位数(阴、阳离子个数相同,配位数也相同)的关系:r+/ r-配位数0.225-0.414 40.414-0.732 60.732-1.00 8(2)电荷因素:正、负离子所带电荷的多少晶体中阴、阳离子的电荷数不相同,阴、阳离子个数不相同,各离子的配位数也不相同。

离子晶体的基本特点离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
晶体主要分为离子晶体、分子晶体、金属晶体和原子晶体。
离子晶体是指由离子化合物结晶成的晶体,离子晶体属于离子化合物中的一种特殊形式,不能称为分子。
由正、负离子或正、负离子集团按一定比例通过离子键结合形成的晶体称作离子晶体。
强碱、活泼性金属氧化物和大多数的盐类均为离子晶体。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
(注:不同于离子化合物。
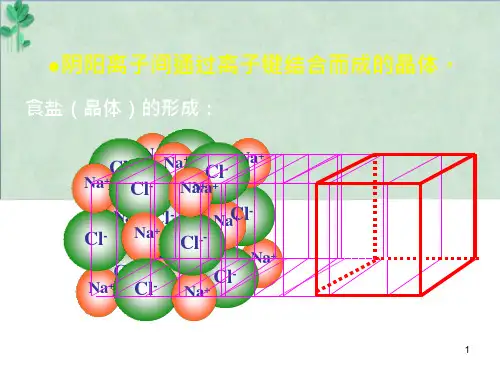
)1.结构特征:离子晶体中正、负离子或离子集团在空间排列上具有交替相间的结构特征,因此具有一定的几何外形,例如NaCl是正立方体晶体,Na+离子与Cl-离子相间排列,每个Na+离子同时吸引6个Cl-离子,每个Cl-离子同时吸引6个Na+。
不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。
离子晶体不存在分子,所以没有分子式。
离子晶体通常根据阴、阳离子的数目比,用化学式表示该物质的移动图片组成,如NaCl表示氯化钠晶体中Na+离子与Cl-离子个数比为1:1, CaCl2表示氯化钙晶体中Ca2+离子与Cl-离子个数比为1:2。
2.电性:离子晶体整体上具有电中性,这决定了晶体中各类正离子带电量总和与负离子带电量总和的绝对值相当,并导致晶体中正、负离子的组成比和电价比等结构因素间有重要的制约关系。
3.离子键:如果离子晶体中发生位错即发生错位,正正离子相切,负负离子相切,彼此排斥,离子键失去作用,故无延展性。
如CaCO3可用于雕刻,而不可用于锻造。
因为离子键的强度大,所以离子晶体的硬度高。
又因为要使晶体熔化就要破坏离子键,所以要加热到较高温度,故离子晶体具有较高的熔沸点。
离子晶体在固态时有离子,但不能自由移动,不能导电,溶于水或熔化时离子能自由移动而能导电。
因此水溶液或熔融态导电,是通过离子的定向迁移导电,而不是通过电子流动而导电。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。

高中化学离子晶体教案设计作为高中化学的一部分,离子晶体是一个重要的内容。
离子晶体是由离子组成的有序排列的结晶固体,由于其独特的物理和化学性质,有着广泛的应用。
本文将围绕离子晶体的基本概念、晶体结构、特性、制备以及应用等方面,结合教学内容,设计一份完整的化学教案,旨在帮助学生更好的掌握化学中离子晶体的相关知识。
一、教学目标1、了解离子晶体的基本概念,包括离子晶体是如何形成的,它们的化学组成,因离子晶体结构而产生的特殊性质等。
2、了解离子晶体的种类和晶体结构,包括简单离子晶体和复合离子晶体等。
3、了解晶体结构的模型,包括离子晶体的离子键模型、离子晶体的离子键/电子共价键模型等。
4、学习离子晶体的制备方法,包括凝胶法、熔融法、水热法等。
5、了解离子晶体的消光性质,了解偏振镜的基本原理,理解所观察到的消光现象。
6、学习离子晶体的应用,包括在生产生活中的应用和其它方面的应用。
二、教学方法1、讲授教学法通过教学的方式,讲解离子晶体的相关概念、结构、特性、制备以及应用等方面的内容,引导学生对离子晶体的认知。
2、实验教学法通过实验尝试,让学生对离子晶体的制备、消光、性质等方面的知识有更深入的了解,同时培养学生的实验操作能力和实验观察能力。
3、讨论教学法以小组讨论的方式,引导学生自觉思考问题,互相交流讨论,提高学生的能力和兴趣。
三、教学过程1、对离子晶体基本概念的讲解分别从离子晶体的形成、化学组成、特殊性质等方面进行讲解,引导学生了解离子晶体的形成及其特点。
了解离子晶体的化学组成,了解离子晶体的性质。
2、离子晶体的种类和晶体结构分别介绍了简单离子晶体和复合离子晶体的种类,从晶体结构的角度讲解了离子晶体的结构模型,包括离子键模型、离子键/电子共价键模型等方面的内容。
3、离子晶体的制备按照不同的制备方法,分别讲解凝胶法、熔融法、水热法等制备离子晶体的方法和步骤,并结合实验进行讲解。
4、离子晶体的消光特性通过实验,让学生亲身体验离子晶体的消光性质并了解偏振镜的基本原理,让学生观察到消光现象。

离子晶体定义离子晶体是一种特殊的晶体,其结构由离子而不是分子构成。
离子晶体在晶体结构中担当电极,以强烈的离子相互作用电聚变作用把原子排列到晶体晶格中,使其形成晶体结构。
离子晶体有多种性质,包括电导性、热性能、光学性能和磁性能。
离子晶体有许多不同的种类,其中最常贴近的是钙钛矿晶体、钙和镧晶体。
钙钛矿晶体是一种具有电极的离子晶体,由钙和钛的离子构成,具有卓越的光学性能和非常好的热性能,例如太阳能电池。
钙和镧晶体是一种具有色素特性的离子晶体,由钙和镧的离子构成,具有卓越的热稳定性和一定的热敏性,用于制造色变器件。
离子晶体的研究主要集中在结构和性能的探索上。
研究人员正在研究电聚变作用如何影响晶体的结构,以及离子晶体的性质和结构如何影响其光学性质、热性能和磁性能。
这些研究对许多应用领域的性能有着重大作用,包括制造军事装备,制备光器件和电子器件,以及分析材料和环境。
离子晶体的发展可以追溯到20世纪60年代,当时研究人员把他们的研究重点放在晶体结构的研究上,将离子以规则方式排列在晶体中,从而构成离子晶体结构。
此后,随着研究和技术的发展,离子晶体在各个领域逐步得到应用,今天已经成为科学研究和工业应用的重要分支。
离子晶体除了具有独特的晶体结构外,还具有各种特殊的性质,因而在许多领域得到应用。
离子晶体在制备太阳能电池和固态照明器件中发挥着重要作用;广泛用于电子器件的制备,例如芯片,显示器,电路板和电阻等;用于分析材料和环境中的电荷;广泛用于生物研究,例如荧光成像和免疫组化;广泛用于军事装备的制造,例如目标探测和传感器,以及穿戴式智能装置的制造。
离子晶体技术正在不断发展,研究人员正在努力开发出新的离子晶体材料,通过改变离子晶体的结构和性质,探索以更高效的方式制备多种用途的器件。
例如,研究人员正在利用离子晶体技术开发新型的太阳能电池,以高效地将光能转换为电能;正在利用离子晶体技术开发新型的灯具,以更加高效地将电能转换为光能;正在开发新型的非晶材料,以提高热性能和电导率,并且具有良好的电学稳定性。
离子晶体的名词解释离子晶体是一种固态物质,由离子构成的有序排列形成晶格结构。
离子是带有正电荷或负电荷的原子或分子,在形成晶体结构时通过静电力互相聚集在一起。
离子晶体通常具有高熔点、高硬度和良好的导电性能,因此在许多领域有着广泛的应用。
1. 离子与晶格离子晶体的基本结构是由正离子和负离子组成的晶格。
正离子和负离子之间通过静电相互作用力形成稳定的晶格结构。
正离子和负离子的数目必须相等,以保持整体电中性。
离子晶体的晶格结构对其性质起着重要的影响。
2. 离子晶体的物理性质离子晶体通常具有高熔点和高硬度。
这是因为在离子晶体中,正离子和负离子之间的静电相互作用力较强,需要很高的能量才能破坏这种结构。
因此,离子晶体往往具有非常稳定的结构。
此外,离子晶体还具有良好的光学性能。
离子晶体中的离子对光的吸收和发射起着重要作用,因此离子晶体通常具有特殊的光学效应,例如双折射和荧光。
3. 离子晶体的导电性由于离子晶体中带电离子的存在,它们通常具有良好的导电性能。
当离子晶体受到外界电场的作用时,带电离子会迅速在晶体内部移动,从而产生电流。
这种特性使离子晶体被广泛应用于电池、电解质和导电材料等领域。
4. 离子晶体的应用离子晶体在日常生活中有着广泛的应用。
其中一个典型的应用是在电子设备中的显示技术。
例如,液晶显示屏就是一种以离子晶体为基础的显示技术。
液晶分子具有可控的旋转和排列方式,通过控制电场来改变液晶分子的排列状态,从而实现图像的显示。
此外,离子晶体还常用于人工合成宝石的制备。
通过控制离子的成分和结构,制造出具有与天然宝石相似甚至更好的光学性能的合成宝石。
另外,离子晶体还在能源领域有着重要的应用。
例如,某些离子晶体在高温下具有良好的离子导电性能,可以用于制造固体氧化物燃料电池。
总之,离子晶体作为一种固态物质,在物理性质、导电性以及应用方面都具有独特的特点和广泛的应用前景。
通过深入研究离子晶体的结构和性质,我们可以更好地理解和应用这种材料,推动科学技术的发展。