高一化学气体的摩尔体积1
- 格式:ppt
- 大小:740.50 KB
- 文档页数:27

标准状况下1mol气体体积在化学和物理学中,我们经常会遇到气体体积的计算和测量。
而在标准状况下,1mol气体的体积是一个非常重要的概念。
在这篇文档中,我们将深入探讨标准状况下1mol气体体积的相关知识,包括其定义、计算方法以及实际应用。
首先,我们来了解一下标准状况的定义。
在化学中,标准状况通常指的是温度为0摄氏度(273.15K)和压强为1大气压(101.325kPa)的状态。
在这种条件下,1mol理想气体的体积被定义为标准摩尔体积,通常用V_m表示。
接下来,我们来看一下如何计算标准状况下1mol气体的体积。
根据理想气体状态方程PV=nRT,其中P代表气体的压强,V代表气体的体积,n代表物质的摩尔数,R代表气体常数,T代表温度。
在标准状况下,我们可以将这个方程简化为PV=nRT=1RT,因为1mol气体的摩尔数为1。
代入标准状况下的温度和气体常数,我们可以得到标准状况下1mol气体的体积为V_m=22.414L。
除了理论计算,我们还可以通过实验来验证标准状况下1mol气体的体积。
通过使用气体收集瓶和水柱法,我们可以测量气体在标准状况下的体积。
这样的实验可以帮助我们更直观地理解1mol气体的体积是多少,并且验证理论计算的准确性。
标准状况下1mol气体的体积在化学实验和工业生产中有着广泛的应用。
比如在化学实验中,我们经常需要将气体体积作为实验数据来计算反应物的摩尔数或者反应的产物。
在工业生产中,标准状况下1mol气体的体积也被用来进行气体的储存和运输,以及计算气体的产量和消耗量。
总的来说,标准状况下1mol气体的体积是一个重要的概念,它不仅在理论研究中有着重要的意义,也在实际应用中发挥着重要作用。
通过深入理解和掌握这一概念,我们可以更好地进行气体相关实验和工业生产,为化学和物理学的发展做出贡献。
在本文中,我们对标准状况下1mol气体体积的定义、计算方法和实际应用进行了详细的介绍和讨论。
希望通过阅读本文,读者能够对这一重要概念有更深入的理解,并且能够在实际应用中灵活运用。






标准状态下1mol气体的体积
高一的化学课本中的表述是:在标准状况下,1mol任何气体所占的体积都约为22.4L.
但这是一个在特定条件下的气体摩尔体积.条件就是标准状况.标准状况是指温度为0℃,压强为101.325KPa.要用气体的摩尔体积,必须满足一定的条件,①标准状况②1mol③气体,当着三个条件都满足时,该气体的体积才为22.4L.
我们知道,温度升高,气体体积增大
压强增大,气体体积减小
所如果温度高于0℃,压强小于101.325KPa
或者温度低于0℃,压强大于101.325KPa
都有可能使1mol气体的体积变为22.4L
所以1mol气体的体积为22.4L的时候,不一定要在标准状况下.。


气体体积与摩尔的关系公式
气体体积与摩尔的关系公式是:V = n × Vm。
其中,V表示气体的体积,n 表示气体的摩尔数,Vm表示摩尔体积,即气体在标准温度和压力(STP)
下的体积。
在STP下,1摩尔理想气体的体积约为升。
摩尔体积定律的实质是根据理想气体状态方程推导出来的,它假设气体分子之间没有相互作用,并且分子体积可以忽略不计。
在实际气体中,这个定律并不完全准确,因为气体分子之间会有相互作用,分子体积也不能完全忽略。
以上内容仅供参考,建议查阅化学书籍或咨询化学专家以获取更准确的信息。

高一化学教案:气体摩尔体积
【摘要】鉴于大家对十分关注,小编在此为大家搜集整理了此文“高一化学教案:气体摩尔体积”,供大家参考!
本文题目:高一化学教案:气体摩尔体积
教学目标
知识目标
使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
使学生在理解气体摩尔体积,特别是标准状况下,气体摩尔体积的基础上,掌握有关气体摩尔体积的计算。
能力目标
6.在理解标况下气体摩尔体积这一特例时,应强调以下4 点:①标准状况
②物质的量为1
2.什幺叫摩尔质量?。
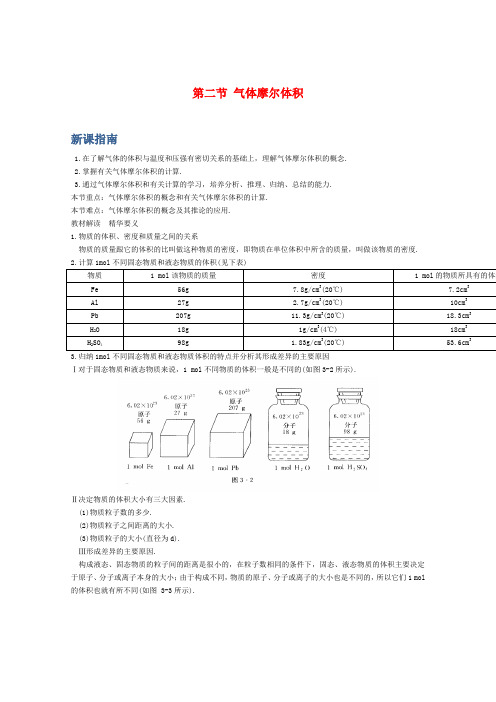
第二节气体摩尔体积新课指南1.在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念.2.掌握有关气体摩尔体积的计算.3.通过气体摩尔体积和有关计算的学习,培养分析、推理、归纳、总结的能力.本节重点:气体摩尔体积的概念和有关气体摩尔体积的计算.本节难点:气体摩尔体积的概念及其推论的应用.教材解读精华要义1.物质的体积、密度和质量之间的关系物质的质量跟它的体积的比叫做这种物质的密度,即物质在单位体积中所含的质量,叫做该物质的密度.2.计算1mol不同固态物质和液态物质的体积(见下表)物质 1 mol该物质的质量密度 1 mol的物质所具有的体积Fe 56g 7.8g/cm3(20℃) 7.2cm3Al 27g 2.7g/cm3(20℃) 10cm3Pb 207g 11.3g/cm3(20℃) 18.3cm3H2O 18g 1g/cm3(4℃) 18cm3H2SO498g 1.83g/cm3(20℃) 53.6cm33.归纳1mol不同固态物质和液态物质体积的特点并分析其形成差异的主要原因Ⅰ对于固态物质和液态物质来说,1 mol不同物质的体积一般是不同的(如图3-2所示).Ⅱ决定物质的体积大小有三大因素.(1)物质粒子数的多少.(2)物质粒子之间距离的大小.(3)物质粒子的大小(直径为d).Ⅲ形成差异的主要原因.构成液态、固态物质的粒子间的距离是很小的,在粒子数相同的条件下,固态、液态物质的体积主要决定于原子、分子或离子本身的大小;由于构成不同,物质的原子、分子或离子的大小也是不同的,所以它们1 mol的体积也就有所不同(如图 3-3所示).知识详解知识点1 气体摩尔体积(重点、难点)Ⅰ决定气体体积大小的主要因素(1)决定气体所含有的分子数(或气体的物质的量).在一定温度,一定压强下,气体中所含的分子数目(或物质的量)越多,气体的体积就越大.(2)分子的直径和分子之间的距离.一般来说,气体分子的直径约为0.4 nm,而分子之间的距离则约为4 nm,即分子之间的距离约是分子直径的10倍.因此,当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小(如图3-4所示).思维拓展如图3-5与图3-6所示,讨论气体分子之间的距离受哪些因素的影响?是怎样影响的?点拨受温度和压强的影响。

高一化学气体摩尔体积
气体摩尔体积是一个重要的物理概念,它是指一定量的某种气体在标准状态下的体积。
它是由法国物理学家和化学家费曼提出的,他提出,一定量的任何气体在标准状态下的体积都是相同的,即22.4升,这就是气体摩尔体积的概念。
气体摩尔体积的概念对于化学家来说非常重要,它可以帮助我们更好地理解气体的性质,以及气体之间的相互作用。
例如,我们可以通过气体摩尔体积来计算气体的比重,从而更好地了解气体的性质。
此外,气体摩尔体积也可以帮助我们更好地理解气体的混合物,从而更好地控制气体的混合物。
气体摩尔体积的概念也可以用于计算气体的温度和压力,从而更好地控制气体的变化。
此外,气体摩尔体积也可以用于计算气体的比容,从而更好地控制气体的变化。
总之,气体摩尔体积是一个重要的物理概念,它可以帮助我们更好地理解气体的性质,以及气体之间的相互作用,从而更好地控制气体的变化。
因此,我强烈推荐高中生学习气体摩尔体积,以便更好地理解化学知识。
