SO2熏气实验装置改进研究
- 格式:pdf
- 大小:264.61 KB
- 文档页数:5

实验四实验室制取SO2及性质实验装置改进研究实验室制取SO2及性质实验是中学化学中的一个基础实验,高中化学教材关于二氧化硫的制备和性质的实验,得出一致结论:二氧化硫是一种具有刺激性气味的气体,对人体有一定的伤害,也对环境有一定的污染,具有漂白性和还原性。
但由于其制备装置与反应速率难于控制,也无法得知其漂白的原理。
我们就主要上边的两个问题设计和改换了一下实验装置供大家参考:实验原理:利用亚硫酸盐和酸反应可以生成SO2,然后让气体先后与鲜花与溴水作用进行漂白和还原性的检验。
设计思路:由于其制备装置与反应速率难于控制,也无法得知其漂白的原理而且SO2具有污染性,所以尽量减少仪器的组装,故设计在同一组仪器中进行该实验,并且有尾气处理装置。
实验装置图如下:实验操作:如图组装实验装置,检验其气密性,然后在广口瓶中加入适量体积比为1:1的硫酸,在纸盒中加入一定亚硫酸钠粉末,在干燥管中加入红色鲜艳的鲜花,在洗气瓶中加入适量溴水,在尾气回收装置中加入适量氢氧化钠溶液。
塞紧塞子,将粉末缓慢倒入硫酸溶液中观察实验现象并记录;待现象明显后,用酒精灯微热干燥管,观察实验现象并记录。
实验现象:将亚硫酸钠粉末与硫酸混合时,溶液有气泡产生鲜花的颜色退去,洗气瓶中溴水的颜色变浅尾气吸收装置有气泡;酒精灯微热干燥管之后鲜花颜色又变亮,并且洗气瓶中的溴水颜色也会比之前更淡。
注意点:因该实验是验证SO2的漂白性的原理,所以产生SO2的量相对较多,故在产生SO2时,要求亚硫酸钠的量不可少尾气处理时使用的是浓NaOH溶液。
由于气体中可能含有水分所以加热干燥管时一定要微热,尾气处理并加防倒吸装置。
反应使用硫酸溶液浓度不能太大否则会氧化生成的SO2气体,浓度太小又会有大量的SO2气体溶入溶液中,所以选择体积比为1:1的溶液。
实验探究点:亚硫酸钠粉末与硫酸溶液混合时,鲜花和溴水的颜色逐渐褪去,原因是什么?微热干燥管后鲜花的颜色逐渐变红而溴水的颜色变的更浅,又是为什么?推测:二氧化硫漂白是化和漂白,反应可逆,并且二氧化硫具有还原性。

二氧化硫性质实验的改进摘要二氧化硫性质探究是高一必修二重要内容,课本中的演示实验都是试管实验,为了避免污染和使实验现象观察明显,对二氧化硫性质探究实验进行了改进,同时培养学生良好实验习惯和提高实验创新能力。
关键词二氧化硫性质改进一、实验背景(1)人教版现行教材中,二氧化硫性质相关实验的探究存在以下问题:1、都是敞开性试管实验,对环境造成一定污染,也对人的身体健康造成一定伤害,且不利于对学生进行环保意识的熏陶。
2、实验现象难以实现。
教材实验是将装有二氧化硫气体的试管倒立在水中,在试管中保留1/3的溶液,滴加品红溶液,现象是品红溶液褪色,但是通过实验证明,褪色现象难以实现。
3、使用仪器多,操作复杂,耗时较长。
二氧化硫的性质实验涉及二氧化硫的制取和几个独立的性质实验,几个独立实验既浪费时间又造成空气污染。
4、需要二氧化硫量比价多,浪费药品。
5、各演示实验比较单一,不利于调动学生的学习激情,也没有体现二氧化碳气体对环境的影响。
(2)对实验进行分析,确定问题解决方向:1、对二氧化硫制备的处理。
2、可设计本实验把几个性质小实验组合在一起并在一个密闭空间里进行,避免了当堂制取气体的麻烦又节约了时间而且不会造成空气污染。
3、通过对比实验加深学生对二氧化硫性质的认识与学习。
4、对实验进行创新,调动学生激情,培养学生创新和环保意识。
二、实验探索1、二氧化碳的制备制备二氧化碳,可通过下述反应来实现:SO32-+ 2H+= H2O +SO2或HSO32-+ H+= H2O + SO2现行化学实验教科书以固体亚硫酸氢钠与浓硫酸的反应来制备二氧化硫。
在实验教学过程中,我们发现将浓硫酸加入固体亚硫酸氢钠,尤其是较长时间放置的固体亚硫酸氢钠,反应仅产生少量二氧化硫且很快终止,不能顺利进行二氧化硫的性质实验。
若改以同样质量的无水亚硫酸钠固体与浓硫酸反应,则产生大量的二氧化硫气体,反应平稳地进行,能很好地完成二氧化硫的性质实验。
2、二氧化硫的性质探究二氧化硫具有还原性、漂白性、氧化性,其水溶液呈酸性。


硫的燃烧实验改进设计在人教版九年级化学教材上册P33学习氧气的性质时,教师要在课堂上演示硫在空气中和氧气中的燃烧实验,教材的演示实验方案存有以下几个问题:1.由于硫燃烧会产生有毒的气体二氧化硫,而该实验首先要将硫在空气中点燃并观察实验现象,此时产生大量有毒气体危害师生健康,同时由于反应微弱,学生也不能近距离观察实验现象,之后再放入氧气中燃烧,由于反应放热,虽然有玻璃片盖住瓶口,仍然会有大量二氧化硫从集气瓶中逸出。
2.水不能很好的吸收二氧化硫,实验结束后,洗涤仪器中仍然会有二氧化硫的逸出,危害实验员的健康。
3.教师在课前要制取好氧气,这对于有连堂课的老师准备时间仓促,同时制取好的氧气容易泄露,从而造成演示实验现象不明显或者实验失败。
为解决这些问题,作者在教学中经过反复尝试,最后设计了一套用于实行硫在空气中、氧气中的燃烧实验装置,该装置简单容易操作,大量减少空气污染,可近距离观察实验现象,实验对比效果很好,演示时间也很短,同时把氧气的制取和硫的燃烧两个实验很好的结合起来。
一、实验仪器及试剂实验仪器:集气瓶一个、20 mL塑料注射器两个、三孔橡皮塞一个、燃烧匙一个、导管两根、气球一个、橡皮筋一根、酒精灯、火柴、药匙2个。
实验药品:二氧化锰、6%双氧水、硫、氢氧化钠溶液。
二、实验仪器装置图(图1)及仪器的组装说明过氧化氢溶液硫二氧化锰图1 实验装置图集气瓶内装有少量二氧化锰,注射器内装有适量6%双氧水,燃烧匙中装有少量硫。
由于实验中会产生大量氧气和二氧化硫,同时反应放热,气球起到一个缓冲压强的作用,同时也能够收集产生的二氧化硫。
三、实验操作先向集气瓶中加入适量二氧化锰,用塑料注射器吸取适量双氧水,用药匙取少量硫于燃烧匙上,将燃烧匙在酒精灯上加热至有火焰时迅速伸入集气瓶并塞进橡皮塞,此时可近距离观察硫在空气中燃烧的现象:硫燃烧,发出微弱的淡蓝色火焰,如图2所示。
推入注射器的活塞,向集气瓶中注入双氧水,双氧水在二氧化锰的催化作用下产生大量氧气,此时可马上观察到硫在氧气中燃烧的现象变为:剧烈燃烧,发出明亮的蓝紫色火焰,如图3所示。

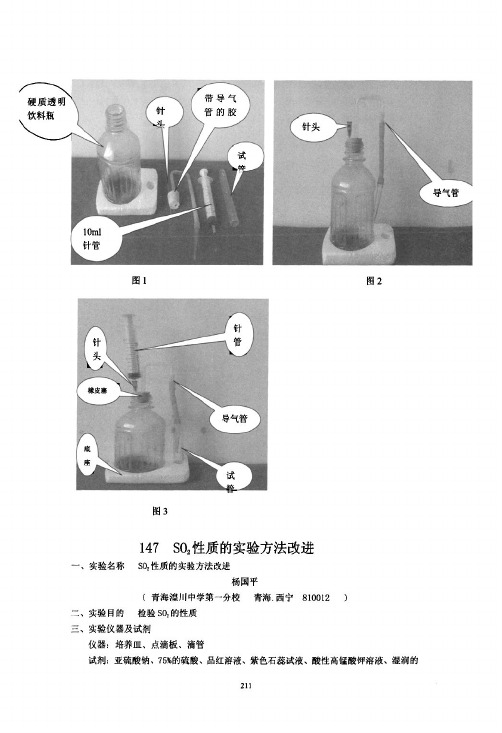
北京师范大学化学学院2007级教育硕士李小兵SO2性质实验的改进(北京师范大学化学学院2007级李小兵)在人教版普通高中课程标准实验教科书《化学》(必修1)第四章第三节《硫和氮的氧化物》中安排了SO2的性质实验,在实验中发现该实验存在以下问题:1、学生实验时有SO2逸出,污染空气;2、在水下塞橡皮塞,操作不便;3、不能用同一装置反复演示。
4、所得SO2溶液浓度小,现象不够明显。
为了克服一以上不足,达到更好的实验效果,将本实验做如下改进:一、实验用品:U型管,干燥管,酒精灯,注射器,铁架台,PH试纸,品红溶液,NaOH溶液,棉花Array二、实验装置图三、实验步骤1、取一橡皮塞A打一孔,注意不要打穿,留大约0.5厘米,这样既便于注射器针头刺入,又能保证良好的气密性。
3、从U型管右管注入蒸馏水,在左管口塞上橡皮塞A,注意短管内液面与橡皮塞之间不留气泡,右管口塞上连接干燥管的橡皮塞B,固定在铁架台上如上图。
4、将用NaOH溶液浸湿的棉花盖住干燥管口,用注射器从左管注入SO2气体,这时观察到左管中出现气体,液面下降,干燥管中液面上升;伴随着SO2的溶解,继而左管中气体量减少,液面上升,干燥管中液面下降,最后短管中气体消失。
5、用注射器抽取少量溶液,用PH试纸检验酸碱度。
6、用注射器向短管内加入1-2滴品红溶液,可观察到溶液的红色逐渐褪去;用酒精灯加热,又可看到溶液又恢复红色,将棉花移走,可闻到刺激性气味。
再用注射器注入SO2气体,一段时间后溶液又褪色,加热又恢复红色,可反复演示。
四、改进后装置优点1、采用了注射器加样,操作简便,易于控制;2、可得到较大浓度的SO2溶液,现象明显3、可以反复演示,再现性好;4、只要采用气密性良好的装置,几乎无SO2逸出,不污染空气,更加绿色环保。


硫在空气中燃烧的改进实验
三里岗中心学校刘忠恩
九年级化学上册(人教版)P34,实验2-3,在燃烧匙里放少量硫,加热,直到发生燃烧,观察硫在空气里燃烧时发生的现象。
硫在空气中燃烧产生微弱的淡蓝色火焰,只有近距离才能观察清楚,为了能让学生观察现象,我们教师的一般做法是:手持燃烧匙在教室内走一周,但是硫燃烧会生成有毒的二氧化硫气体,既会给学生的健康带来影响,又会污染空气,基于此,设计了如下改进实验。
实验原理(化学反应):
S+O2点燃
SO2
2NaOH+SO2 Na2SO3+H2O
实验用品:
燃烧匙、酒精灯、药匙、硫、氢氧化钠溶液、塑料瓶2只(可口可乐瓶1只、
矿泉水瓶1只)、胶带、小刀、海绵等。
实验步骤:
1、用小刀在可口可乐塑料瓶的侧上方开一个口(长约4cm,宽约2cm)。
2、用胶带把两个塑料瓶口对口粘好。
3、取一块海绵,厚约2cm,长、宽略大于塑料瓶开口的面积,把燃烧匙斜穿海绵(当海绵塞在开口处时,燃烧匙竖直,不倾斜)。
4、从开口处向塑料瓶内加入一定量的氢氧化钠溶液,并在朝向瓶内的海绵一侧喷适量的NaOH溶液。
5、在燃烧匙里放少量硫加热,直到发生燃烧,迅速伸入塑料瓶内,塞
紧海绵。
6、手持装置,近距离靠近学生,观察现象。
实验分析:
由于硫燃烧有少量白烟生成,故用上面的矿泉水瓶吸收白烟,下面用大
一些的可乐瓶,为了提供更多的空气(氧气),延长反应时间,有利于现象
观察,实验结束后,待白烟消失,SO2全部吸收后拆装置,减少有毒物质的
扩散。

化学创新实验:硫在空气或氧气里燃烧的实验改进一、实验名称硫在空气或氧气里燃烧的实验改进二、实验目的1、认识到“硫在空气或氧气里燃烧的实验非常重要,但生成的二氧化硫是一种典型的有毒气体,污染空气,危害师生健康,危害人类。
”需要改进。
2、学会发现九年级(人教版)化学实验中需要改进的问题,学会进行实验改进与创新。
3、教师学会在教学工作中保护学生和自我保健。
三、实验仪器及试剂一端有突出像平勺状的玻璃棒、双孔橡皮塞、井穴板、酒精灯、集气瓶、玻璃管、小气球、火柴、硫粉、NaOH溶液、空气、氧气四、实验仪器装置图及仪器的制作、组装和改进说明图1图2图3图4改进问题的提出和说明1.如图1装置的缺点:人教版《化学》九年级上册34页[实验2-3]是硫在空气或氧气里燃烧,书中操作是:在燃烧匙内放少量的硫,加热,直至发生燃烧,观察硫在空气里燃烧时发生的现象。
然后把有燃着的硫的燃烧匙伸入充满氧气的集气瓶里,再观察硫在氧气里燃烧时发生的现象。
比较硫在空气里和在氧气里燃烧有什么不同。
对于书中的实验方法在演示时存在着一些缺点:①若用燃烧匙盛药品用量大则污染大,对师生毒害强;若药品用量太少,火苗可能被燃烧匙挡着,台下的学生不易观察现象。
若想办法在燃烧匙底部放些如沙土等填充物垫高些再取少量硫进行实验,但到下节课在另一班里马上难以清洗,还有些学生误认为填充物发出的现象。
②硫在空气中燃烧尽管时间短,但放出二氧化硫多;硫在氧气中燃烧玻璃片与瓶间隙较大,又放出二氧化硫;教师和学生吸入多,对师生毒害强,笔者和个别学生表现为刺激咳嗽、气喘、头痛(九年级化学教师每学年代三个班毒害就更大),笔者咽喉过敏,每次服用药物日久方癒。
③“比较硫在空气里和在氧气里燃烧有什么不同”演示实验,很难达到有效,凭借教师的语言描述实验现象。
④教材中瓶内装少量水,目的是吸收反应生成的有毒气体二氧化硫,防止空气污染,但水的吸收效果远不如碱溶液,二氧化硫能和碱发生反应,既然是改进装置,液体应是碱溶液,如氢氧化钠溶液(或氢氧化钾溶液等可溶性碱溶液)。

二氧化硫性质实验改进摘要:为使二氧化硫的性质实验符合绿色化学的理念,更多地验证二氧化硫的化学性质,使学生更好地掌握有关二氧化硫的化学知识。
经过深入研究,利用废弃的医疗用品、医用输液器、注射器等,设计出一套全新的既能制备二氧化硫气体又能验证二氧化硫诸多性质,而且又不污染环境的全封闭一体化的实验装置。
关键词:二氧化硫;绿色环保;废弃医疗用品二氧化硫是一种有刺激性气味、有毒、污染空气的气体。
而教材中的实验设计只涉及了so2漂白性和溶于水后溶液酸性的检验,至于so2的重要性质还原性并没有涉及,而且教材中的反应装置复杂;药品用量大,造成浪费;使用仪器多,装置冗杂,操作麻烦;实验时间长,影响教学过程;也没考虑环境污染的问题,存在一些缺陷。
因此,我们将教材中的试管实验改进成利用废弃医疗用品设计的绿色环保的微型实验。
一、实验目的1.让学生初步认识二氧化硫的性质(酸性气体、漂白性、还原性等性质)。
2.培养学生的实验创新能力和环保意识。
3.培养学生设计实验、动手实验、观察现象,并根据实验现象得出结论的能力。
二、实验用品1.实验仪器:100 ml医用盐水瓶2个(一个塑料瓶,一个玻璃瓶)、250 ml医用盐水袋一个、输液器排气管若干、医用三通阀2个、一次性塑料注射器2支、医用青霉素小药瓶若干等。
2.实验药品:na2so3固体、1比1的硫酸、石蕊试液、品红溶液、酸性kmno4溶液、溴水、浓naoh溶液、蒸馏水、热水。
三、实验装置(如图所示)二氧化硫性质实验微型实验设计图四、实验步骤1.如图所示连接好装置,检查装置的气密性。
2.先在反应瓶中加入na2so3固体约3.3 g,塞好瓶塞并将输液器插入瓶塞,另一端连接三通阀。
三通阀上另外两端连接分别连接真空盐水袋和装有检验so2性质药品的小药瓶。
小药瓶上再连接一根导管,导管另一端连接装有naoh溶液的盐水瓶。
3.用装有硫酸溶液的注射器向反应器中慢慢注入硫酸,并将三通阀打开至小药瓶端,观察并记录实验现象。


二氧化硫性质实验的改进与探究发布时间:2021-09-27T17:35:17.272Z 来源:《中国教师》2021年10月作者:杨旺[导读] 现行高中化学人教版新教材中,有关二氧化硫性质的探究是需要学生掌握的重难点。
而经典二氧化硫性质探究实验的设计存在较多不足,如实验装置复杂难以组装,药品用量大造成浪费等。
本文对二氧化硫性质探究实验进行综合改进,通过巧用球形冷凝管简化了实验装置,使操作更简便、药品用量更少、现象更明显。
且该装置可用于其他气体(氯气、氨气、乙烯等)性质探究实验,适用范围较广。
杨旺洪江市黔阳一中 418100【摘要】现行高中化学人教版新教材中,有关二氧化硫性质的探究是需要学生掌握的重难点。
而经典二氧化硫性质探究实验的设计存在较多不足,如实验装置复杂难以组装,药品用量大造成浪费等。
本文对二氧化硫性质探究实验进行综合改进,通过巧用球形冷凝管简化了实验装置,使操作更简便、药品用量更少、现象更明显。
且该装置可用于其他气体(氯气、氨气、乙烯等)性质探究实验,适用范围较广。
【关键词】实验创新二氧化硫性质探究球形冷凝管中图分类号:G652.2 文献标识码:A 文章编号:ISSN1672-2051 (2021)10-049-01普通高中教科书《化学必修第二册》人民教育出版社第5页实验5-3,是关于二氧化硫溶于水、酸碱性测定及漂白性的实验,但该实验并没有对二氧化硫的氧化性、还原性进行研究[1]。
化学是一门以实验为基础的自然科学,学生对实验现象进行分析可以培养学生的实验探究与归纳整理能力,为此笔者设想寻找一种简易的改进装置完善二氧化硫的性质探究。
在此基础上我们对经典实验进行分析、质疑、查阅资料、设计新方案、实验验证,最终以巧用球形冷凝管作为反应容器的方式,设计出一种二氧化硫性质探究实验的创新装置[2][3][4]。
一、原实验存在的问题经典的二氧化硫性质探究实验采用的是多个试剂瓶串联的方式来验证二氧化硫的氧化性、还原性、漂白性,存在着实验装置较为复杂难以组装,药品用量较大造成浪费等问题[5]。

二氧化硫性质实验的改进
1.实验装置
2.实验步骤
(1)取一个小塑料输液瓶,向其中加入1.5g左右的亚硫酸钠晶体。
(2)取一个带单孔橡皮塞的玻璃棒,从下到上依次用透明胶带粘
贴润湿的蓝色石蕊试纸、润湿的品红试纸和用高锰酸钾溶液润湿的
滤纸,然后插入瓶中,塞紧瓶口。
(3)取两支10mL的注射器,分别吸入3mL左右的70%的浓硫酸和
6mL左右的氢氧化钠浓溶液,然后分别插入输液瓶的两侧,并用橡
皮筋固定好。
(4)推动注射器活塞加入浓硫酸,观察三条试纸的颜色变化。
观
察完毕,再加入氢氧化钠浓溶液,吸收多余的二氧化硫气体。
3.实验优点
(1)实验器材廉价易得,实验装置组装简单。
(2)实验操作简单方便,实验现象明显,用时较短。
(3)实验药品消耗量少,有利于节约。
(4)整个实验在密闭系统中进行,而且用氢氧化钠溶液进行尾气
吸收,可防止有毒的二氧化硫逸出污染空气。
作者:高一(2)班贠启伦
指导教师:田红霞。

二氧化硫实验改进教学设计引言二氧化硫是一种有害气体,常见于一些工业生产过程和燃烧反应中。
教学中通过进行二氧化硫实验,可以帮助学生更好地理解该气体的性质、特点和相关反应。
本篇文档将从实验目的、实验步骤、实验材料和装置、实验步骤改进及安全注意事项等方面进行展开,为教师提供一个关于二氧化硫实验改进的教学设计。
一、实验目的1. 理解二氧化硫的性质和特点。
2. 探究二氧化硫的制备方法和相关反应。
二、实验材料和装置实验材料:- 二氧化硫气体- 空气- 石膏- 灯酒实验装置:- 反应瓶- 橡皮塞- 导管- 镊子- 燃烧器三、实验步骤1. 向反应瓶中加入适量的石膏。
2. 取适量的灯酒,加入到燃烧器中。
3. 将燃烧器点燃,并将其放入反应瓶中,同时用橡皮塞将反应瓶口封严。
4. 等待燃烧过程结束后,将燃烧器取出。
5. 用镊子将石膏中的产物取出并进行观察。
6. 将导管连接到反应瓶上,另一端通入水中,观察现象。
7. 将导管接到同样的反应瓶上,另一端通入碱性溶液中,观察现象。
四、实验改进为了使二氧化硫实验更加有趣和具有教学意义,可以进行以下实验改进:1. 添加颜色指示剂:在装置中添加颜色指示剂,如酚酞溶液,可以观察到气体溶液的颜色变化,激发学生的兴趣,并加深对气体溶解性质的理解。
2. 观察反应速率:在实验步骤中加入一定量的催化剂,观察反应速率的变化。
通过观察和比较不同反应条件下的实验结果,学生可以深入理解催化剂对反应速率的影响。
3. 进行反应机理探究:在实验结束后,引导学生深入探究二氧化硫与水和碱性溶液发生的反应机理,通过实验结果和观察现象,让学生自主思考并提出合理的解释。
4. 组织小组讨论:在实验过程中,将学生分成小组,让他们观察实验现象并及时记录并提出自己的观察结果和猜测。
在实验结束后组织小组讨论,让学生分享观察结果,并通过交流和讨论来加深对实验原理的理解。
五、安全注意事项在进行二氧化硫实验时,需要注意以下安全事项:1. 实验操作时需要戴上适当的个人防护装备,如实验手套和护目镜。

二氧化硫性质实验联合改进创新研究二氧化硫是一种常见的气体,有着强烈的刺激性气味,能够对人体造成严重的危害。
因此,对其性质进行深入的研究是非常必要的。
在实验中,我们可以通过改进创新研究的方法,更好地了解二氧化硫的性质。
一、实验原理二氧化硫在常温常压下为无色有刺激性的气体,不易溶于水,但能与水反应生成亚硫酸和硫酸。
二氧化硫容易被氧气氧化成三氧化硫,也可以和氯气反应生成氯化硫酰。
二氧化硫的化学式为SO2,分子量为64.06 g/mol。
在室温下,二氧化硫的密度为2.926 g/L,沸点为-10 ℃,熔点为-73.3 ℃。
二氧化硫是一种较强的还原剂,可以还原铁离子。
二、实验步骤1.准备试剂(1)硫酸铜(3)二氧化硫气体2.实验装置(1)采用蓝高真垂测管(2)毛细管插入式小玻璃管3.实验过程(1)将垂管中的一定量的浓硫酸加热至50℃,然后向试管中加入0.1 ml的硫酸铜溶液。
(2)将装有二氧化硫气体的玻璃球插入到试管中。
(3)利用毛细管首先抽取一小量溢出的蓝色液体后,将其染成紫红色。
(5)不断重复步骤3和4,直到紫红色消失。
三、实验结果与分析根据实验结果和分析,我们可以发现,二氧化硫是一种强还原剂,能够还原硫酸铜为金属铜。
同时,氧气也是一种很强的氧化剂,能够将二氧化硫氧化成三氧化硫。
在实验室中,可以通过将硫酸铜加入到溶液中,再向其中通二氧化硫气体来检测二氧化硫的含量。
四、改进创新研究在实验中,我们可以通过改进创新研究的方法,更好地了解二氧化硫的性质。
例如,我们可以采用红外光谱法来检测二氧化硫的含量和结构。
通过红外光谱仪检测溶液中的谱线,可以得到二氧化硫和亚硫酸的特征峰。
同时,我们还可以观察二氧化硫在不同温度下的性质变化。
通过改变温度,我们可以观察到二氧化硫在不同温度下的熔点和沸点,同时还能比较不同温度下二氧化硫的物理和化学性质的差异,更好地了解二氧化硫的性质。