tnf流程图
- 格式:pdf
- 大小:2.45 MB
- 文档页数:23

单抗制备流程1975年,Kohler和Milstein发现将小鼠骨髓瘤细胞和绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交细胞既可产生抗体,又可无限增殖,从而创立了单克隆抗体杂交瘤技术.这一技术上的突破不仅为医学与生物学基础研究开创了新纪元,也为临床疾病的诊、防、治提供了新的工具。
制备单克隆抗体包括动物免疫、细胞融合、选择杂交瘤、检测抗体、杂交瘤细胞的克隆化、冻存以及单克隆抗体的大量生产,要经过几个月的一系列实验步骤,下面按照制备单克隆抗体的流程顺序,逐一介绍其实验方法。
一、细胞融合前准备(一) 免疫方案选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。
一般要在融合前两个月左右确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定.1.颗粒性抗原免疫性较强,不加佐剂就可获得很好的免疫效果。
下面以细胞性抗原为例的免疫方案:初次免疫1×107/0.5ml ip (腹腔内注射)↓2~3周后第二次免疫1×107/0。
5ml ip↓3周后加强免疫(融合前三天)1×107/0.5ml ip或iv(静脉内注射)↓取脾融合2.可溶性抗原免疫原性弱,一般要加佐剂,常用佐剂:福氏完全佐剂,福氏不完全佐剂.要求抗原和佐剂等体积混合在一起,研磨成油包水的乳糜状,放一滴在水面上不易马上扩散呈小滴状表明已达到油包水的状态。
商品化福氏完全佐剂在使用前须振摇,使沉淀的分枝杆菌充分混匀。
初次免疫 Ag 1~50μg 加福氏完全佐剂皮下多点注射│(一般0.8~1ml 0.2ml/点)↓3周后第二次免疫剂量同上,加福氏不完全佐剂皮下或ip│(ip剂量不宜超过0.5ml)↓3周后第三次免疫剂量同上,不加佐剂,ip│(5~7天后采血测其效价,检测免疫效果)↓2~3周后加强免疫,剂量50~500μg为宜,ip或iv↓3天后取脾融合目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。

肿瘤坏死因子的生产工艺设计说明书
肿瘤坏死因子(TNF)是一种细胞因子,可以诱导肿瘤细胞和病原体细胞的坏死。
TNF在医学上被用来治疗某些类型的癌症和自身免疫性疾病。
TNF的生产工艺设计需要遵循以下步骤:
1. 选取合适的菌株:选择能够高效产生TNF的合适菌株。
2. 制备接种菌种:将菌株接种于适宜培养基中,通过批次培养达到高效生产TNF的目的。
3. 筛选培养条件:根据菌株的生长特性和目标产物产率的关系,优化培养条件,包括温度、pH值、酸碱度、氧气供应等参数的设定。
4. 收获发酵物:在合适的时期,收获菌体或培养液。
5. TNF提取:在TNF基因表达的细胞或者培养液中提取目标蛋白,包括细胞裂解、超声波破碎、液液分离、离子交换层析、亲和层析、透析等操作。
6. TNF纯化:运用联合层析方法进行TNF的纯化和精制,包括无机盐沉淀、层析吸附、高效液相层析等方法。
7. TNF结晶:将TNF得到结晶并进行晶体形态学分析,以确定其活性和纯度。
8. 活性检测:利用TNF敏感细胞进行活性检测,包括细胞增殖率、DNA合成率、免疫细胞释放细胞因子等方法。
9. 包装与储存:将TNF制品进行过滤、灭菌、瓶装、标记、储存和配送等工序。
在整个生产流程中,需要严格控制各个环节的质量,确保生产的TNF符合药典规定的质量标准,并采用合适的技术手段监测和控制各个工艺环节的运行情况。

人(human)肿瘤坏死因子a(TNF-a)说明书本试剂盒仅供研究使用标本:血清或者血浆一、试剂组成精密度微孔板96孔 (Microtitration Strips) 1块 2~8℃干燥保存酶标偶合液 (Conjugate ) 1瓶 12.0毫升 2~8℃冷藏保存标准品 (Standard) 5瓶各1.0毫升 2~8℃冷藏保存呈色剂A (Substrate A) 1瓶 6.0毫升 2~8℃避光冷藏保存呈色剂B (Substrate B) 1瓶 6.0毫升 2~8℃避光冷藏保存终止液 (Stopping Solution) 1瓶 6.0毫升室温保存20倍浓缩洗涤液 (Rinsing Buffer x 20) 1瓶 60.0毫升 2~8℃冷藏保存5倍浓缩样品稀释液 (Diluent x 5) 1瓶 15.0ml 2~8℃冷藏保存英文说明书,中文说明书各一份室温保存二、注意事项1. 此试剂为体外检测试剂,效期内使用,试剂应视为传染物,不同总批号的试剂不能混用。
2.使用前应将盒内各试剂取出。
室温放置至少30分钟,3.浓缩洗涤液出现结晶后,请于37℃孵育15分钟。
4.浓缩样品稀释液出现结晶后,请于37℃孵育15分钟5.若24小时内进行实验,标本可存放于2~8℃。
不需及时实验,标本-20℃保存,避免反复冻融。
6.在反复清洗微孔板,并扣干微孔中的残余液体,否则将降低精确度,造成吸光度偏离的假像。
7.加样完毕后,应注意轻微摇动微孔反应条,以便使孔中的液体充分混匀。
8.试剂盒保存于2~8℃,请勿冷冻,有效期请见盒内标示。
三、实验前准备1.使用前应将盒内各试剂取出,室温放置至少30分钟。
2.准备各种实验仪器及材料,如微量移液器,吸头,医用蒸馏水等3.浓缩洗液与医用蒸馏水1︰19倍稀释后成为应用洗涤液4.浓缩样品稀释液与医用蒸馏水1︰4倍稀释成应用样品稀释液5.用应用样品稀释液来稀释样品,按照1:100的体积比来稀释样品如10μl的样品加入到1ml的应用样品稀释液中,充分混匀待用。

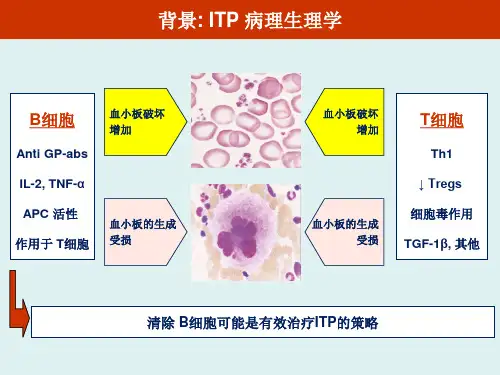
TNF-T N F 根据来源和结构不同分为T N F- a 、T N F -?,其中T N F-a 与⾻质疏松关系密切。
T N F 主要由单核巨噬细胞产⽣,另外,活化的T 细胞、⾃然杀伤细胞、肥⼤细胞、软⾻细胞也能分泌这种因⼦。
单核巨噬细胞合成的TN F 是⼀个25 ku 左右的⾮糖化跨膜蛋⽩,有两种不同的受体(P55 ,P75 ) ,其分⼦量分别为55 ku 和75 ku 。
T NF 与受体结合后,信号传⼈细胞内,通过N F -xB 或活化蛋⽩(A P ).1 转录因⼦来实现其功能。
⼈的TN F .a 基因位于第 6 对染⾊体上。
1975年E.A. Carswell等⼈发现接种卡介苗的⼩⿏注射细菌脂多糖后,⾎清中出现⼀种能使多种肿瘤发⽣出⾎性坏死的物质,将其命名为肿瘤坏死因⼦(tumor necrosis factor,TNF)。
⼋⼗年代⼈们发现其在消耗症中起了重要作⽤,⼜称恶液质素。
TNF主要由活化的巨噬细胞,NK细胞及T淋巴细胞产⽣。
1985年Shalaby把巨噬细胞产⽣的TNF命名为TNF-α,把T淋巴细胞产⽣的淋巴毒素(lymphotoxin,LT)命名为TNF-β。
虽然TNF-α与TNF-β仅有约30%的同源性,但它们却拥有共同的受体。
TNFα的⽣物学活性占TNF总活性的70 %~95 %,因此⽬前常说的TNF多指TNF-α。
1984年TNF基因的克隆开辟了临床试验的时代,是第⼀个⽤于肿瘤⽣物疗法的细胞因⼦,但因其缺少靶向性且有严重的副作⽤,⽬前仅⽤于局部治疗。
⼈类TNF-α基因于1985年成功克隆,定位于6p21.4,长约3.6 kbp,有4个外显⼦和3个内含⼦,与主要组织相容性复合体(MHC)基因紧密连锁位于HLA-B 和 HLA-C2 位点之间的 MHC3 类基因区内,由TNFA和TNFB组成,分别编码TNFα和TNFβ。
位于启动⼦区238位和308位存在单核苷酸多态性,被认为可调节TNF 的转录⽔平,与慢性⼄肝、⾃⾝免疫性疾病、胰岛素抵抗、肿瘤等多种疾病的易感性相关。
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。


一、TNF的发现及发展历史目前普遍认为,TNF最早是1975年由Carswell发现的。
Carswell在研究中观察到,经卡介苗致敏的小鼠被注射大肠杆菌内毒素后,血清中出现一种物质,该物质在体内可以使移植肿瘤发生出血、坏死,遂将该物质命名为肿瘤坏死因子(tumor necrosis factor, TNF)[1]。
其实早在十九世纪后期,Coley等就观察到,当肿瘤患者伴有感染时,其肿瘤偶尔可以消退甚至痊愈。
基于这些发现,Coley等开始用一些灭活的G+和G-细菌混合物作为疫苗,来治疗恶性肿瘤,称为“Coley毒素”疗法[2]。
Coley毒素的应用,大大提高了软组织肿瘤患者的生存率,这在当时获得了较高的评价。
1936年,随着Coley的去世,人们对Coley菌苗的兴趣被广泛应用的化疗和放疗所取代。
100多年后的今天,当人们再次关注“Coley毒素”疗法的时候,发现该疗法的主要原理之一就是通过诱导体内产生大量的TNF来实现抗肿瘤作用的[3]。
自Carswell发现TNF后,许多学者进行的其他研究均观察到TNF在体外和体内对多种肿瘤细胞有明显的细胞毒作用。
1984年Pennica等首次克隆了人TNF-α的cDNA,并在大肠杆菌中表达成功[4]。
随后,即有许多学者致力于将TNF 应用于临床的研究[5]。
自1987年起,在欧洲(德国、英国、法国、波兰、埃及等)、美国、日本等地陆续有进行TNFⅠ期和Ⅱ期临床试验的报道[6]。
但临床试验的结果给对TNF满怀希望的人们带来的是失望。
TNF类似严重感染所致的不良反应令患者难以耐受,而患者可以耐受的剂量似乎达不到抗肿瘤的浓度[7]。
一时间TNF的临床研究陷入了低谷,进一步的临床研究几乎停滞。
由于TNF明确的抗肿瘤活性,使得不少学者不愿轻易放弃对其的研究。
90年代中期以来,陆续有临床研究者报道了TNF局部用药的临床结果[8]。
证明TNF 局部用药(大剂量局部灌流、肿瘤内注射、腔内注射等)既可达到良好的抗肿瘤效果,又可避免全身用药的严重副作用,这一发现重新燃起了人们对TNF的热情。

REV20190712仅供研究,不用于临床诊断。
客服热线: 400-7060-959﹡技术支持邮箱: **************公司官网: 目录简介 ......................................................................................................................................................................... - 3 -检测原理 ................................................................................................................................................................. - 3 -试剂盒组分 ............................................................................................................................................................. - 4 -储存条件 ................................................................................................................................................................. - 5 -其他实验材料 ......................................................................................................................................................... - 5 -注意事项 ................................................................................................................................................................. - 5 -样本收集处理及保存方法 ..................................................................................................................................... - 6 -试剂准备 ................................................................................................................................................................. - 6 -操作步骤 ................................................................................................................................................................. - 7 -操作流程图 ............................................................................................................................................................. - 8 -操作要点提示 ......................................................................................................................................................... - 8 -结果判断 ................................................................................................................................................................. - 9 -结果重复性 ........................................................................................................................................................... - 10 -灵敏度 ................................................................................................................................................................... - 10 -特异性 ................................................................................................................................................................... - 10 -参考文献 ............................................................................................................................................................... - 10 -该产品由北京四正柏生物科技有限公司研制。


最新:造血干细胞移植相关血栓性微血管病诊断和治疗中国专家共识(最全版)造血干细胞移植(HSCT)是根治血液系统疾患重要的手段之一,随着HSCT技术的日益成熟和推广普及,国内HSCT例数逐年增加。
移植相关血栓性微血管病(TA-TMA)是一种HSCT的严重并发症。
目前对TA-TM A的发病机制得到了一定的深入和系统研究,但其诊断标准和治疗方案仍缺乏统一的临床规范。
因此,为进一步解决TA-TMA临床诊治的实际问题,建立并优化国内TA-TMA的临床诊治路径,中华医学会血液学分会发起制定本共识,为中国HSCT的临床实践提供规范合理的诊治指导意见。
一.定义和流行病学TA-TMA是一类以微血管性溶血性贫血、血小板减少、微血栓形成和多器官功能障碍为主要临床表现的造血干细胞移植后严重并发症。
若不及时治疗,TA-TMA患者死亡率为50%~90°/o,尤其高危患者死亡率高达80� 如血栓性微血管病(TMA)包括溶血尿毒综合征(HU S)、血栓性血小板减少性紫瘢(TT P)和HSCT、肿瘤、感染和自身免疫疾病等继发的TMA等。
TA-TMA是HSCT相关的继发性TMA。
TA-TMA根据确诊时间,分为早发型TA-TMA(确诊千移植后load内)和迟发型TA-TMA (确诊千移植后100d以后)两种类型。
目前,关千TA-T MA的发生率不同文献报道差异较大,主要与诊断标准等因素有关。
采用不同时期和不同学术组织对TA-T MA的诊断标准,TATMA在欧美国家的发生率为0·5%~25°/o0根据移植类型分类,国际上TA-T MA在异基因造血干细胞移植(al o H S CT)后的发生率为0.5%~64°/o , 自体造血干细胞移植(aut o H S CT)后TA-T MA的发生率<1%。
L aSk i n等分析近年来大样本回顾性研究结果发现,TA-T MA的发生率为10%~25°/o该结果可能更接近TA-T MA的真实发生率。
体外诊断试剂生产平面图
符合生产要求。
中国细胞和分子生物学会
一、预备工作
1、根据产品要求,建立质量管理体系并保证产品质量。
2、根据产品类型确定原料,按质量标准进行检验并进行记录。
3、建立产品生产过程,确定原料、研磨和稀释等操作规程。
4、准备所需的生产设备和检测仪器,严格按照规定的标准进行维护,并保证其质量的稳定。
二、生产流程
1、原料研磨和稀释:原料研磨到达指定标准后,进行稀释处理。
2、灌装:按照质量标准对各种试剂灌装,并根据灌装要求放置至存
放库。
3、包装:按照质量要求,对批量生产的体外诊断试剂进行有质量保
证的整体包装。
4、成品检验:检验成品的结构特性和性能特性,确保其达到规定的
标准。
5、质量检查:严格按照质量管理体系,对每个批次的体外诊断试剂
进行质量检查,并录入数据库系统。
三、废弃物处理
1、生产废弃物要定期进行清理,并及时处理,使其不会对下一批次的生产产生不利影响。
2、废弃物要按照规定报废,记录登记,加强监控,确保及时处理。
四、外来物料处理。
免疫名词解释简答题抗原:抗原是指所有能激活和诱导免疫应答的物质,通常指能被T、B淋巴细胞表面特异性抗原受体(BCR/TCR)识别及结合,激活T、B细胞增值、分化、产生免疫应答效应产物(特异性淋巴细胞或抗体),并与效应产物结合,进而发挥适应性免疫应答效应的物质。
超抗原:某些抗原物质,只需极低浓度即可非特异性激活人体T细胞2%—20%的T细胞克隆,产生极强的免疫应答。
抗原肽:具有免疫原性的多肽或抗原衍生肽,抗原肽是多肽类抗原而抗原不一定是多肽,可能还有其他物质。
AD(抗原表位):抗原分子中决定免疫应答特异性的特殊化学基团,是抗原与T/B细胞抗原受体(TCR/BCR)或抗体特异性结合的最小结构与功能单位。
免疫细胞T:T淋巴细胞来源于胸腺。
成熟T细胞定居于外周免疫器官的胸腺依赖区,它们不但介导适应性细胞免疫应答,在凶险依赖性抗原诱导的体液免疫应答中亦发挥重要的辅助作用。
B:B淋巴细胞由哺乳动物或禽类法氏囊中的淋巴样干细胞分化发育而来。
成熟B细胞主要定居于淋巴结皮质浅层淋巴小结和脾脏红髓及白髓淋巴小结内,约占外周淋巴细胞总数的20%。
B细胞表面的多种膜分子在其分化和功能执行中有重要作用。
B细胞不仅能通过产生抗体发挥特异性体液免疫功能,同时也是重要的抗原提呈细胞,并参与免疫调节。
MΦ(巨噬细胞):由定居和游走两类细胞组成:定居在不同组织中的MΦ有不同的命名,如肝脏中的库普弗细胞、中枢神经系统中的小胶质细胞、骨组织中的破骨细胞。
游走的巨噬细胞广泛分布在结缔组织中,寿命较长(可存数月),胞质内富含溶酶体颗粒及其相关的酶类物质,具有很强的变形运动和吞噬杀伤、清除病原体等抗原性异物的能力。
DC(树突状细胞):是机体功能最强的专职抗原递呈细胞(Antigen presenting cells, APC),它能高效地摄取、加工处理和递呈抗原,未成熟DC 具有较强的迁移能力,成熟DC能有效激活初始型T细胞,处于启动、调控、并维持免疫应答的中心环节。
VENN译文氏图、温氏图、范氏图,是在所谓的集合论,数学分支中,在不太严格的意义下用以表示集合的一种草图,用于表示不同事物的群组之间的数字或逻辑联系,适合用来表示集合或类之间的”大致关系“,也常常被用来帮助推导关于集合运算的一些规律,下面是分享的绘制VENN流程图方法介绍,一起学习吧!
绘制工具选择:询价诶画图是一款可以直接在线绘制各种思维导图、流程图等多种图形的网站,里面有很多的模板,可以直接在线套用模板进行绘制,拖曳式操作,很适合新手使用的哦!
绘制流程图方法介绍:
1.打开迅捷画图,点击页面中央【立即体验】进入类型选择界面,点击左上角【新建文件】选择【流程图】进入在线绘制界面;
2.在页面的四周有很多的工具栏,这些在绘制的过程中都是可以使用的,直接用鼠标将推行拖曳至右边画布需要的位置,之后再用连接线将其进行连接即可;
3.基本框架单间完后,我们需要做的就是将内容进行填充,双击
文本框即可,这时在右边出现的工具栏中将可以对文本的样式、排列及背景颜色根据自己的喜好进行设置;
4.这时一张完整的思维导图就在线制作完成了,点击右上角【导出】在弹出的菜单栏中支持7种格式的导出,选择自己需要的格式进行导出即可;
那么,大家是不是在绘制的过程中会有一个疑问呢?难道绘制流程图就必须自己绘制吗?有没有模板直接编辑呢?答案是当然有啦,下面是分享的流程图模板,大家可以看下:
收款业务流程图:
精简版地铁线路流程图:
EPC事件过程流程图:
财务部单据流程图:
职位统计流程图:
旅游行程路线图:
好啦,今天的分享到这里就结束了,认真阅读的你都看明白了吧,动手试试吧,光看不做事不行的哦!。
小鼠肿瘤坏死因子α (TNF-α)酶联免疫试剂盒使用说明书【预期应用】ELISA法定量测定小鼠血清、血浆、细胞培养物上清、组织裂解液中TNF-α含量。
【产品性能指标】1、检测范围:15.6 pg/ml-1000 pg/ml2、灵敏度:3.9 pg/ml3、精密度:批内差CV%<8%,批间差CV%<10%4、特异性:本试剂盒特异性检测小鼠TNF-α,且与其他相关蛋白无交叉反应。
【实验原理】用纯化的抗体包被微孔板,制成固相载体,往包被抗TNF-α抗体的微孔中依次加入标本或标准品、生物素化的抗TNF-α抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样本中的TNF-α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
【试剂盒组成成分】组份96T酶标板(Assay plate) 12条×8孔标准品(Standard) 2瓶(冻干品)生物素标记抗体(Biotin-antibody) 1 x 120 μl/瓶(100×)辣根过氧化物酶标记亲和素(HRP-avidin) 1 x 120 μl/瓶(100×)生物素标记抗体稀释液(Biotin-antibody Diluent) 1 x 15 ml/瓶辣根过氧化物酶标记亲和素稀释液(HRP-avidin Diluent) 1 x 15 ml/瓶样本稀释液(Sample Diluent) 1 x 50 ml/瓶浓洗涤液(Wash Buffer) 1 x 20 ml/瓶(25×)底物溶液(TMB Substrate) 1 x 10 ml/瓶终止液(Stop Solution) 1 x 10 ml/瓶板贴 4【存储条件及有效期】未开封试剂盒试剂盒避光保存于2-8℃。
有效期为六个月。
请在试剂盒标注的有效日期内使用。
TNF客網上操作流程
IT部USC
2010.12.13
輸入網址:https:// 輸入用戶名及密碼,點擊“Submit”進入,如圖page3.
(注:密碼會隔段時間更新,如密碼為001,更新為002,以此類推)
對於包裝,製作標籤等來說,主要應用兩個模塊,一是Move WIP,二是e—pack。
首先選擇Move WIP(Working In Process ),如page4所示。
在所標示的框中,輸入所需操作的PO(PO尾后加%,方可顯示全部信息),點擊“Find PO/Cut”,顯示此PO所有的信息。
點擊Move WIP下方的“車”的標誌。
進入page5.
在Select Stage 中選擇CUT,再點擊“Submit”顯示page6.
在Qty. to Move處輸入同Qty. Avail.一樣的數量,如圖所示,輸入3。
在點擊“Save WIP”進入page7
點擊“Post Wip Movement”
點擊“Make More WIP Movement”進入執行AUDT.
在Select Stage中選擇“AUDT”,再Qty. to Move 輸入3,再點擊“Save WIP”(注:當完成CUT時,會在CUT下顯示3)
點擊“Post Wip Movement”,進入下一個畫面。
點擊“Make More WIP Movement”完成MOVE WIP操作。
在e-sps中選擇e-pack.
在“Find PO/CUT”輸入剛剛完成Move WIP的PO%,點擊“Find PO/CUT”,顯示此PO的詳細情況,再點擊“Create Labels”小箱子,開始製作標籤。
(在填寫此畫面前,會有同事給你裝箱單,所填資料以裝箱單為主。
)在“Qty. Per Carton ”輸入裝箱單上所寫每箱所裝數量,再輸入總重量,凈重量,
箱子的長,寬,高。
再點擊“Post”製作標籤完成。
還會進入page14畫面。
(注:在裝箱單上一般寫箱子長寬高單位為尺寸,在填寫時需轉換,1英尺=2.54釐米)
當有尾數,點擊“Keep Packing”重複page13的操作。
都完成之後,在“e-SPS”中再選擇“e-Pack”會顯示page15的畫面。
在“Find PO/Cut“中輸入,剛操作完的PO%,點擊“Find PO/Cut”,顯示PO全信息再選擇“Print Labels”,進入page16.
在此選擇需打印的範圍,第一項為打印全部沒有打印的標籤;第二項為設置打印的頁碼,選擇性打印。
再選擇“Print Labels”。
顯示page17
顯示紙箱標籤的號碼及總數,點擊“Print”,顯示page18
標籤內容以記事本格式存儲,如果已經連接好印表機,點擊直接打印;如果還未連接好印表機,可點擊右鍵,另存為自己電腦上,待印表機設置好再打印。
如果在完成標籤后要更改標籤內容時,可點擊“Adjust Carton”,進入page20.
此畫面顯示了該PO的所有信息,點擊此PO,進入需該界面。
方框為可修改內容,一般長寬高及重量不修改,除非要更換紙箱。
大多數修改的為數量,即Update Units。
在某些情況下,標籤會棄用,我們需刪除此標籤,點擊“Delete Carton”顯示下圖,再勾選“Delete”,點擊“Delete Selected Cartons”,顯示page23.
顯示對話框,選擇“確定”刪除此標籤。