机理计算公式
- 格式:docx
- 大小:88.36 KB
- 文档页数:16

化学反应速率的反应级数计算化学反应速率是指单位时间内反应物消失或生成的物质的量的变化率。
在化学反应中,反应速率的大小与反应物浓度之间存在着一定的关系。
反应级数是指反应速率与各个反应物浓度之间的关系的指数。
通过确定反应级数,我们可以了解反应动力学的一些基本性质,如反应机理、反应速率常数以及反应物浓度对反应速率的影响等。
反应级数的计算方法主要有两种:实验法和理论法。
一、实验法实验法是通过进行一系列的实验来测定反应速率与反应物浓度的关系,从而确定反应级数。
下面以一阶反应为例进行说明。
1.一阶反应一阶反应的速率方程为:v = k[A]其中,v为反应速率,k为速率常数,[A]为反应物A的浓度。
根据实验数据,我们可以得到反应速率与反应物浓度的关系。
假设进行了几组实验,得到的数据如下表所示:实验组数[A]初始浓度(mol/L)时间(s)[A]浓度(mol/L)速率(mol/L·s)1 0.2 0 0.2 -2 0.2 10 0.1 0.023 0.1 10 0.05 0.014 0.2 20 0.04 0.01通过观察数据可知,反应速率与[A]的浓度成正比关系。
由速率方程可知,v与[A]之间的关系应该是指数关系。
因此,我们可以假设反应速率与[A]的浓度之间的关系为:v = k[A]^n根据实验数据,我们可以取其中的两组实验数据,代入速率方程,利用对数运算得到反应级数n的值。
取实验组1和实验组2,代入速率方程得到:0.02 = k(0.2)^n取实验组3和实验组4,代入速率方程得到:0.01 = k(0.1)^n将式子1除以式子2,消去k,得到:2 = (0.2/0.1)^n,化简得到:2 = 2^n解得n = 1,因此,反应级数n为1,即该反应为一阶反应。
二、理论法理论法是通过根据反应机理和反应速率方程推导出反应级数的计算方法。
以二阶反应为例,假设反应速率方程为:v = k[A]·[B],其中[A]和[B]分别为反应物A和B的浓度。

fmea风险评估三要素及计算公式
fmea的三要素:风险量化评估、列出原因/机理、寻找预防/改
善措施。
风险量化评估是指,在风险事件发生之前或之后(但还没有结束),该事件给人们的生活、生命、财产等各个方面造成的影响和损失的可能性进行量化评估的工作。
即,风险评估就是量化测评某一事件或事物带来的影响或损失的可能程度。
严重度(S)、频度(O)、不易探测度(D);因为这三个参数决定最终的RPN值。
如果想有效管理fmea,最好上线专业fmea软件,有消息称:上海通用已经明确要求,DFMEA需要专业系统管理FMEA风险系数,RPN Risk Priority Number.是严重度,发生率,探测度的乘积。
RPN=S×O×DS ---严重度1-10,数字越大,严重度
级别越高;O---频度1-10数字越大,越容易发生;D--探测度1-10
数字越大,越容易探测;RPN分值越高,风险系数越大,RPN的高低
并不是唯一判断FMEA的风险大小、实施相应对策的评价标准。
需要综合考虑S、O、D的先后顺序,以及对此三种影响着风险大小的理解与评估。

化学反应动力学中的反应级数计算方法化学反应是指化学物质相互转化的过程。
化学反应动力学是研究化学反应速率、机理和反应热力学的科学。
化学反应动力学中,反应级数是一个非常重要的概念,它决定了反应速率的特征和机理。
本文将详细介绍化学反应动力学中的反应级数计算方法。
一、反应级数的概念反应级数是指一个反应中各反应物的浓度对反应速率的影响程度。
根据反应级数,可将反应分为一级反应、二级反应、三级反应等不同类型,其中一级反应影响反应速率最大。
一级反应表示反应物的浓度对反应速率的影响程度为一次方,例如:A → 前体 + 产物当反应速率只随反应物A的浓度变化时,这个反应就是一级反应。
二级反应表示反应物的浓度对反应速率的影响程度为二次方,例如:A +B → 产物当反应速率随反应物A、B的浓度变化时,这个反应就是二级反应。
同理,三级反应表示反应物的浓度对反应速率的影响程度为三次方。
二、反应级数的计算方法反应级数的计算方法通常有两种:比值法和时间法。
1. 比值法比值法又称为初始斜率法,基本原理是利用反应前一段时间内的反应速率来确定反应级数。
反应前一段时间内,反应物的浓度变化很小,在反应速率与反应物浓度呈线性关系的情况下,反应级数即为反应速率与反应物浓度的线性关系次数。
①在一定温度下,将反应物A、B加入反应釜中,调节pH、加入催化剂等,使反应得以快速进行。
②在反应前的十分之一到五分之一段时间内,每隔一段时间(如10s或20s)记录反应物A、B的浓度。
③用第二组与第一组浓度数据差值除以时间得到反应物A、B 的反应速率。
④根据浓度-反应速率的关系作图,根据线性部分确定反应级数。
2. 时间法时间法又称为半衰期法,是利用反应速率和反应物浓度随时间变化的关系求解反应级数的方法。
通过测量半衰期来确定反应级数。
①在一定温度下,将反应物A、B加入反应釜中,调节pH、加入催化剂等,使反应得以快速进行。
②记录反应物A、B的浓度随时间的变化。
③求取半衰期T1/2,通过反应级数公式计算反应级数。

化学结构理论计算公式化学结构理论计算是一种重要的理论方法,它可以用来预测分子的结构、性质和反应。
在化学研究中,理论计算可以帮助化学家理解分子的行为,并为实验设计提供指导。
本文将介绍一些常用的化学结构理论计算公式,并探讨它们在化学研究中的应用。
1. 分子轨道理论。
分子轨道理论是一种描述分子电子结构的理论方法。
它通过求解分子的薛定谔方程来得到分子的轨道能级和轨道波函数。
分子轨道理论的基本公式可以用哈密顿算符表示:HΨ = EΨ。
其中,H是分子的哈密顿算符,Ψ是分子的波函数,E是分子的能量。
通过求解这个方程,可以得到分子的轨道能级和轨道波函数,从而揭示分子的电子结构和性质。
分子轨道理论在化学研究中有着广泛的应用。
它可以用来解释分子的光谱性质、化学键的形成和断裂过程,以及分子的反应机理。
此外,分子轨道理论还可以用来设计新的分子材料,预测分子的性质和反应活性。
2. 密度泛函理论。
密度泛函理论是一种用来描述分子电子结构的理论方法。
它通过求解分子的电子密度来得到分子的能量和性质。
密度泛函理论的基本公式可以用密度泛函表示:E[ρ] = T[ρ] + V[ρ] + Eee[ρ] + Exc[ρ]其中,E[ρ]是分子的总能量,T[ρ]是分子的动能,V[ρ]是分子的外势能,Eee[ρ]是分子的电子-电子相互作用能,Exc[ρ]是分子的交换-相关能。
通过求解这个方程,可以得到分子的能量和电子密度,从而揭示分子的结构和性质。
密度泛函理论在化学研究中有着广泛的应用。
它可以用来预测分子的结构、光谱性质和反应活性,解释分子的化学键和反应机理,设计新的分子材料。
此外,密度泛函理论还可以用来模拟分子的动力学过程,预测分子的稳定性和反应速率。
3. 分子力场理论。
分子力场理论是一种用来描述分子结构和振动的理论方法。
它通过求解分子的势能函数来得到分子的力场和振动频率。
分子力场理论的基本公式可以用势能函数表示:V(r) = Σi<j Vi,j(r)。

细胞分裂计算公式细胞分裂是生物体生长和发育的基本过程,也是细胞繁殖的方式之一。
它是通过一个细胞分裂成两个完全相同的细胞,并且遗传物质也被平均分配给两个细胞。
细胞分裂的计算公式是一种描述细胞分裂过程的方式,可以帮助我们更好地理解细胞分裂的机理。
细胞分裂的计算公式可以分为两个阶段:有丝分裂和无丝分裂。
有丝分裂是指细胞在分裂过程中形成一个类似于线的结构称为纺锤体,通过纺锤体的作用将染色体均匀地分配给两个细胞。
而无丝分裂是指细胞在分裂过程中没有形成纺锤体,染色体通过其他方式进行分裂。
下面将详细介绍这两个阶段的细胞分裂计算公式。
有丝分裂是细胞分裂的常见方式,它包括减数分裂和有丝分裂。
减数分裂是指生殖细胞在分裂过程中形成四个细胞,每个细胞含有一半的染色体数目。
有丝分裂是指体细胞在分裂过程中形成两个细胞,每个细胞含有完整的染色体数目。
在有丝分裂中,细胞分裂的计算公式可以用以下方式表示:1. 有丝分裂的数目公式:n = 2^n其中,n表示有丝分裂的次数,2^n表示每次有丝分裂后细胞的数量。
例如,如果有一次有丝分裂,那么细胞的数量就是2^1=2;如果有两次有丝分裂,那么细胞的数量就是2^2=4。
这个公式可以帮助我们计算在有丝分裂过程中细胞的数量变化。
无丝分裂是细胞分裂的另一种方式,它包括原核分裂和真核分裂。
原核分裂是指原核生物在分裂过程中直接分裂成两个细胞,每个细胞含有完整的染色体数目。
真核分裂是指真核生物在分裂过程中通过其他方式分裂。
在无丝分裂中,细胞分裂的计算公式可以用以下方式表示:2. 无丝分裂的数目公式:n = 2n其中,n表示无丝分裂的次数,2n表示每次无丝分裂后细胞的数量。
例如,如果有一次无丝分裂,那么细胞的数量就是2*1=2;如果有两次无丝分裂,那么细胞的数量就是2*2=4。
这个公式可以帮助我们计算在无丝分裂过程中细胞的数量变化。
细胞分裂的计算公式可以帮助我们更好地理解细胞分裂的过程。
通过对细胞分裂的计算公式的研究,我们可以预测细胞分裂过程中细胞数量的变化。

化学反应动力学的基本原理和计算方法化学反应动力学是研究反应速率和反应机理的一个分支学科,对于化学反应的研究和应用具有重要意义。
本文将围绕化学反应动力学的基本原理和计算方法展开探讨。
一、反应速率常数反应速率常数是化学反应动力学的一个重要参数,是描述反应速率的数量指标。
在众多化学反应中,反应速率一般是反应物浓度的某个函数,简单化学反应可以表示为:A +B → C反应速率可以通过反应物A和B的浓度来表示:速率= k·[A]·[B],其中k就是反应速率常数。
反应速率常数受到温度等因素的影响,其中最重要的是温度。
一般情况下,反应速率常数会随着温度的升高而增加,符合阿累尼乌斯方程:ln k2/k1 = Ea/R(1/T1-1/T2),其中k1和k2分别表示温度下的反应速率常数,Ea是反应活化能,R是气体常数,T1和T2分别是两个温度。
二、反应级数反应级数是指反应物对于反应速率的影响程度,可以通过实验数据来确定。
对于多元反应,反应级数可以通过推导反应速率常数的表达式来确定。
下面举一个例子:2 NO + Cl2 → 2 NOCl通过实验数据可以确定,反应速率与[NO]和[Cl2]的浓度之积有关,因此速率表达式可以写成:速率 = k·[NO]²[Cl2]。
可以看出,这是一个三级反应,NO和Cl2的浓度的平方的乘积为3级。
该反应也可以用降解增加法求解,可以求得反应分子为4。
三、反应机理化学反应机理是指化学反应的分子层面的过程描述,可以通过实验数据来确定。
通常情况下,通过测量不同反应物浓度下的反应速率,来确定反应机理。
对于复杂反应,可以通过推导反应机理的分子层面过程来分析。
例如,对于二元反应,可以通过分步反应分析来推导反应机理。
分步反应分析方法主要是通过推算反应的每一个步骤,并确定每一个步骤的速率表达式来确定反应机理。
四、计算方法对于反应速率常数的计算,通常是在实验室中进行测量和计算。

一、简述飞机升力产生的机理及升力的计算公式和物理意义答:气流以一定的正迎角流经机翼,机翼上便面流管变细,气流速度增大,压力下降;机翼下表面流管变粗,气流速度减小,压力升高。
机翼上表面负压,下表面正压,机翼总气动力在竖直方向的分量形成升力,在水平方向的分量形成阻力。
升力计算公式:L = CL﹒1/2ρV^2﹒S其中: CL—升力系数1/2ρV^2—飞机的飞行压力S—机翼的面积二、说明气体的伯努利方程的物理意义和使用条件?答:P+1/2ρV^2 = P0 =常数方程的物理意义:空气在低速一维定常流中,同一流管的各个截面上,静压与动压之和(总压)相等。
在同一流管中,流速快的地方,压力小;流速慢的地方压力大。
方程使用条件:1. 气流式连续的,稳定的气流(定常流)2. 没有粘性(理想气体)3. 空气的密度变化可以忽略不计(不可压流)三、简述升力系数曲线,阻力系数曲线,升阻比曲线的意义。
1. 升力系数曲线:升力系数和迎角之间的关系曲线阻力系数曲线:阻力系数和迎角之间的关系曲线随着迎角的增加,升力系数和阻力系数都增加,在一定迎角范围内,升力系数呈线性增大,而阻力系数按抛物线的规律增大。
阻力系数在小迎角范围内增加较慢,随后增大速度加快,比升力系数增大的速度更快。
在升力系数达到最大值之后,升力曲线由上升转为下降,升力系数开始减小,而阻力系数增加得更快。
2. 升阻比曲线:升阻比随迎角的变化曲线当升力系数等于0时,升阻比也等于0,升阻比随迎角的增大而增大。
由负值增大到0再增大到最大值,然后,随着迎角的增加而逐渐减少。
四、简述高速飞机的气动外形的特点。
1. 采用薄翼型:翼型的相对的厚度越小,上翼面的气流加速就越缓慢,速度增量就越小,可以有效地提高的临界马赫数和飞机的最大平飞速度。
2. 后掠机翼:可以提高飞机临界马赫数,并可以减小波阻。
3. 小翼弦比的机翼:提高飞机的临界马赫数,减少诱导阻力。
4. 涡流发生器和翼刀:①涡流发生器:防止或减弱激波诱导的附面层分离,推迟波阻的急剧增加和减缓波阻增加得趋势,改善飞机的跨音速空气动力特性。
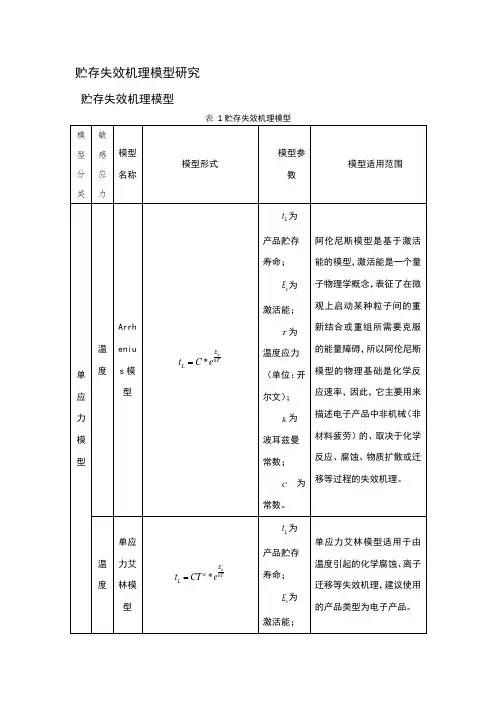
贮存失效机理模型研究贮存失效机理模型贮存失效机理模型贮存寿命模型分析 单应力模型(1)阿伦尼斯模型19世纪阿伦尼斯研究了温度应力激发类化学过程,在大量数据的基础上提出了阿伦尼斯加速模型。
该模型适用于加速应力为单一温度应力的产品,导弹在贮存期内遭受的最主要的应力是温度应力,所以阿伦尼斯模型在电子产品的加速贮存寿命试验中得到了广泛的应用。
如在美军导弹研究和发展报告《小型/中型数字和无偏集成电路分析》(ADA053415)中运用阿伦尼斯模型来估计非工作状态下的集成电路的寿命。
阿伦尼斯模型的形式如下:*aE kTL t C e(4-1)L t 为产品贮存寿命;a E 为激活能;T为温度应力(单位:开尔文); k为波耳兹曼常数;C 为常数。
阿伦尼斯模型是基于激活能的模型,激活能是一个量子物理学概念,表征了在微观上启动某种粒子间的重新结合或重组所需要克服的能量障碍,所以阿伦尼斯模型的物理基础是化学反应速率,因此,它主要用来描述电子产品中非机械(非材料疲劳)的、取决于化学反应、腐蚀、物质扩散或迁移等过程的失效机理。
(2)艾林模型Eyring 于1935年提出了艾林模型。
单应力的艾林模型是根据量子力学原理推导出的,它表示某些产品的寿命特性是绝对温度的函数。
当绝对温度在较小范围内变化时,单应力艾林模型近似于阿伦尼斯模型,在很多应用场合可以用这两个模型去拟合数据,根据拟合好坏来决定选用哪一个加速模型。
所以,艾林模型也常常用于电子产品的加速贮存寿命试验。
Glasstene 、Laidler 、Eyring 在1941年提出一个加速模型,该模型被称为广义艾林模型,该模型适用于产品同时遭受温度应力与另一其他环境应力的情况,但需要假设温度应力与另一环境应力互不干涉。
导弹在贮存期内的运输、装卸和定期检测等环境情况下,弹上产品会同时遭受温度和其他应力,此时就可以使用广义艾林模型。
单应力艾林模型的形式如下:*aE kTL t CT eα= (4-2)L t 为产品贮存寿命;a E 为激活能;T为温度应力(单位:开尔文); k为波耳兹曼常数; C α、为常数。

经济性分析计算公式
1、基本概念
(1)煤中硫的氧化反应机理:S + O2=SO2
(2)二氧化硫排放量: D1=B×S×
其中:
D1……SO2产生量(kg/h)
S……燃煤全硫份含量(%)
B……耗煤量(kg/h)
……可燃硫转化二氧化硫的转换系数。
2、脱硫效率
以耗煤量15t/h、烟气量100000Nm3/h、燃煤全硫份含量为%计算:
脱硫前二氧化硫排放量=
D1=B×S× =15t/h×%×=153kg/h
标准状况下的烟气量为100000Nm3/h(压强近似为标准大气压),则转换成工况烟气量为:
(200℃+273K)×100000Nm3/h/273K=173260m3/h
脱硫前每立方米烟气中的二氧化硫含量=
153kg/h×106÷173260m3/h=m3
满足脱硫后SO2排放浓度≤300 mg/m3要求,则最低脱硫效率
η= 1-( 300/)=67%
3、计算氨消耗量(费用)
计算依据
NH3·H2O +SO2→N H4H SO3
根据SO2原始排放量为153kg/h,脱硫效率67%计算得每小时消耗纯氨(100%浓度)h。
折合浓度为5%氨水
a、需5%浓度的氨水÷5%=544kg/h
b、需加水=h
c、折合成20%浓度的氨水质量136kg。
配成5%浓度加水408 kg(每小时流量)
d、按市场价20%浓度氨水元/吨、自来水元/吨计算:
(1)*136*10-3=元/h
(2)*408*10-3=元/h。
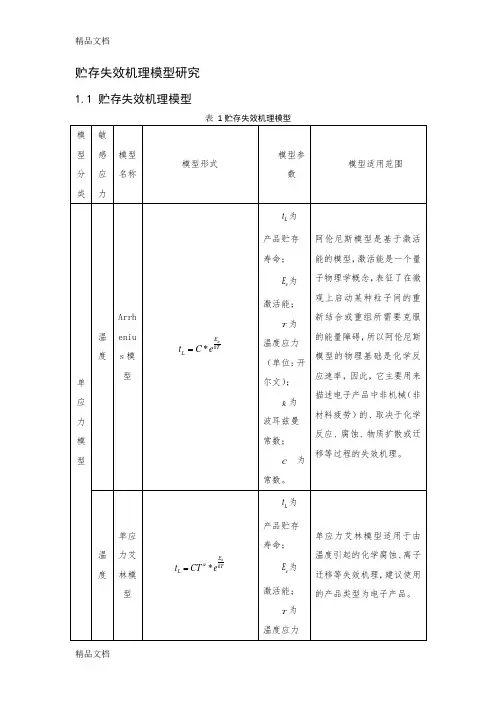
贮存失效机理模型研究1.1 贮存失效机理模型贮存失效机理模型4.2 贮存寿命模型分析 4.2.1 单应力模型(1)阿伦尼斯模型19世纪阿伦尼斯研究了温度应力激发类化学过程,在大量数据的基础上提出了阿伦尼斯加速模型。
该模型适用于加速应力为单一温度应力的产品,导弹在贮存期内遭受的最主要的应力是温度应力,所以阿伦尼斯模型在电子产品的加速贮存寿命试验中得到了广泛的应用。
如在美军导弹研究和发展报告《小型/中型数字和无偏集成电路分析》(ADA053415)中运用阿伦尼斯模型来估计非工作状态下的集成电路的寿命。
阿伦尼斯模型的形式如下:*aE kTL t C e(4-1)L t 为产品贮存寿命;a E 为激活能;T为温度应力(单位:开尔文); k为波耳兹曼常数;C 为常数。
阿伦尼斯模型是基于激活能的模型,激活能是一个量子物理学概念,表征了在微观上启动某种粒子间的重新结合或重组所需要克服的能量障碍,所以阿伦尼斯模型的物理基础是化学反应速率,因此,它主要用来描述电子产品中非机械(非材料疲劳)的、取决于化学反应、腐蚀、物质扩散或迁移等过程的失效机理。
(2)艾林模型Eyring 于1935年提出了艾林模型。
单应力的艾林模型是根据量子力学原理推导出的,它表示某些产品的寿命特性是绝对温度的函数。
当绝对温度在较小范围内变化时,单应力艾林模型近似于阿伦尼斯模型,在很多应用场合可以用这两个模型去拟合数据,根据拟合好坏来决定选用哪一个加速模型。
所以,艾林模型也常常用于电子产品的加速贮存寿命试验。
Glasstene 、Laidler 、Eyring 在1941年提出一个加速模型,该模型被称为广义艾林模型,该模型适用于产品同时遭受温度应力与另一其他环境应力的情况,但需要假设温度应力与另一环境应力互不干涉。
导弹在贮存期内的运输、装卸和定期检测等环境情况下,弹上产品会同时遭受温度和其他应力,此时就可以使用广义艾林模型。
单应力艾林模型的形式如下:*aE kTL t CT eα= (4-2)L t 为产品贮存寿命;a E 为激活能;T为温度应力(单位:开尔文); k为波耳兹曼常数; C α、为常数。

化学反应的反应速率和反应机理化学反应是物质发生变化的过程,其中的一个重要特征就是反应速率。
反应速率指的是反应物转化为生成物的速度,在化学反应中起着重要的作用。
同时,反应速率也取决于反应的机理,即反应路径和步骤。
本文将探讨化学反应的反应速率和反应机理的相关内容。
一、反应速率反应速率描述的是反应物浓度变化随时间变化的快慢程度。
通常用以下公式来计算反应速率:反应速率 = (反应物的浓度变化量) / (反应时间)例如,对于简单的一级反应A → 产物,反应速率可以表示为:反应速率 = -(Δ[A]) /Δt其中,Δ[A]表示反应物A的浓度变化量,Δt表示反应时间的变化量。
反应速率通常用mol/(L·s)或M/s来表示。
反应速率与反应物浓度的关系可以通过速率方程来描述。
速率方程表明了反应速率与反应物浓度之间的关系。
例如,对于简单的一级反应,速率方程可以写为:速率 = k[A]其中,k为速率常数,[A]为反应物A的浓度。
二、影响反应速率的因素反应速率受多种因素的影响,包括温度、浓度、催化剂和表面积等。
这些因素对反应速率的影响可以通过反应速率方程来描述。
1. 温度:温度的升高会导致反应物分子的平均动能增加,分子的碰撞频率和能量也相应增加,从而加快反应速率。
根据阿伦尼乌斯方程,反应速率与温度之间呈指数关系:速率 = A·e^(-Ea/RT)其中,A为指前因子,Ea为活化能,R为气体常数,T为温度。
可以看出,温度对反应速率具有显著影响。
2. 浓度:反应物浓度的增加会增加反应物分子之间的碰撞频率,从而提高反应速率。
对于简单的一级反应,反应速率与反应物浓度呈线性关系。
3. 催化剂:催化剂是一种可以加速化学反应的物质,它通过降低反应活化能来促进反应速率。
催化剂不参与反应本身,因此在反应结束后可重新利用。
4. 表面积:反应物的表面积增大时,反应速率也会增加。
这是因为反应物分子在表面上的接触面积增大,提高了碰撞频率。
化学反应机理和反应速率的计算化学反应是指化学物质间的相互作用过程,其中原子、分子或离子间的键被断裂或者生成新的键。
化学反应过程通常包含两个方面,一是化学物质间的作用和变化,二是反应的速率。
本文介绍了化学反应机理和反应速率的计算方法。
一、化学反应机理化学反应的机理是指一系列原子、分子或离子间的反应步骤,这些步骤以及相应的中间体、转化物和反应生成物的生成与消失关系共同构成了反应的机理。
例如,下面的化学反应式:2NO + O2 →2NO2在该反应中,中间体NO3的生成和消失可以分别由以下反应式描述:NO + O2 →NO3NO3 + NO → 2NO2化学反应的机理研究对于了解反应动力学行为及分子结构解析具有重要意义。
二、反应速率化学反应的速率指反应物转化成反应生成物的速度。
而反应速率的大小有很多因素的影响,包括摩尔浓度、温度和催化剂等。
在反应达到动态平衡状态下,反应速率等于反应生成物被消耗的速率。
反应速率是一个关于反应物摩尔浓度的函数。
温度的变化可以对反应速率造成很大的影响,如果反应温度升高,则反应速率会增加;如果温度降低,则反应速率会降低。
三、反应速率的计算反应速率的计算就是要确定一个化学反应的摩尔数随时间的变化关系,从而得到反应速率。
主要有以下方法:1、初始速率法:在化学反应开始时,如何确定反应速率?这就需要使用初始速率法。
当化学反应开始时,反应物的浓度随时间的变化极小,因此反应速率可以近似认为是随时间线性增加的。
可以通过初始时的浓度差异来计算反应速率。
2、积分法:可以先将反应物及生成物的摩尔数差分方程转化为只含一个变量的常微分方程,进而加以解决。
这是通过积分的方法来计算反应速率。
3、动力学法:动力学是研究化学反应速率与反应物浓度关系的科学。
通常采用浓度变化或发光法来测定反应速率,其数学表达式是由速率常数和反应物浓度组成的。
总之,化学反应机理和反应速率的计算方法可以有多种选择,主要取决于具体的研究和应用目的。
化学稳定性与反应机理的计算化学反应是指原子、离子或分子在互相作用的过程中发生的变化,从而形成新的分子或离子。
在化学反应中记录反应物到产物的转化是十分重要的,而化学稳定性与反应机理的计算则可以帮助我们更加深入地理解和预测这些转化。
化学稳定性是指一种化学物质在给定条件下保持其结构和组成不变的能力。
在化学反应中,一个分子的稳定性越高,它在反应中就越难被分解或转化为其他物质。
反之,一个分子的稳定性越低,它就更容易被分解或转化。
为了计算化学稳定性,我们需要考虑分子内的化学键能以及分子中的电荷密度分布等因素。
其中,分子内的化学键能是影响分子稳定性的最重要因素之一。
通过分子内的化学键能的计算,我们可以比较不同分子之间的稳定性差异。
反应机理则是描述化学反应发生的途径和步骤。
在反应机理中,我们需要确定反应物转化为产物的过程中所发生的分子和离子的构型变化,以及生成的中间体和过渡态等信息。
这些信息可以帮助我们理解反应的速率和路线,在设计合成化合物时也可以起到指导作用。
为了计算反应机理,我们需要使用分子模拟和量子化学计算等工具。
在分子模拟中,我们可以使用分子动力学模拟或蒙特卡罗模拟等方法来模拟原子和分子之间的相互作用。
在量子化学计算中,我们可以使用密度泛函理论或哈特里-福克方程等方法来计算反应物和产物之间的相对能量和过渡态的构型等信息。
值得注意的是,化学反应的计算是一项复杂的工作,其结果也会受到理论方法、模型参数以及计算精度等因素的影响。
因此,在进行化学反应的计算时,需要谨慎选择计算方法并进行多次独立的重复计算。
总结起来,化学稳定性和反应机理的计算可以帮助我们更好地理解化学反应过程,预测和指导化学合成,以及开发新的化学反应工艺。
而在进行这些计算的过程中,需要注意选择合适的计算方法和进行准确的计算,以期获得可靠的结果。
反应机理计算
反应机理计算是指根据化学反应过程中离子、分子、反应物和生成物之间的化学键和能量变化,推导出反应机理的过程。
具体地说,反应机理计算分为以下几个步骤:
1. 确定反应物和生成物:首先需要确定化学反应的反应物和生成物,可以根据反应条件和反应方程式来确定。
2. 确定反应物的电子结构:反应物的电子结构是指包括化学键、非共价键和孤对电子在内的反应物分子的所有电子状态。
可以通过分子轨道理论或者密度泛函理论等计算手段,对反应物的电子结构进行计算与分析。
3. 找到反应物之间可能发生的反应路径:根据反应物的电子结构,可以找到反应物之间可能发生的反应路径。
这些反应路径可以通过过渡态、活化能和反应物与生成物的自由能差来描述。
4. 确定反应物之间的反应机理:根据反应路径,可以推导出反应物之间的反应机理。
反应路径越少,反应机理越简单,反之,反应机理越复杂。
5. 验证反应机理的正确性:最后要对反应机理进行验证,包括计算反应物吸附能、离子解离能、电子亲和能、反应物间的距离等参数的计算,以及与实验数据的比较等。
通过反应机理计算,可以深入了解反应的过程和机理,在材料科学、工业制造等领域具有广泛应用。
化学反应机理和化学反应过程的理论计算化学反应是物质变化的过程,它涉及到物质之间的相互作用和电子的转移。
化学反应机理是用来描述化学反应中每一步所发生的反应,并以此来解释反应物和产物之间的关系。
而化学反应过程的理论计算,指的是利用量子化学理论和计算机科学方法,模拟化学反应过程的机理和性质,以便更好地理解这些反应的复杂性质。
一、理论基础化学反应的机理是由一个或多个基本反应过程组成的,它们的速率决定了整个反应的速率。
基本反应过程可以分为三类:物理过程、化学吸附和化学反应。
其中,化学反应是最重要的一部分。
化学反应的机理和热力学性质是相互关联的,它们共同决定了反应的速度和产物选择性。
化学反应的机理可以通过实验方法来研究,比如观察反应物和产物的分子结构、反应活化能和反应速率。
但是这种方法非常耗时、耗费资金。
因此,理论计算成为了一种重要的研究手段。
量子化学理论和计算机科学方法可以精确计算化学反应的机理和热力学性质,从而获得一些实验上难以获得的信息。
二、量子化学理论量子化学理论是描述分子和原子结构的理论,其核心思想是解决薛定谔方程,以获得分子的波函数和波函数的本征脉冲。
这些本征脉冲包含了双原子分子和多原子分子之间的相互作用,以及与其他分子和环境的相互作用。
通过量子化学理论,我们可以计算化学反应的过程和性质,包括平衡常数、反应活化能、反应速率和反应机理等。
其中,反应活化能是一个核心参数,它描述了一个反应需要克服多少能量障碍才能进行。
三、计算机科学方法计算机科学方法可以帮助化学家理解分子和反应的性质、预测其行为和构建模型。
计算机模拟可以帮助化学家分析和理解分子的结构、动力学和热力学性质。
在计算机科学中,数值方法是一种常用的计算方法,它通常利用微积分和计算机程序来模拟分子的动力学运动。
另一方面,计算机科学方法还可以应用于化学反应机理的计算中,为化学反应机理的研究提供了强大的工具。
四、结论化学反应机理和化学反应过程的理论计算在理论和实践中扮演了重要角色,它们可以帮助我们更好地理解化学反应以及相关的热力学性质。
化学反应机理的理论计算化学反应机理的理论计算是一项重要的研究方法,可以揭示反应过程中分子之间的相互作用以及各个步骤的能量变化。
本文将介绍化学反应机理的理论计算方法以及其在研究中的应用。
1. 理论计算方法的基础理论计算方法的基础是量子力学的原理。
量子力学可以描述微观粒子间的相互作用,并计算能量、几何构型、动力学等性质。
在化学领域,常用的理论计算方法包括密度泛函理论(DFT)、哈特里-福克(HF)方法、多配置自洽场(MCSCF)方法等。
2. 化学反应机理的探索通过理论计算方法,研究者可以探索化学反应机理中各个步骤的能量变化、中间体的生成以及反应物与产物之间的转化关系。
这对于了解反应机理的细节非常重要,有助于设计更高效的催化剂以及优化反应条件。
3. 动力学模拟理论计算方法还可以通过动力学模拟来研究反应速率以及反应过程中的能垒。
通过这种方法,研究者可以预测反应速率常数,并了解反应中的速率控制步骤。
这对于优化反应条件以及理解化学反应动力学规律具有重要意义。
4. 模型优化化学反应机理的理论计算还可以用于模型的优化。
通过理论计算方法,可以预测不同反应条件下的反应物与产物的生成情况,并进行模型的修正和优化。
这对于降低实验成本、提高反应效率非常有帮助。
总结:化学反应机理的理论计算是一项极具挑战性的工作,但也是十分重要的。
它可以揭示反应过程中的微观机理,并且对于设计更高效的催化剂、优化反应条件以及预测反应速率具有重要意义。
通过不断改进和发展理论计算方法,我们可以更加深入地了解化学反应的本质,并为实验提供更多的指导和理论依据。
(总字数:326)。
机理计算公式(总16页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--贮存失效机理模型研究贮存失效机理模型表 1贮存失效机理模型贮存寿命模型分析 单应力模型(1)阿伦尼斯模型19世纪阿伦尼斯研究了温度应力激发类化学过程,在大量数据的基础上提出了阿伦尼斯加速模型。
该模型适用于加速应力为单一温度应力的产品,导弹在贮存期内遭受的最主要的应力是温度应力,所以阿伦尼斯模型在电子产品的加速贮存寿命试验中得到了广泛的应用。
如在美军导弹研究和发展报告《小型/中型数字和无偏集成电路分析》(ADA053415)中运用阿伦尼斯模型来估计非工作状态下的集成电路的寿命。
阿伦尼斯模型的形式如下:*a E kTL t C e= (4-1)L t 为产品贮存寿命; a E 为激活能;T为温度应力(单位:开尔文); k为波耳兹曼常数;C 为常数。
阿伦尼斯模型是基于激活能的模型,激活能是一个量子物理学概念,表征了在微观上启动某种粒子间的重新结合或重组所需要克服的能量障碍,所以阿伦尼斯模型的物理基础是化学反应速率,因此,它主要用来描述电子产品中非机械(非材料疲劳)的、取决于化学反应、腐蚀、物质扩散或迁移等过程的失效机理。
(2)艾林模型Eyring 于1935年提出了艾林模型。
单应力的艾林模型是根据量子力学原理推导出的,它表示某些产品的寿命特性是绝对温度的函数。
当绝对温度在较小范围内变化时,单应力艾林模型近似于阿伦尼斯模型,在很多应用场合可以用这两个模型去拟合数据,根据拟合好坏来决定选用哪一个加速模型。
所以,艾林模型也常常用于电子产品的加速贮存寿命试验。
Glasstene 、Laidler 、Eyring 在1941年提出一个加速模型,该模型被称为广义艾林模型,该模型适用于产品同时遭受温度应力与另一其他环境应力的情况,但需要假设温度应力与另一环境应力互不干涉。
导弹在贮存期内的运输、装卸和定期检测等环境情况下,弹上产品会同时遭受温度和其他应力,此时就可以使用广义艾林模型。
贮存失效机理模型研究1.1 贮存失效机理模型贮存失效机理模型4.2 贮存寿命模型分析 4.2.1 单应力模型(1)阿伦尼斯模型19世纪阿伦尼斯研究了温度应力激发类化学过程,在大量数据的基础上提出了阿伦尼斯加速模型。
该模型适用于加速应力为单一温度应力的产品,导弹在贮存期内遭受的最主要的应力是温度应力,所以阿伦尼斯模型在电子产品的加速贮存寿命试验中得到了广泛的应用。
如在美军导弹研究和发展报告《小型/中型数字和无偏集成电路分析》(ADA053415)中运用阿伦尼斯模型来估计非工作状态下的集成电路的寿命。
阿伦尼斯模型的形式如下:(4-1)为产品贮存寿命;为激活能;为温度应力(单位:开尔文); 为波耳兹曼常数;为常数。
阿伦尼斯模型是基于激活能的模型,激活能是一个量子物理学概念,表征了在微观上启动某种粒子间的重新结合或重组所需要克服的能量障碍,所以阿伦尼斯模型的物理基础是化学反应速率,因此,它主要用来描述电子产品中非机械(非材料疲劳)的、取决于化学反应、腐蚀、物质扩散或迁移等过程的失效机理。
(2)艾林模型Eyring 于1935年提出了艾林模型。
单应力的艾林模型是根据量子力学原理*aE kTL t C eL t a E TkC推导出的,它表示某些产品的寿命特性是绝对温度的函数。
当绝对温度在较小范围内变化时,单应力艾林模型近似于阿伦尼斯模型,在很多应用场合可以用这两个模型去拟合数据,根据拟合好坏来决定选用哪一个加速模型。
所以,艾林模型也常常用于电子产品的加速贮存寿命试验。
Glasstene 、Laidler 、Eyring 在1941年提出一个加速模型,该模型被称为广义艾林模型,该模型适用于产品同时遭受温度应力与另一其他环境应力的情况,但需要假设温度应力与另一环境应力互不干涉。
导弹在贮存期内的运输、装卸和定期检测等环境情况下,弹上产品会同时遭受温度和其他应力,此时就可以使用广义艾林模型。
单应力艾林模型的形式如下:(4-2)为产品贮存寿命;为激活能;为温度应力(单位:开尔文); 为波耳兹曼常数;为常数。
广义艾林模型的模型形式如下:(4-3)为产品贮存寿命;为激活能;为温度应力(单位:开尔文);为除温度应力外的其他应力;为波耳兹曼常数;为常数。
不管是单应力艾林模型还是广义艾林模型,它们都与阿伦尼斯模型一样是基于激活能的模型,同样,它们主要用来描述电子产品中非机械(非材料疲劳)的、*aE kTL t CT eα=L t a E TkC α、*ai i i iE A B S kTT L t CT eα⎛⎫++ ⎪⎝⎭∑=L t a E Ti S kC α、取决于化学反应、腐蚀、物质扩散或迁移等过程的失效机理。
但是它们与阿伦尼斯模型的主要不同点反应在两个方面:1、阿伦尼斯模型是一个基于实验结果的经验公式,而艾林模型则是一个基于化学和量子力学的理论结果;2、阿伦尼斯模型只描述了失效与温度之间的关系,而艾林模型则认为失效与其他类型应力间的关系也可以在模型中通过类似的数学形式给出。
(3)逆幂率模型该模型描述了电压或压力等应力和产品寿命的关系,模型形式如下:(4-4) 为产品贮存寿命;为电压或压力应力;为常数。
逆幂率模型适用于电应力及机械应力等单一应力,在导弹贮存中,许多产品都要经历运输、装卸、定期检测。
这些任务阶段产品会遭受电应力或机械应力,此时可以考虑使用逆幂率模型。
建议在可能由电应力或机械应力引发的失效上使用该模型。
(4)Coffin-Manson 模型Coffin-Manson (CM )模型描述的是温度循环与产品寿命的关系,成功应用于焊料的裂纹生长失效机理上,模型形式如下:(4-5)为产品贮存寿命;为最高温度应力的阿伦尼斯激活能;为最高温度与最低温度之间的温差(单位:开尔文); 为循环频率(单位:赫兹)为常数。
CM 模型用于由热疲劳引起的材料疲劳、变形及裂缝等失效机理,建议使用于焊料及金属材料的器件。
()1nL V KV =()L V V K ()max f N Af T G T αβ--=∆f N ()max G T T∆f A αβ、、1.2.2 多应力模型(1)温度-湿度模型在实际的电子产品的贮存寿命问题中,影响非密封器件,即塑封器件贮存寿命的一个重要因素就是环境湿度,环境中得水分可以透过塑封材料造成芯片的腐蚀和失效。
但是单应力模型均无法给出环境湿度影响器件贮存寿命的具体表达形式。
➢ Peck 模型20世纪70年代,研究人员开始在阿伦尼斯模型的基础上通过引入湿度来构建新的寿命模型,Peck 模型是稳态条件下的温湿度模型。
Peck 汇总了众多稳态实验的结果,并以85℃/85%RH 的结果为基准进行了比较和分析,在1986年给出如下形式塑封器件的寿命表达式:(4-6)为产品贮存寿命; 为激活能;为温度应力(单位:开尔文);为相对湿度(单位:%RH )为波耳兹曼常数;为常数,为大于0的无单位常数。
Peck 模型适用于由温度、湿度两种应力引起的产品失效。
建议使用在失效由温度、湿度两种应力引发的非密封性电子或机电器件。
➢ Shirley 模型这一模型重点是在Peck 模型的基础上,考虑了器件在实际的工作过程中电源经常开启和关断对于空气中的水分进出塑封器件过程的非稳态影响。
模型形式如下:(4-7) 各参数含义详见《THB Reliability Models And Life Prediction For Intermittently-powered Non-hermetic Components 》*a E n kT L t C He -=L t a E T H k C n ()()()*{}exp()()m sat a a sat j iP T Q AF steady state a bV H P T kT --=+该模型适用于在定期检测或战备值班阶段经常需要电源开启和关断的非密封器件,且器件失效由温度与湿度两种应力共同作用引起。
(2)温度-电应力模型在导弹贮存期内要经历定期检测、战备值班等,部分器件需要同时遭遇温度与电应力两种应力。
如产品失效由这两种应力引起可选用温度-电应力模型。
由温度和电应力共同引起的失效机理主要有两种,一种是电迁移;一种是电介质击穿。
在电流流过金属线时,金属离子会在电流及其他因素的相互作用下移动并在金属层内形成孔隙或裂纹,这种失效机理被称为电迁移。
电介质击穿是指在电场作用下,电介质丧失绝缘能力的现象。
电场强弱对电介质击穿的影响很大,使用的失效物理模型也不一致。
➢电迁移模型电迁移是由于金属离子的扩散所引起的,这种扩散有三种基本的形式,即表面扩散、晶格扩散、晶界扩散。
不同的金属材料所涉及的扩散形式可能不同,例如,凸点中的扩散主要是晶格扩散;Al 互连线的扩散主要是晶界扩散;而Cu 互连线的扩散主要是表面扩散等。
影响电迁移的因素主要可以归纳为如下的三类:1、导致扩散的外力。
这些外力包括了由电子与金属离子动量交换和外电场产生的综合力、非平衡态离子浓度产生的扩散力、由纵向压力梯度产生的机械应力以及温度梯度产生的热应力。
这些应力的存在会导致金属的离子流密度不连续从而产生电迁移。
2、几何因素。
转角、台阶、接触孔的存在都会加大局部的应力梯度从而加速电迁移现象的发生。
此外,当线宽变得可以和晶粒大小相比拟甚至更小时,晶界扩散会减少且向晶格扩散和表面扩散转化。
3、金属材料本身。
通常合金可有效地抑制电迁移,正如前面所提到的那样,掺一点铜能大大提高铝金属层的寿命,加入少量硅也可提高可靠性,因为铜原子沿晶粒界面的吸收使可扩散的部位减少。
电迁移失效物理模型建立了元器件的电迁移与流过金属的电流密度以及金属的几何尺寸、材料性能和温度分布的关系。
流过金属的电流可以是直流或交流,交流条件下的电迁移研究是建立在直流物理模型基础上的,通常采用平均电流密度并对电迁移寿命作近似评估。
● 直流模型直流条件下的,电迁移失效物理模型如下式:(4-8) 为产品的平均故障前时间;为激活能;为温度; 为电流密度;为金属的几何尺寸参数; 为波耳兹曼常数;为常数,低电流情况下,高电流情况下。
电子、机电、光电设备发生失效,如失效原因是由于战备值班或定期检测时,直流电应力引起的电迁移失效机理,建议使用该模型。
● 交流模型在交流条件下,大致说来电迁移失效寿命比直流条件下都要长,对这一现象的物理解释为:在正半周期内产生的离子流扩散在负半周期内发生了部分回扩散,根据这一解释,在交流条件下的电迁移可以认为是一种平均电流密度的结果,交流情况下的电迁移失效物理模型如下式:,其中 (4-9) 为产品的平均故障前时间;为激活能;为温度; 为电流密度;为金属的几何尺寸参数; 为波耳兹曼常数;为常数,为通电时间。
a EmkT n wdT MTTF e Cj =MTTF a E Tj w d、k C m=n=1m=n=3a EmkT n wdT MTTF e Cj =01()j j t dt ττ=⎰MTTF a E Tj w d、k C τ电子、机电、光电设备发生失效,如失效原因是由于战备值班或定期检测时,交流电应力引起的电迁移失效机理,建议使用该模型。
➢ 介质击穿模型● E 模型E 模型是一种随时间退化的电介质击穿模型,建立在偶极子与电场作用基础上的,认为氧化层的退化与击穿实际上是电场作用的结果,由缺陷的产生和积累决定。
其方程形式如下:(4-10) 为产品贮存寿命;为激活能;为温度;为波耳兹曼常数;为电场加速因子;为常数。
电子、机电、光电设备发生失效,如失效原因是由于战备值班或定期检测时,电应力引起的介质击穿失效机理,建议使用该模型。
特别是在低电场范围内该模型更为适用。
● 1/E 模型1/E 模型是一种随时间退化的电介质击穿模型,是建立在电子隧穿注入基础上的,认为氧化层击穿是由空间电荷积累造成的,并认为击穿所需的总俘获空穴电荷量一定,其方程形式如下:(4-11) 为产品贮存寿命;为激活能;为温度;为波耳兹曼常数;1ln()ox Q TF E kT γ∝-TF 1Q T k ox E γ2ln()(1/)ox Q TF G E kT∝-TF 2Q T k为电场加速因子。
电子、机电、光电设备发生失效,如失效原因是由于战备值班或定期检测时,电应力引起的介质击穿失效机理,建议使用该模型。
特别是在高电场范围内该模型更为适用。
(3)温度-振动模型1991年Donald B. Barker 等人经过对印制电路板焊点的研究,提出了温度与振动应力共同加载时对产品寿命影响的加速模型,其公式描述如下:(4-12) 为产品贮存寿命;如果芯片载体使用无铅焊料,反之;为疲劳延性系数;为焊点高度; 为等价温度范围;为器件焊点间最大距离;为部件和衬底间TCE 绝对误差。