氧化还原反应基本规律和氧化性还原性强弱的比较方法课件
- 格式:ppt
- 大小:1.03 MB
- 文档页数:81


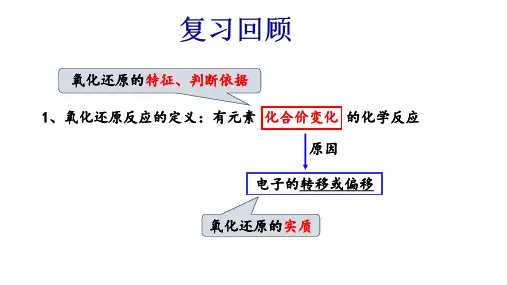
第20课时 物质的氧化性、还原性强弱比较及规律和应用知识归纳:一、氧化性、还原性强弱的认识1.氧化性是指物质 的性质(或能力);还原性是指物质 的性质(或能力)。
2.氧化性、还原性的强弱取决于物质得、失电子的 程度,与得、失电子数目的 无关。
例如:Na -e -===Na +,Al -3e -===Al 3+,但根据金属活动性顺序表,Na 比Al 活泼,更易失去电子,所以Na 比Al 的还原性强。
二、氧化性、还原性强弱的比较方法方法一 依据反应原理(还原性强) (氧化性强) (氧化性较弱) (还原性较弱)氧化性:氧化剂>氧化产物。
还原性:还原剂>还原产物。
可总结为:比什么性,找什么剂(物),产物之性小于剂。
方法二 依据金属活动性顺序方法三 依据元素周期表方法四 依据电化学原理(1)原电池:一般情况下,两种不同的金属构成原电池的两极,其还原性:负极>正极。
(2)电解池:用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
方法五 依据反应条件及反应的剧烈程度反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
例如:根据2Na +2H 2O===2NaOH +H 2↑,Mg +2H 2O=====△Mg(OH)2+H 2↑,可以推知还原性Na>Mg 。
方法六 依据氧化还原反应的程度(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
如(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
如物质的氧化性还原性还与以下因素有关:(1)浓度:同一种物质浓度越大,氧化性(或还原性)越强,如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3,还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强,如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。





氧化性,还原性强弱的判断方法(一)根据氧化还原反应的方向判断氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物氧化剂--得电子--化合价降低--被还原--发生还原反应--还原产物还原剂--失电子--化合价升高--被氧化--发生氧化反应--氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物氧化性:氧化剂>还原剂还原性:还原剂>氧化剂(二)根据元素活动性顺序比较(1)金属活动顺序:K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>P t>Au从左到右,金属还原性逐渐减弱,对应阳离子氧化性逐渐增强(2)非金属活动性顺序(常见元素):F---Cl---Br---I---S 从左到右,原子(或单质)氧化性逐渐减弱,对应阴离子还原性增强氧化性:F2>Cl2>Br2>Fe3+>I2>SO2>S还原性:S2->SO32->I->Fe2+>Br->Cl->OH->含氧酸根>F-(三)根据反应条件判断,当不同氧化剂分别于同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的难易来判断。
反应越容易,该氧化剂氧化性就强。
(四)根据氧化产物的价态高低来判断当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱。
(五)根据元素周期表判断(1)同主族元素(从上到下)非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强。
金属原子还原性逐渐增强,对应阳离子氧化性逐渐减弱(2)同周期主族元素(从左到右)单质还原性逐渐减弱,氧化性逐渐增强阳离子氧化性逐渐增强,阴离子还原性逐渐减弱。
(六)根据元素最高价氧化物的水化物酸碱性强弱比较酸性越强,对应元素氧化性越强碱性越强,对应元素还原性越强(七)根据原电池的电极反应判断两种不同的金属构成的原电池的两极。

氧化还原反应基本规律
氧化还原反应的基本规律有五大规律:
1.强弱律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
2.价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
3.转化律:同种元素不同价态间发生归中反应时,元素的氧化数值接近而不交叉,最多达到同种价态。
4.优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。
5.守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化-还原反应(oxidation-reduction reaction,也作redox reaction)是化学反应前后,元素的化合价有变化的一类反应。
氧化还原反应的特征是元素化合价的升降,实质是电子的得失或共用电子对的偏移。
氧化还原反应是化学反应中的三大基本反应之一(另外两个为(路易斯)酸碱反应与自由基反应。
自然界中的燃烧,呼吸作用,光合作用,生产生活中的化学电池,金属冶炼,火箭发射等等都与氧化还原反应息息相关。
研究氧化还原反应,对人类的进步具有极其重要的意义。
物理概念
在无机反应中,有元素化合价升降,即电子转移(得失或偏移)的化学反应是氧化还原反应。
在有机反应中,有机物引入氧或脱去氢的作用叫做氧化反应,引入氢或失去氧的作用叫做还原反应。
氧化与还原的反应是同时发生的,即是说氧化剂在使被氧化物质氧化时,自身也被还原。
而还原剂在使被还原物还原时,自身也被氧化。
氧化还原反应的特征是元素化合价的升降,实质是发生电子转移。