几种典型的晶格统计模型
- 格式:pdf
- 大小:1.51 MB
- 文档页数:20

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
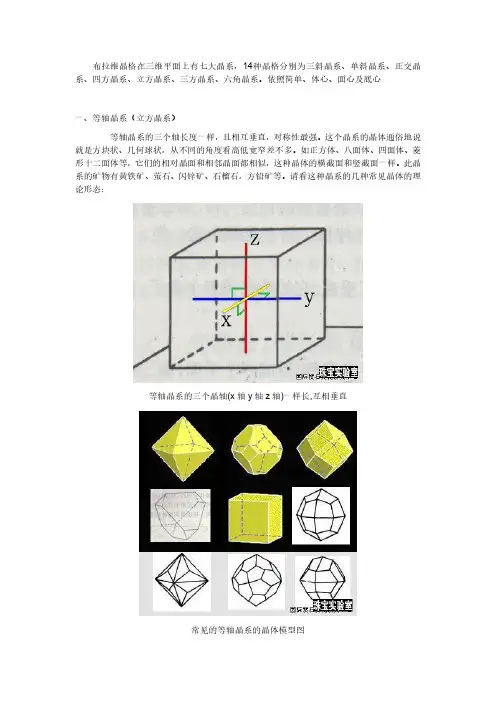
布拉维晶格在三维平面上有七大晶系,14种晶格分别为三斜晶系、单斜晶系、正交晶系、四方晶系、立方晶系、三方晶系、六角晶系。
依照简单、体心、面心及底心一、等轴晶系(立方晶系)等轴晶系的三个轴长度一样,且相互垂直,对称性最强。
这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。
如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。
此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。
请看这种晶系的几种常见晶体的理论形态:等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直常见的等轴晶系的晶体模型图等轴晶系的各种宝石金刚石晶体翠榴石黄铁矿萤石八面体和立方体的聚形的方铅矿二、四方晶系四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。
通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。
再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。
请看模型图:四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x、y)发育大于竖轴z轴,那么该晶体就是四方板状常见的一些四方晶系的晶体模型符山石的晶体锡石的长柱状晶体(顶端另有斜生的小晶体)。
请注意看柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面这是短柱状锆石,柱体几乎不发育。
象个四方双锥体或假八面体三、三方晶系和六方晶系三方晶系和六方晶系有许多相似之处,一些矿物专著和科普书刊往往将二者合并在一起,或干脆就称晶体有六大晶系。
与前面讲的五个晶系最大的不同是三方/六方晶系的晶轴有四根,即一根竖直轴(z轴)三根水平横轴(x、y、u轴)。
竖轴与三根横轴的交角皆为90度垂直,三根横轴间的夹角为120度(六方晶系为60度,也可说成三横轴前端交角120度。
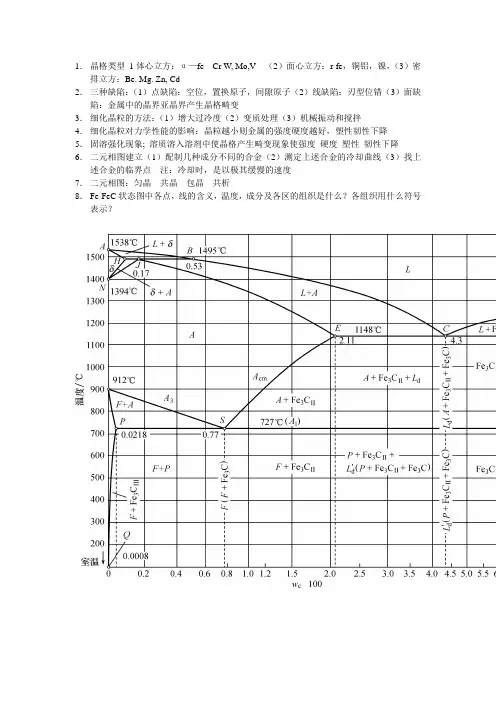
1.晶格类型1体心立方:α—fe Cr W, Mo,V (2)面心立方:r-fe,铜铝,镍,(3)密排立方:Be. Mg. Zn, Cd2.三种缺陷:(1)点缺陷:空位,置换原子,间隙原子(2)线缺陷:刃型位错(3)面缺陷:金属中的晶界亚晶界产生晶格畸变3.细化晶粒的方法:(1)增大过冷度(2)变质处理(3)机械振动和搅拌4.细化晶粒对力学性能的影响:晶粒越小则金属的强度硬度越好,塑性韧性下降5.固溶强化现象; 溶质溶入溶剂中使晶格产生畸变现象使强度硬度塑性韧性下降6.二元相图建立(1)配制几种成分不同的合金(2)测定上述合金的冷却曲线(3)找上述合金的临界点注:冷却时,是以极其缓慢的速度7.二元相图:匀晶共晶包晶共析8.Fe-FeC状态图中各点,线的含义,温度,成分及各区的组织是什么?各组织用什么符号表示?⇄⇄⇄⇄⇄LJNGAA+Fe3CF+Fe3CL+Fe3CL+A+ ALJ NG AA+Fe3CF +Fe3CL+Fe3C L+AF + AF9.。
碳钢中常含有哪四种杂质元素?哪些是有益元素哪些是有害元素?Mn Si S P Mn Si 有益P S 有害10.过冷奥氏体等温转变曲线包括哪三个转变区域?共析钢等温曲线的转变区温度范围是多少?各转变区在不同温度下的转变产物的名称和符号是什么?珠光体转变贝氏体转变马氏体转变11.退火,正火,淬火,低低温回火的目的是什么?获得的组织是什么?退火目的:(1)降低硬度,改善切削加工性(2)消除应力,稳定尺寸(3)细化晶粒,调整组织,消除缺陷,为后续热处理做好组织准备获得铁素体加珠光体冷却方式:空气中冷却正火:细化晶粒,提高其力学性能获得索氏体组织空气冷却淬火:为了获得马氏体,提高钢的强度,硬度和耐磨性油冷或水冷低温回火:降低淬火应力和脆性,多用于处理各种模具或表面淬火的工艺获得回火马氏体12.合金元素对C曲线位置有何影响?其他元素对C曲线位置的影响?1.含碳量的影响:对C曲线位置影响:在正常加热条件下,Wc<0.77%时,含碳量增加,C曲线右移;Wc>0.77%时,含碳量增加,C曲线左移。

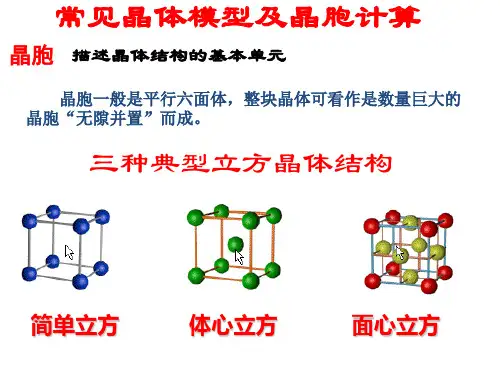
常见晶体模型及晶胞计算晶体是由晶体胞重复堆积而成的,晶体胞是晶体的最小构造单元。
晶体的结构可以用晶胞参数表示,晶胞参数包括晶格常数、晶胞的角度、晶胞的体积等。
根据晶体的晶胞参数,可以推导出晶胞的几何形状和晶体的晶体类别。
根据晶体的晶胞形状,晶体可以分为立方晶系、四方晶系、六方晶系、正交晶系、单斜晶系和三斜晶系。
每个晶系又可以进一步分为各种晶体类别,如立方晶系下又有体心立方晶体和面心立方晶体等。
晶体模型描述了晶体的结构和排列方式。
常见的晶体模型有球模型、格点模型和球与棍模型。
1.球模型:球模型是一种简化的晶体表示方法,将晶体中的原子用球体表示,球的大小和颜色常用来表示原子的种类和其它信息。
2.格点模型:格点模型是用晶体胞中的原子位置来表示晶体结构的一种方法,晶体胞中的每个原子位置称为格点。
在格点模型中,晶体中的每个原子都用一个点来表示,这样形成了一个点阵,点阵反映了原子的排列方式。
常见的格点模型有立方格点模型、面心立方格点模型和体心立方格点模型。
3.球与棍模型:球与棍模型是一种结合了球模型和格点模型的晶体表示方法。
在球与棍模型中,每个原子用一个球来表示,不同原子之间用直线连接表示键的形成。
在进行晶胞计算时,需要确定晶体的晶胞参数。
晶胞参数可以通过实验测量得到,也可以通过计算方法获得。
晶胞计算主要包括以下几个步骤:1.实验测量:通过实验手段,如X射线衍射、电子衍射等,测量晶体的晶胞参数。
2.计算方法:根据晶体的晶胞参数和晶体的晶格类型,可以使用计算方法来预测和计算晶体的晶胞参数。
常见的计算方法有密度泛函理论(DFT)和分子力场(MM)等。
3.晶胞优化:通过晶胞优化算法,寻找晶体的最稳定结构。
晶胞优化算法可以通过改变晶胞参数、原子位置或局部结构等来寻找最低能量的晶体结构。
4.校正和验证:使用计算得到的晶胞参数进行校正和验证,与实验结果进行比较,确保计算结果的准确性和可靠性。
总之,晶体模型和晶胞计算是研究和描述晶体结构的重要工具。


常见晶胞模型氯化钠晶体(1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个(2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个;占有的Cl-4个。
(3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个;与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞)(1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数)为8个CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
(3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。
CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。
(2)Zn2+的配位数为4个,S2-的配位数为 4个。
金刚石 金刚石晶胞 金刚石晶胞分位置注释(1)金刚石晶体a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实际为椅式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成正四面体。
键角109°28’b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。


布拉维晶格在三维平面上有七大晶系,14种晶格分别为三斜晶系、单斜晶系、正交晶系、四方晶系、立方晶系、三方晶系、六角晶系。
依照简单、体心、面心及底心一、等轴晶系(立方晶系)等轴晶系的三个轴长度一样,且相互垂直,对称性最强。
这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。
如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。
此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。
请看这种晶系的几种常见晶体的理论形态:等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直常见的等轴晶系的晶体模型图等轴晶系的各种宝石金刚石晶体翠榴石黄铁矿萤石八面体和立方体的聚形的方铅矿二、四方晶系四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。
通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。
再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。
请看模型图:四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x、y)发育大于竖轴z轴,那么该晶体就是四方板状常见的一些四方晶系的晶体模型符山石的晶体锡石的长柱状晶体(顶端另有斜生的小晶体)。
请注意看柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面这是短柱状锆石,柱体几乎不发育。
象个四方双锥体或假八面体三、三方晶系和六方晶系三方晶系和六方晶系有许多相似之处,一些矿物专著和科普书刊往往将二者合并在一起,或干脆就称晶体有六大晶系。
与前面讲的五个晶系最大的不同是三方/六方晶系的晶轴有四根,即一根竖直轴(z轴)三根水平横轴(x、y、u轴)。
竖轴与三根横轴的交角皆为90度垂直,三根横轴间的夹角为120度(六方晶系为60度,也可说成三横轴前端交角120度。

金属晶体的四种堆积模型总结Metal crystals can be classified into four main stacking models: Close-packed cubic (FCC), Close-packed hexagonal (HCP), Body-centered cubic (BCC), and Simple cubic (SC). These models represent different ways in which metal atoms arrange themselves in a crystal lattice. Close-packed cubic structures have atoms arranged in layers of repeating ABCABC... pattern, giving them high packing efficiency.金属晶体可以分为四种主要的堆积模型:密堆立方(FCC)、密堆六方(HCP)、体心立方(BCC)和简单立方(SC)。
这些模型代表了金属原子在晶格中排列的不同方式。
密堆立方结构中,原子按照重复ABCABC...模式排列在不同层中,使得具有较高的填充效率。
Close-packed hexagonal structures, on the other hand, consist of layers with an ABAB... stacking sequence. This type of arrangement gives rise to a compact structure with a hexagonal unit cell. Body-centered cubic structures have atoms arranged in a simple cubic lattice with an additional atom at the center of the cube. This arrangement provides good mechanical properties due to thepresence of the central atom, which enhances the strength of the crystal lattice.另一方面,密堆六方结构由具有ABAB...堆叠序列的层组成。

氯化钠晶体(1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个(2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个;占有的Cl-4个。
(3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个;与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞)(1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数)为8个CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
(3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。
CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。
(2)Zn2+的配位数为4个,S2-的配位数为 4个。
金刚石 金刚石晶胞 金刚石晶胞分位置注释(1)金刚石晶体a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实际为椅式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成正四面体。
键角109°28’b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
布拉维晶格在三维平面上有七大晶系,14种晶格分别为三斜晶系、单斜晶系、正交晶系、四方晶系、立方晶系、三方晶系、六角晶系。
依照简单、体心、面心及底心一、等轴晶系(立方晶系)等轴晶系的三个轴长度一样,且相互垂直,对称性最强。
这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。
如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。
此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。
请看这种晶系的几种常见晶体的理论形态:等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直常见的等轴晶系的晶体模型图等轴晶系的各种宝石金刚石晶体翠榴石黄铁矿萤石八面体和立方体的聚形的方铅矿二、四方晶系四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。
通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。
再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。
请看模型图:四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x、y)发育大于竖轴z轴,那么该晶体就是四方板状常见的一些四方晶系的晶体模型符山石的晶体锡石的长柱状晶体(顶端另有斜生的小晶体)。
请注意看柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面这是短柱状锆石,柱体几乎不发育。
象个四方双锥体或假八面体三、三方晶系和六方晶系三方晶系和六方晶系有许多相似之处,一些矿物专著和科普书刊往往将二者合并在一起,或干脆就称晶体有六大晶系。
与前面讲的五个晶系最大的不同是三方/六方晶系的晶轴有四根,即一根竖直轴(z轴)三根水平横轴(x、y、u轴)。
竖轴与三根横轴的交角皆为90度垂直,三根横轴间的夹角为120度(六方晶系为60度,也可说成三横轴前端交角120度。
学生版:典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻个碳以共价键结合,形成体结构(2)键角均为(3)最小碳环由个C组成且六个原子不在同一个平面内(4)每个C参与条C—C键的形成,C原子数与C—C键数之比为SiO2(1)每个Si与个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n(Si)∶n(O)=(3)最小环上有个原子,即个O,个Si分子晶体干冰(1)8个CO2分子构成立方体且在6个面心又各占据1个CO2分子(2)每个CO2分子周围等距紧邻的CO2分子有个冰每个水分子与相邻的个水分子,以相连接,含 1 mol H2O的冰中,最多可形成mol“氢键”。
NaCl(型)离子晶体(1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na +)有个。
每个Na+周围等距且紧邻的Na+有个(2)每个晶胞中含个Na+和个Cl-CsCl (型)(1)每个Cs+周围等距且紧邻的Cl-有个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-)有个(2)如图为个晶胞,每个晶胞中含个Cs +、个Cl-金属晶体简单六方堆积典型代表Po,配位数为,空间利用率52%面心立方最密堆积又称为A1型或铜型,典型代表,配位数为,空间利用率74%体心立方堆积又称为A2型或钾型,典型代表,配位数为,空间利用率68%六方最密堆积又称为A3型或镁型,典型代表,配位数为,空间利用率74%混合晶体石墨(1)石墨层状晶体中,层与层之间的作用是(2)平均每个正六边形拥有的碳原子个数是,C原子采取的杂化方式是(3)每层中存在σ键和π键,还有金属键(4)C—C的键长比金刚石的C—C键长,熔点比金刚石的(5)硬度不大、有滑腻感、能导电教师版典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻4个碳以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C组成且六个原子不在同一个平面内(4)每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2SiO2(1)每个Si与4个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n(Si)∶n(O)=1∶2(3)最小环上有12个原子,即6个O,6个Si分子晶体干冰(1)8个CO2分子构成立方体且在6个面心又各占据1个CO2分子(2)每个CO2分子周围等距紧邻的CO2分子有12个冰每个水分子与相邻的4个水分子,以氢键相连接,含1 mol H2O的冰中,最多可形成2 mol“氢键”。
二维晶格类型二维晶格指的是一个由平面上相同的二维单元重复排列而成的结构。
在二维晶格中,每个单元都具有相同的结构和形状,这种结构可以用一个二维点阵的形式来表示。
二维晶格的类型多种多样,本文将介绍一些常见的二维晶格类型。
1.正方形晶格正方形晶格是一种最简单的二维晶格类型,也是最易于理解的类型之一。
它的每个单元都是一个正方形,在平面上以正方形为基元进行重复排列,而构成的图案就是一个正方形点阵。
正方形晶格有非常好的对称性,每个单元的中心点与周围单元的中心点距离相等。
2.六方晶格六方晶格也称为蜂窝状晶格,它是由六边形单元结构组成的。
六方晶格的单元之间相邻的角度为120°,构成一个蜂窝状的结构,这种结构常见于石墨烯等材料的结构中。
六方晶格也具有很好的对称性,具有六重旋转对称性以及反演对称性。
3.矩形晶格矩形晶格是以矩形为基本单元的晶格,它的单元结构由两个相邻矩形组成。
矩形晶格可以看作是一个简单的两维六点式网格结构。
矩形晶格的对称性较弱,但它有方便的坐标系,可以方便地计算和描述复杂的结构。
4.三角晶格三角晶格又称为三角形晶格,这是由三角形单元组成的晶格。
三角晶格最常见的形态就是等边三角形晶格,它常常出现在石墨烯等材料的结构中。
三角晶格因其对称性而广泛应用于研究物理学中的各种现象。
5.布拉菲晶格布拉菲晶格是由平行于一个平面的线性结构组成的二维晶格,即不同方向的线性结构交汇形成的晶格。
这种晶格是由两个六方晶格和一个矩形晶格交错排列而成的。
由于它的复杂结构,它的对称性也比较复杂,因此处理布拉菲晶格的问题是非常具有挑战性的。
以上就是几种常见的二维晶格类型,每种晶格类型具有不同的结构和对称性特征,适用于不同的物理问题求解。
研究二维晶格结构的发展也为人们更好地理解物质的各种性质提供了便利。