大学化学期末试卷
- 格式:doc
- 大小:603.20 KB
- 文档页数:12


广东医科大学基础化学期末试卷1、萜类化合物在化学结构上的明显区别是()[单选题] *A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同2、具有酚羟基或羧基的游离蒽醌类成分有一定酸性,可用的提取方法是()[单选题]* A酸溶碱沉法B碱溶酸沉法(正确答案)C水提醇沉法D醇提水沉法3、下列化合物中具有强烈天蓝色荧光的是()[单选题] *A七叶内脂(正确答案)B大黄素C麻黄碱D大豆皂苷4、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素5、萃取时,混合物中各成分越易分离是因为()[单选题] *A分配系数一样B分配系数相差越大(正确答案)C分配系数越小D以上都不是6、黄酮母核具有的下列何种结构特点在碱液中不稳定()[单选题] * A邻二酚羟基(正确答案)B3-羟基C5-羟基D7-羟基7、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿8、属于二萜的化合物是()[单选题] *A龙脑B月桂烯C薄荷醇D穿心莲内酯(正确答案)9、很少含有挥发油的植物科为()[单选题] *A菊科B唇形科C茜草科(正确答案)D姜科10、碱水提取芦丁时,若PH过高会使()[单选题] * A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环11、中药补骨脂中的补骨脂内脂具有()[单选题] *A抗菌作用B光敏作用(正确答案)C解痉利胆作用D抗维生素样作用12、使游离香豆素呈现红色的是()[单选题] *A异羟肟酸铁反应(正确答案)BA-萘酚-浓硫酸反应C浓硫酸-没食子酸D浓硫酸-变色酸13、以葛根素为指标成分进行定性鉴别的中药是()[单选题] * A葛根(正确答案)B黄芩C槐花D陈皮14、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷15、不属于木脂素类化合物的物理性质的是()[单选题] *A一般没有挥发性B有光学活性C易溶于有机溶剂D有色晶体(正确答案)16、可与异羟肟酸铁反应生成紫红色的是()[单选题] *A羟基蒽醌类B查耳酮类C香豆素类(正确答案)D二氢黄酮类17、纸色谱是分配色谱中的一种,它是以滤纸为(),以纸上所含的水分为固定相的分配色谱。

吉林大学09—10学年第一学期普通化学A 试卷一、每小题只有一个选项符合题意,请将答案的代码填入题末的括号内。
(每小题1分, 共10分)1、干冰升华吸收能量以克服…………………………………..………… ( ) A 、 键能 B 、 取向力 C 、 色散力 D 、 诱导力2、金属表面因氧气分布不均匀而被腐蚀,称为差异充气腐蚀,此时金属溶解处是( )A 、在氧气浓度较大的部位;B 、在氧气浓度较小的部位;C 、在凡有氧气的部位;D 、以上均不正确。
3、下列各组量子数中不合理的是…………………………………………………. ( )A 、2,1,0,+21B 、2,2,0,+21C 、2,0,0, -21D 、1,0,0,+21 4、酸雨是指雨水的pH 小于……………………………………………………………( ) A 、6.5; B 、6.0; C 、5.6; D 、7.05、通常线性非晶态高聚物中,适宜作塑料且加工性能较好的是…………………...( ) A 、T g 值和T f 值均高; B 、T g 值和T f 值均低; C 、T g 值低,T f 值高; D 、T g 值高,T f 值低。
6、AgCl 在下列物质中溶解度最大的是……………………………………………….( )A 、纯水;B 、6 mol·kg –1 NH 3·H 2O ;C 、0.1 mol·kg –1NaCl 溶液;D 、0.1 mol·kg –1BaCl 2溶液。
7、下列物质中 不等于零的是:..………………………………………….( )A 、I 2(g );B 、C (石墨); C 、Fe (s );D 、Cl 2(g )8、稀土金属通常保存在………………………………………………………………( )A 、汽油中;B 、柴油中;C 、煤油中;D 、酒精中。
9、下列离子属于9 ~17电子构型的是……………………………………………….( )A 、Br - ;B 、Sc 3+; C 、Zn 2+; D 、Fe 2+10、下列分子中,偶极矩不为零的是…………………………………………………( )A 、NCl 3;B 、BF 3 ;C 、CCl 4 ;D 、CS 2二、每小题有一个或两个选项符合题意,请将答案的代码填入题末的括号内。

南京林业大学无机化学期末试卷1. 原子结合成分子的作用力是 [单选题] *分子间作用力化学键(正确答案)氢键范德华力2. 水的沸点反常高是因为 [单选题] *氢键(正确答案)共价键配位键离子键3. 下列各组量子数,不正确的是 [单选题] *A.n=2,l=1,m=0 ,ms=-1/2B.n=3,l=0,m=1 ,ms=1/2(正确答案)C.n=2,l=1,m=-1,ms=1/2D.n=3,l=2,m=-2,ms=-1/24. 下列哪个电子亚层可以容纳最多电子( )。
[单选题] *A.n=2,l=1B.n=3,l=2C.n=4,l=3(正确答案)D.n=5,l=05. 某多电子原子中四个电子的量子数表示如下,其中能量最高的电子是( )。
[单选题] *A.2,1,1,-1/2B.2,1,0,-1/2C.3,1,1,-1/2D.3,2,-2,-1/2(正确答案)6. 元素基态原子,在n=5的轨道中仅有2个电子,则该原子n=4 的轨道中含有电子( ) [单选题] *A.8个(正确答案)B.18个C.8~18个D.8~23个7. 下列原子中原子半径最大的是( ) [单选题] *A.NaB.AlC.ClD.K(正确答案)8. 下列各组元素中电负性相差最大的是( ) [单选题] *A.H和RnB.F和Cs(正确答案)C.H 和CsD.F和Rn9. 已知BeCl2是直线型分子,Be的杂化方式为: ( ) [单选题] *A. sp3B. sp2C. sp(正确答案)D. sp3d10. 在单质碘的四氯化碳溶液中,溶质和溶剂分子之间存在着( ) [单选题] *A. 取向力B. 诱导力C. 色散力(正确答案)D. 诱导力和色散力11. σ键和π键在分子中均可单独存在。
() [判断题] *对错(正确答案)12. 角量子数l=2的某一电子,其磁量子数m( ) [单选题] *A. 只有一个数值B. 可以是三个数值中的任一个C. 可以是五个数值中的任一个(正确答案)D. 可以有无限多少数值13. 下列分子采取sp3杂化方式成键的是( ) [单选题] *A. CO2B. BCl3C. BeCl2D. SiCl4(正确答案)14. 下列哪种分子的偶极矩等于零?( ) [单选题] *A. CCl4(正确答案)B. H2OC. NH3D. HCl15. 下列化合物中哪个氢键表现得最强?( ) [单选题] *A. NH3B. H2OC. H2SD. HF(正确答案)16. 硫磺洗剂属于 [单选题] *A.分子分散系B.离子分散系C.胶体分散系D.粗分散系(正确答案)17. 雾属于一种分散体系,其分散介质是 [单选题] *A. 液体B. 气体(正确答案)C. 固体D. 气体或固体18. 将4gNaOH固体溶于水配成50mL溶液,其物质的量浓度为 [单选题] *A.0.1mol/L B.0.5mol/L C.1mol/L D.2mol/L(正确答案)19. 将30mL 0.5mol/L NaCl溶液稀释到500mL,稀释后NaCl的物质量浓度为 [单选题] *A.0.03mol/L(正确答案)B.0.3mol/L C.0.05mol/L D. 0.04mol/L 20. 取100mL 0.3mol/L和300mL 0.25mol/L的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 [单选题] *A.0.21mol/L B.0.42mol/L(正确答案)C.0.56mol/L D.0.26mol/L21. 等渗溶液的渗透浓度为280~300mol/L [判断题] *对错(正确答案)22. 在稀溶液的凝固点降低公式中的b所代表的是溶液的 [单选题] *A.溶质的质量摩尔浓度(正确答案)B.溶质的摩尔分数C.溶剂的摩尔分数D.溶液的物质的量浓度23. 下列水溶液渗透压最大的是 [单选题] *A.0.1 mol/L C12H22O11 B.0.1 mol/LC2H5OHC.0.1 mol/L KClD.0.1 mol/LK2SO4(正确答案)24. 不挥发的溶质溶于水后会引起 [单选题] *A.沸点下降B.熔点升高C.蒸气压升高D.蒸气压下降(正确答案)25. 下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的 [单选题] *A.100mL 0.5mol/L MgCl2溶液B.200mL 0.25mol/L CaCl2溶液(正确答案)C.50ml 1mol/L NaCl溶液D.25ml 1mol/L HCl溶液26. 下列有关原子知识的归纳中你认为不正确的是? [单选题] *原子是构成物质的一种粒子原子在化学变化中可以再分(正确答案)同类原子的质子数一定相等原子里的质子数和中子数不一定相等27. 某元素原子的核外有3个电子层,最外层上有1个电子,这种元素是? [单选题] *非金属元素金属元素(正确答案)稀有气体元素无法确定28. “五月粽香飘万家”,能闻到粽香的原因是() [单选题] *A.分子是由原子构成的B.分子的质量和体积都很小C.分子在不停地运动(正确答案)D.分子间有间隔29. 化学上称“原子是化学变化中的最小粒子”的根据是() [单选题] *A.原子的质量很小B.原子是构成物质的最小粒子C.原子的体积极小D.原子在化学反应中不可再分(正确答案)30. 用“|”表示半透膜,膜两侧溶液及浓度分别表示如下,其中溶剂从左向右渗透的是() [单选题] *0.1mol/L CaCl2溶液 | 0.3mol/L 蔗糖溶液0.1mol/L NaCl溶液 | 0.1mol/L CaCl2溶液(正确答案)0.2mol/L NaHCO3溶液 | 0.1mol/L CaCl2溶液0.1mol/L 葡萄糖溶液 | 0.1mol/L 蔗糖溶液31. 使溶胶稳定的决定性因素是() [单选题] *布朗运动电泳现象胶粒带电(正确答案)丁达尔现象32. 下列电解质对As2S3溶胶(负溶胶)的聚沉能力由强到弱的顺序是() [单选题] *NaCl>CaCl2>AlCl3CaCl2>AlCl3>NaClAlCl3>CaCl2>NaCl(正确答案)AlCl3>NaCl>CaCl233. 使Fe(OH)3溶胶聚沉,下列电解质聚沉能力最大的是() [单选题] * K2SO4Na3PO4(正确答案)AlCl3MgCl234. 关于活化能下裂说法正确的是() [单选题] *活化能越大,反应速率越大活化能是活化分子具有的能量一般来说,活化能越小,反应速率越大(正确答案)正反应的活化能与你反应的活化能通常相等35. 一些药物放在冰箱中贮存以防变质,其主要作用是() [单选题] *避免与空气接触保持干燥避免光照降温减少反应速率(正确答案)36. 关于速率常数k,叙述正确的是() [单选题] *与浓度无关(正确答案)与温度无关与催化剂无关反应条件不变,值可变37. 丁达尔现象是光射到胶粒上所产生的()现象引起的 [单选题] *透射反射散射(正确答案)折射38. 土壤中NaCl含量高时植物难以生存,这与下列稀溶液的哪个性质有关()[单选题] *凝固点下降渗透压(正确答案)沸点升高蒸气压下降39. 用AgNO3溶液与过量KI溶液制备AgI溶胶时,胶核吸附的离子是() [单选题] *K+I-(正确答案)Ag+NO3-40. 当红细胞置于溶液中时,水分子由细胞膜向细胞内渗透,红细胞逐渐膨胀,膨胀至一定程度后破裂,释出血红蛋白,发生溶血现象。
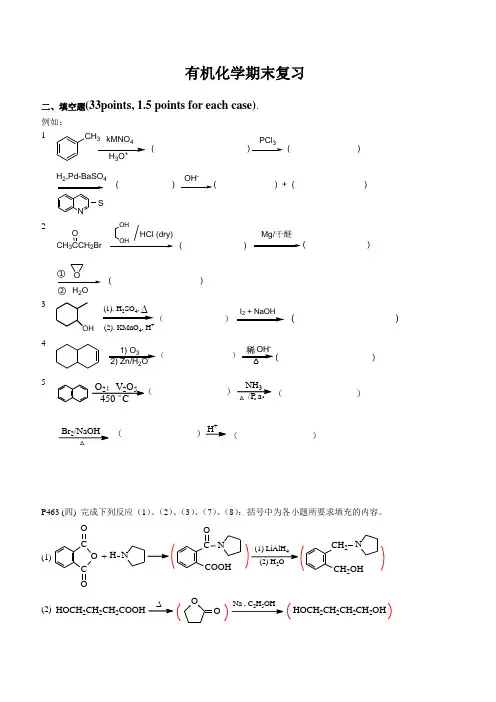
有机化学期末复习二、填空题(33points, 1.5 points for each case). 例如: 1CH 3kMNO43+( )PCl 3( )H 2,Pd-BaSO 4NS( )OH -2CH 3CCH 2BrMg/干醚HCl (dry)OH OHO H 2OO( )( )( )①②3OH(1). H SO ,∆(2). KMnO 4, H+))(41) O 32) Zn/H 2O- )5NH 3/P a Br 2/NaOHH +△△..O 2;V 2O 5 C 。
450( ( )( )( )P463 (四) 完成下列反应(1)、(2)、(3)、(7)、(8):括号中为各小题所要求填充的内容。
(1)C O CO ONH +COOHCON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH 2CH 2OH(3)CH 2=C COOHCH 3323CH 2=CCOClCH 3CH 2=C COOCH 2CF 3CH 3(7)C NH CO O22COOHNH 2(8)COOHCHOCOClH , Pd-BaSO 3P509,15.15 写出下列季铵碱受热分解时,生成的主要烯烃结构。
P522,15.23 完成下列反应式。
P527,(八) 写出下列反应的最终产物:(1) CH 2ClNaCNLiAlH 4(CH 3CO)2O(CH 2CH 2NHCOCH3)(2)NO Fe, HCl22NO (CH 3)2N )(3)CH 3(CH 2)2CH=CH HBr ROORCN Na CO OH 2O, HO -( CH 3(CH 2)2CH 2CH 2NH 2 )(4)O322N(CH 3)2O)P616,20.2 写出下列反应式中(A )~ (H)的构造式。
三、选择题(反应快慢,鉴别试剂,物质的稳定性,能否发生某种反应等) 例如:P404,11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。

湖北中医药大学无机化学期末试卷1、能溶于水的生物碱是()[单选题] *A莨菪碱B小檗碱(正确答案)C长春新碱D长春碱2、很少含有挥发油的植物科为()[单选题] *A菊科B唇形科C茜草科(正确答案)D姜科3、萃取法是利用混合物中各成分在两相溶剂中的分配.系数不同而到达分离的方法,所谓两相溶剂是指()[单选题] *A两种相互接触而又不相溶的溶剂(正确答案)B两种不相互接触而又互相溶的溶剂C两种不相互接触而又不相容的溶剂D两种互相接触而又互相溶的溶剂4、以黄芩苷、黄芩素、汉黄芩素为指标成分进行定性鉴别的中药是()[单选题] * A葛根B黄芩(正确答案)C槐花D陈皮5、下列化合物中,酸性最强的是()[单选题] *A芦荟大黄素B大黄酚C大黄素甲醚D大黄酸(正确答案)6、下列化合物可用水蒸汽蒸馏法提取的是()[单选题] *A七叶内酯(正确答案)B七叶苷C厚朴酚D五味子素7、下列关于香豆素的说法,不正确的是()[单选题] *A游离香豆素多具有芳香气味B分子量小的香豆素有挥发性和升华性C香豆素苷多无香味D香豆素苷多无挥发性,但有升华性(正确答案)8、在分配色谱中,属于反相色谱的是()[单选题] *A固定相的极性大于流动相B固定相的极性小于流动相(正确答案)C固定相的极性等于流动相D以上都不是9、具有光化学毒性的中药化学成分类型是()[单选题] * A多糖B无机酸C鞣质D呋喃香豆素(正确答案)10、下列生物碱碱性最强的是()[单选题] *APkA=22BPkA=5(正确答案)CPkA=13DPkA=5811、由两个C6-C3单体聚合而成的化合物称()[单选题] * A木质素B香豆素(正确答案)C黄酮D木脂素12、溶剂极性由小到大的是()[单选题] *A石油醚、乙醚、乙酸乙酯(正确答案)B石油醚、丙酮、乙酸乙酯C石油醚、乙酸乙酯、三氯甲烷D三氯甲烷、乙酸乙酯、乙醚13、挥发油的溶解性难溶于()[单选题] *A水(正确答案)B乙醇C石油醚D乙醚14、可与异羟肟酸铁反应生成紫红色的是()[单选题] *A羟基蒽醌类B查耳酮类C香豆素类(正确答案)D二氢黄酮类15、在脱铅处理中,一般通入的气体为()[单选题] *A氯化氢B二氧化硫C硫化氢(正确答案)D二氧化碳16、香豆素衍生物最常见的羟基取代位置是()[单选题] *AC7位(正确答案)BC5位CC3位DC6位17、所有游离香豆素均可溶于热的氢氧化钠水溶液,是由于其结构中存在()[单选题]* A酮基B亚甲二氧基C内酯环(正确答案)D酚羟基对18、薄层吸附色谱中的Rf的大小说明了吸附程度的大小,吸附力越大,则Rf()[单选题] *A越大B越小(正确答案)C越接近1D越接近019、苯丙素类的基本母核是具有一个或数个()单元的天然化合物()[单选题] *AC6-C3基团(正确答案)BC6-C6基团CC5-C3基团DC8-C8基团20、E易酶解苷类成分关于亲水性有机溶剂,说法正确的有()*A极性大(正确答案)B极性小C水不相溶D与水部分相溶21、下列应用最广的经典提取方法是()[单选题] *A水蒸气蒸馏法B溶剂提取法(正确答案)C超临界流体萃取法D超声提取法22、挥发油常见属于哪类萜类化学物()[单选题] *A半萜与单萜B单贴与倍半萜(正确答案)C倍半萜与二萜D二萜与三萜23、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿24、下面化合物能与异羟肟酸铁反应的是()[单选题] *A花椒内酯(正确答案)B柠檬烯C色原酮D天精25、连续回流提取法与回流提取法比较,其优越性是()[单选题] * A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大26、用有机溶剂加热提取中药成分时,宜采用(多选)()*A浸渍法B渗漉法C煎煮法D回流提取法(正确答案)27、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草28、水蛭的主要化学成分是()[单选题] *A有机酸B蛋白质(正确答案)C多糖D生物碱29、下列溶剂中亲脂性最强的是()[单选题] * A甲醇B苯(正确答案)C三氯甲烷D丙酮30、下列不能作为极性吸附剂的是()[单选题] * A活性炭(正确答案)B氧化铝C硅胶D氧化镁。
、、
、下列卤代烃与AgNO
、2-甲基氯丁烷
、3-甲基-1-丁烯
、下列物质能发生碘仿反应的是(
、乙酸B、乙醇
7、下列化合物中沸点最高的是(
、CH3CH CH3
、CH3CH OCH2CH3
8、下列各组物质中互为同分异构体的是(
七、推断结构式。
(15分)
1、化合物A分子式为C6H12O,不与托伦试剂或饱和亚硫酸氢钠反应,但能与羟胺反应,A经催化氢化得分子式C6H14O的B。
B与浓硫酸共热得分子式C6H12的C。
C经臭氧氧化再还原水解,生成分子式均为C3H6O的D和E。
D能发生碘仿反应,但不能发生银镜反应;E能发生银镜反应,但不能发生碘仿反应。
试写出A、B、C、D、E的构造式。
(不必写反应式)(9分)
2、某化合物A的分子式为C8H14O,A可迅速使溴水褪色,也能与苯肼反应生成黄色沉淀,但不能发生银镜反应。
A经酸性高锰酸钾氧化生成丙酮及另一化合物B。
B具有酸性,与NaOI反应生成碘仿和丁二酸。
试写出A、B可能的构造式。
(不必写反应式)(6分)试卷︵B ︶
第4页︵共4页︶
河南科技大学教务处。
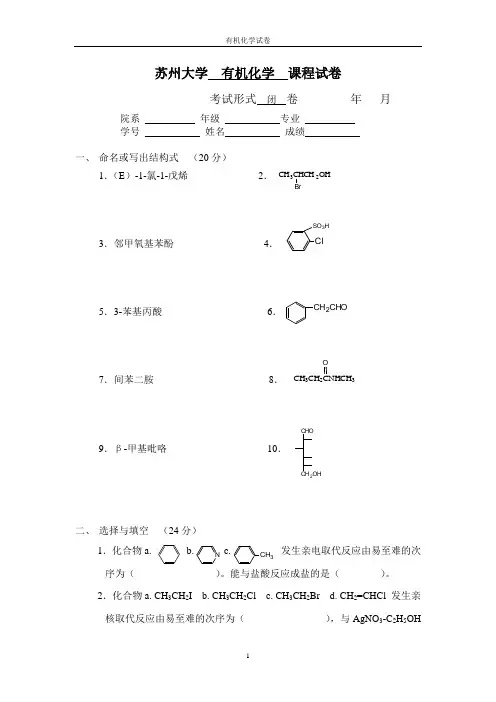
苏州大学 有机化学 课程试卷考试形式 闭 卷 年 月院系 年级 专业 学号 姓名 成绩一、 命名或写出结构式 (20分)1.(E )-1-氯-1-戊烯 2.3.邻甲氧基苯酚 4.5.3-苯基丙酸 6.7.间苯二胺 8.9.β-甲基吡咯 10.二、 选择与填空 (24分)1.化合物a. b. c. 发生亲电取代反应由易至难的次序为( )。
能与盐酸反应成盐的是( )。
2.化合物a. CH 3CH 2I b. CH 3CH 2Cl c. CH 3CH 2Br d. CH 2=CHCl 发生亲核取代反应由易至难的次序为( ),与AgNO 3-C 2H 5OHClSO 3HCH 3CHCH 2OHBrCH 3CH 2CNHCH 3OCHOCH 2OH N CH 3CH 2CHO溶液反应能生成黄色沉淀的为( )。
3.化合物a. CH 3CH 2COOH b. c. 酸性由强至弱的次序为( )。
加热后产物能使溴水褪色的是( )。
4.化合物a. (CH 3)4N +OH -b. c. (CH 3)2CHCONH 2 碱性由强至弱的次序为( ),与溴水反应产生白色沉淀的是( )。
5.a.b.c.( )仅含一个手性碳原子,构型为( )(用R/S 标记),( )为内消旋体。
6.a. b. c. a 表示( )的优势构象,b 表示( )优势构象(透视式),c 表示( )优势构象(纽曼投影式)。
7.a . b. c. ( )没有变旋现象,( )能被溴水氧化,( )与( )和过量苯肼反应生成相同的糖脎 。
8.a. CH 3-S-CH 3 b. c. d. CH 3-S-S-CH 3e. ( )表示油脂,( )属于硫醚,( )属于膦酸酯。
三、 完成下列反应(20分) 1. 2.3.COOH H OH COOHH OH 3或SOCl 2HBr CH 2=CHCH 2CH32CH 3CHClCOOC 2H 5CH 3CH 2COOH NH 2CH 3CHCOOHOHCH 2CH 2COOH OHCOOH H Cl COOHH OH COOHH H COOHH OH H3CH 3HHCH 3H HCH 2OHC O CH 2OHCHOCH 2OHCH 2OH CH 2OH(CH 3)2P O OHCH2CHCH 2R 1COO R 2COO R 3COO (CH 3)2P OOCH 34.5. 6.7.四、 用化学方法区别、分离、合成(16分)1. 区别苯 环己二烯 1-己炔2. 区别甲醛 乙醛 丙酮3. 区别苯胺 丙氨酸 N-甲基苯胺4.分离苯甲酸、苯甲醇的混合物5. 用CH 3CH 2CH 2Br 合成CH 3CH 2CH 2COOHO4HCNCH 3CHCH 2CH 3OHKOHN H浓NaOH+HCHO NN Cl -+。

扬州⼤学普通化学期末考试试卷扬州⼤学普通化学期末考试试卷第⼀卷选择题1.下列量⼦数组合(s m m l n ,,,)中;哪⼀组是合理的? (A)3;2;2;1(B)21,1,0,3-(C)21,2,2,2(D)21,0,1,22.某元素+3价离⼦的电⼦排布式为63][d Ar ;该元素在元素周期表中位于 (A)s 区(B)p 区(C)d 区(D)ds 区3.氢原⼦的4s 径向分布函数图有 (A)4个峰 (B)2个峰 (C)3个峰 (D)1个峰 4.⽔的反常沸点主要原因是(A)离⼦键(B)共价键(C)配位键(D)氢键5.下列物质中;中⼼原⼦以不等性3sp 杂化⽅式成键的是 (A)2CS(B)3BF(C)4SiH(D)2OF6.等性3sp 杂化可以⽤来描述下列哪个分⼦中共价键的形成? (A)O H 2(B)4CCl(C)3NH(D)3NCl7.在下列微粒中;哪个不具有孤电⼦对? (A)O H 2(B)3NH(C)+4NH(D)S H 28.将0.103-?dm mol 的KI 和0.153-?dm mol 的3AgNO 溶液等体积混合制成溶胶;使其聚沉能⼒最强的电解质是(A)NaCl (B)4MgSO (C)3AlCl (D)])([63CN Fe K9.现有两种溶液;⼀为1.5g 尿素[22)(NH CO ]溶于200g O H 2中;另⼀为42.75g 未知物(⾮电解质)溶于1000g O H 2中。
这两种溶液在同⼀温度结冰;则未知物的摩尔质量为{已知M [22)(NH CO ]=60.051-?mol g } (A)3001-?mol g(B)3421-?mol g(C)2801-?mol g(D)4001-?mol g10.胶体溶液中胶粒带电的主要原因是 (A)电离作⽤(B)选择性吸附作⽤(C)⽔合离⼦现象(D)溶剂化膜作⽤11.下列参数中;哪个不属于状态函数? (A)温度T(B)压强P(C)热Q(D)焓H12.已知反应)(21)()(2222g O l O H l O H +=的198-O-=mol kJ H mr 反应)()(22g O H l O H =的10.44-O=mol kJ H mr 则反应)()(2)(22222g O g O H l O H +=的为Omr H (A) -54 1-?mol kJ (B) -1081-?mol kJ (C) -1421-?mol kJ (D)1421-?mol kJ13.在恒温条件下;若化学平衡发⽣移动;则其平衡常数 (A)不变(B)减⼩(C)增⼤(D)难以判断14.反应)()(21)()(22g CO g N g CO g NO +=+的10.373-O-=mol kJ H mr ;若要提⾼ )(g NO 和)(g CO 的转化率;可采取的⽅法是(A)⾼温低压 (B)⾼温⾼压 (C)低温⾼压 (D)低温低压15.已知某反应的速率常数为1min 35.0-=k ;则此反应是 (A)零级反应(B)⼀级反应(C)⼆级反应(D)三级反应16.⼀个复杂反应的速度是(A)由最慢的⼀步基元反应决定 (B)由最快的⼀步基元反应决定 (C)各步基元反应速度之和(D)⽆法确定的扬州⼤学普通化学期末考试试卷1.29号铜元素的原⼦核外电⼦的排布式为 1s 22s 22p 63s 23p 63d 104s 1__ 。

无机化学(下)期末考试试卷化学、材料化学、临床医学姓名: 班别:学号:一、选择题: 请把正确答案的字母填在各小题前的( )内。
(15分) ( B ) 1. 键能大小正确的顺序是A. B-B > C-C > Si-SiB. C-C > B-B > Si-SiC. Si-Si > B-B > C-CD. C-C > Si-Si > B-B( D ) 2. 下列各组元素中,性质最相似的两种元素是A. Co和NiB. Mg和AlC. B和SiD. Mo和W( C ) 3. 用氢氧化钠熔融法分解矿石时最合适用的容器是A. 铂坩埚B. 石英坩埚C. 镍坩埚D. 铁坩埚( D ) 4. 过量氨水加于Hg2Cl2,生成A. Hg(OH)2B. Hg(NH3) 2+C. Hg(NH3) 42+D. HgNH2Cl + Hg( A ) 5. 可以用于治疗癌症的含铂药物是A. cis-PtCl2(NH3)2B. PtCl4C. H2PtCl6D. trans-PtCl2(NH3)2( D ) 6. 下列各组元素中,都可以形成多酸的是A. V,Ag,ZnB. Fe,Co,NiC. B,N,PD. Mo,Si,P( A ) 7. 可用PdCl2溶液检测的气体是A. COB. CO2C. O3D. Cl2( B ) 8. 下列化学方程式正确的是A. SiO2(s) + 2Cl2(g) = SiCl4(l) + O2(g)B. 2H2S(aq) + SnCl4(aq) = SnS2(s) + 4HCl(g)C. 2H2S(aq) + PbCl4(aq) = PbS2(s) + 4HCl(g)D. Cu2+(aq) + 4I-(aq) = [CuI4]2-(aq)( C ) 9. 既可溶于NaOH,又可溶于氨水的是A. Ni(OH)2B. Fe(OH)3C. Zn(OH)2D. Al(OH)3( A ) 10. 某金属离子在八面体弱场中的磁矩为4.9 B.M.,而在八面体强场中的磁矩为0 B.M.,该金属离子可能是A. Co3+B. Mn2+C. Cr3+D. Fe3+( C ) 11. 下列各对配合物稳定性顺序不正确的是A. [Fe(CN)6]3- > [Fe(H2O)6]3+B. [Fe(CN)6]4- < [Fe(CN)6]3-C. [HgCl4]2- > [HgI4]2-D. [Al(OH)4]- < [Zn(OH)4]2-( C ) 12. 下列配合物中,不满足“有效原子序规则”的是A. Fe(CO)5B. Mn2(CO)10C. V(CO)5D. Fe(C5H5)2( B ) 13. 以Fe2O3(s)为原料制备高铁酸盐应选择的试剂是A. NaClO + 稀H2SO4B. KNO3+ KOHC. H2O2 + 稀H2SO4D. 浓H2SO4 + Cl2(g) ( D ) 14. 下列配离子中, 分裂能∆O最大的是A. [Fe(CN)6]4-B. [Fe(H2O)6]2+C. [Ru (CN)6]4-D. [Os(CN)6]4-( A ) 15. 63 Eu 3+ 离子是许多发光材料中的激活离子,其基态价电子构型是A. 4f 6B. 4f 56s 1C. 4f 55d 1D. 4f 45d 16s 1二、填空题 (15分)1. TlCl 3(s) 在313 K 分解,相应的化学方程是 TlCl 3(s) = TlCl(s) + Cl 2(g) ,化学式为TlI 3(s)的化合物存在,其中Tl 元素的氧化数是 +1 ;上述现象说明 Tl (III )的强氧化性,是由6s 2惰性电子对效应引起 。
一 . 命名以下各化合物或写出结构式(每题 1 分,共 10 分)1.(H3C)2HCC(CH 3)3C CH H2.3-乙基-6-溴-2-己烯-1-醇3.O 4.5.CH 3 CHO邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必需时,指出立体结构),达成以下各反响式。
(每空 2 分,共 48 分)1.CH CHBrKCN/EtOHCH2Cl2.高温 、高压①O3+ C12② H 2O Zn 粉3.HBrMgCH = CH 2醚CH 3COC14.+CO 2CH 35.1, B 2H 62, H 2O 2, OH -1, Hg(OAc) 2 ,H 2 O-THF 2, NaBH 46.OOOOO7.CH 2ClNaOH H 2OCl8.CH 3+ H 2O OH-SN1 历程Cl+9.OCH 3 O C 2 H 5 ONa+ CH 2=CH C 2 H 5 ONaC CH 3O10.① CH 3COCH 3② H 2O H +BrBrZnEtOH11.OH+C CH 3 + Cl 212.CH 3HNO 3Fe,HCl(CH 3CO) 2O( 2)H 2SO 4Br 2NaOHNaNO 2 H 3 PO 2H 2SO 4三 . 选择题。
(每题 2 分,共 14 分)1. 与 NaOH 水溶液的反响活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3 )3CH 2Br (D). CH 3(CH 2)2CH 2BrCH 32. 对 CH 3Br 进行亲核代替时,以下离子亲核性最强的是: ( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 以下化合物中酸性最强的是()(A) CH 3CCH(B) H 2O(C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E)CHOH(F) p-CH C H OH6 53 6 44. 以下化合物拥有旋光活性得是:()COOHA,HOHCH 3B, HCOOHOHCH 3C,(2R, 3S, 4S)-2,4- 二氯 -3- 戊醇5. 以下化合物不发生碘仿反响的是 ( ) A 、 C 65 3、2 5H COCH3B CHOHC 、 CH 3 22D 、 32 3CHCOCHCH CHCOCHCH6. 与 HNO 2作用没有 2 生成的是()A 、H 22NB3 2 NCONH、CHCH ( NH )COOHC 、C 6 53D6 52H NHCH、CHNH7. 能与托伦试剂反响产生银镜的是 ( )A 、 CCl 3COOHB、 3C 、 CH CHCOOHClCOOHD、 HCOOH2四 . 鉴识以下化合物(共 6 分)苯胺、苄胺、苄醇和苄溴五 . 从指定的原料合成以下化合物。
大学期末考试试卷(有机化学)第二学期考试科目:有机化学考试类型:(闭卷)考试考试时间:120 分钟学号姓名年级专业一、填空题(本大题共15小题,每空1分,共15分)1、巴豆醛CH3CH=CHCHO的系统名称为()。
2、C CCBrCl2CH2CH3HC的系统名称为()。
3、SO3HOHO2N的系统名称为()。
4、香茅醇存在于香茅、香叶天竺葵的挥发油中,其结构式为CH2OH,该化合物的系统名称为()。
5、烟酸N COOH的系统名称为()。
6、苦味酸是一种烈性炸药,其结构式为()。
7、(2S,3S)-2,3-二羟基丁二酸(酒石酸)的Fischer投影式为()。
8、顺-1-甲基-4-叔丁基环己烷的最稳定椅式构象为()。
9、DOP是PVC塑料薄膜中常用的增塑剂,其系统名称为邻苯二甲酸二(2-乙基己酯),其化学结构式为()。
10、N,4-二甲基苯甲酰胺的化学结构式为()。
11、在苯环结构中只存在()杂化。
12、2-甲基-2-溴丁烷在NaOH-乙醇溶液中主要发生()(填“取代”或“消除”)反应。
13、能将伯、仲、叔胺鉴别开的试剂是()。
14、有手性碳就有旋光异构体,但不一定有旋光性,比如()就没有旋光性。
15、通过成脎可以鉴别不同的糖,所用的化学试剂为()(填结构式或系统名称)。
二、选择题(将正确的答案填在下列表格中)(15小题,每小题2分,共30分)1、下列化合物中,同种分子间能形成氢键的是()。
A. 1-丙醇B. 丙醛C. 丙酮D. 丙醚2、下列化合物具有芳香性的是()。
A. +B. C.-D.O3. 下列化合物中,最容易发生亲电取代反应是()。
A.甲苯B.苯酚C. 吡啶D.硝基苯4. 在高温条件下,甲苯与氯气所发生的主要反应是( )。
A. 自由基取代B. 亲核取代C. 亲电取代D. 亲电加成 5. 下列化合物中酸性最强的是( )。
A.OHCH 3Cl B.OHClClC OHClNO 2D.OHCH 3NO 2.6. 下列化合物与亚硫酸氢钠反应活性最小的是_________。
成绩北京化工大学《无机化学》期末考试模拟试卷班级___________ 姓名___________ 学号___________总分:(请考生注意:本试卷共 7 页)大题一二三四五六成绩一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×。
不必写在答题纸上。
)(本大题分10小题, 每小题2分, 共20分)()1、N原子是一个很活泼的原子,但常温下N2的化学性质不很活泼,其原因之一是N - N 键的键能较大。
()2、含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。
()3、碱土金属氢氧化物溶解度大小的次序为:Be (OH)2 < Mg (OH)2 < Ca (OH)2 < Sr (OH)2 < Ba (OH)2。
()4、配合物H2 [ PtCl6 ] 应命名为六氯合铂(Ⅳ) 酸。
()5、已知E(Sn2+/Sn)=−0.136V,则反应(Pb2+/Pb)=−0.126V,EPb2++Sn Pb+Sn2+必定自左向右进行。
()6、高氯酸溶液与金属锌反应时,产物之一是生成氢气。
()7、O3是反磁性的极性分子。
()8、每个NaCl 晶胞中含有4个Na+和4个Cl-。
()9、将Co2O3溶在盐酸中,可生成CoCl2。
()10、在单电子原子或离子中,核外电子的能级只与主量子数n有关,n 越大,能级越高。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内。
不必写在答题纸上。
)(本大题分20小题, 每小题1.5分, 共30分)( )1、一混合理想气体,其压力、体积、温度和物质的量分别用p、V、T、n表示,如果用i表示某一组分的气体,则下列表达式中错误的是。
(A)pV=nRT;(B)p i V=n i RT;(C)pV i=n i RT;(D)p i V i=n i RT。
()2、在某温度条件下,反应NH4Cl (s) NH3 (g) + HCl (g) 的标准平衡常数K= 0.150,在此温度时,将放入一真空容器中,则平衡后混合气体总压是。
一. 命名下列各化合物或写出结构式(每题1分,共10分)1.C H C(CH3)3(H3C)2HCH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1.CH CH2ClCHBrKCN/EtOH2.3.4.+CO2CH35.46.OOOO7.CH2ClCl8.3+H2O-SN1历程+ 9.C2H5ONaOCH3O+ CH2=CH C CH3O10.+C12高温高压、CH = C H2HBrMgCH3COC1BrBrZn EtOH11.C O CH 3+Cl 2H +12.Fe,HClH 2SO 43CH 3(CH 3CO)2OBr2NaOH24NaNO H PO (2)三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F)p-CH 3C 6H 4OH4. 下列化合物具有旋光活性得是:( )A,CH 3CH 3B,C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( ) A 、 C 6H 5COCH 3 B 、C 2H 5OH C 、 CH 3CH 2COCH 2CH 3 D 、CH 3COCH 2CH 36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOH B、CH3COOHC、 CH2ClCOOH D、HCOOH四. 鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五. 从指定的原料合成下列化合物。
扬州大学普化试题册 第 1 页 揚州大學普通化学上学期期末考试模拟试卷(最新版)
第一卷 选择题
1.下列量子数组合(smmln,,,)中,哪一组是合理的? (A)3,2,2,1 (B)21,1,0,3 (C)21,2,2,2 (D)21,0,1,2 2.某元素+3价离子的电子排布式为63][dAr,该元素在元素周期表中位于 (A)s区 (B)p区 (C)d区 (D)ds区 3.氢原子的4s径向分布函数图有 (A)4个峰 (B)2个峰 (C)3个峰 (D)1个峰 4.水的反常沸点主要原因是 (A)离子键 (B)共价键 (C)配位键 (D)氢键
5.下列物质中,中心原子以不等性3sp杂化方式成键的是 (A)2CS (B)3BF (C)4SiH (D)2OF 6.等性3sp杂化可以用来描述下列哪个分子中共价键的形成? (A)OH2 (B)4CCl (C)3NH (D)3NCl 7.在下列微粒中,哪个不具有孤电子对? (A)OH2 (B)3NH (C)4NH (D)SH2
8.将0.103dmmol的KI和0.153dmmol的3AgNO溶液等体积混合制成溶胶, 使其聚沉能力最强的电解质是 扬州大学普化试题册 第 2 页 (A)NaCl (B)4MgSO (C)3AlCl (D)])([63CNFeK
9.现有两种溶液,一为1.5g尿素[22)(NHCO]溶于200gOH2中,另一为42.75g 未知物(非电解质)溶于1000gOH2中。这两种溶液在同一温度结冰,则未知物 的摩尔质量为{已知M[22)(NHCO]=60.051molg} (A)3001molg (B)3421molg (C)2801molg (D)4001molg 10.胶体溶液中胶粒带电的主要原因是 (A)电离作用 (B)选择性吸附作用 (C)水合离子现象 (D)溶剂化膜作用 11.下列参数中,哪个不属于状态函数? (A)温度T (B)压强P (C)热Q (D)焓H 12.已知反应)(21)()(2222gOlOHlOH的198molkJHmr 反应)()(22gOHlOH的10.44molkJHmr 则反应)()(2)(22222gOgOHlOH的为mrH (A) -54 1molkJ (B) -1081molkJ (C) -1421molkJ (D)1421molkJ 13.在恒温条件下,若化学平衡发生移动,则其平衡常数 (A)不变 (B)减小 (C)增大 (D)难以判断 14.反应)()(21)()(22gCOgNgCOgNO的10.373molkJHmr,若要提高 )(gNO和)(gCO的转化率,可采取的方法是 (A)高温低压 (B)高温高压 (C)低温高压 (D)低温低压 15.已知某反应的速率常数为1min35.0k,则此反应是 (A)零级反应 (B)一级反应 (C)二级反应 (D)三级反应 16.一个复杂反应的速度是 扬州大学普化试题册 第 3 页 (A)由最慢的一步基元反应决定 (B)由最快的一步基元反应决定
大学化学期末试卷加答案学院________ 姓名_________ 学号_________闭卷考试时间:120分钟一、选择题(每小题1.5分,共24分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、NaBrC、CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、s区B、d区C、f区D、p区7、质量作用定律只适用于()A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应8、对于反应Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是( )。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。
A、1B、2C、3D、012、等温等压下且不做非体积功条件下,反应自发进行的判据是A、ΔHΘ<0B、ΔSΘ<0C、ΔG<0D、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在()。
A、色散力B、诱导力C、取向力D、氢键14、欲配制pH=5.0的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?()A、HF (pKa=3.45)B、CH3COOH (pKa=4.75)C、NH3·H2O (pKb=4.75)D、HCN(pKa=9.31)15、对于下列基元反应:A + 2B = C,其速率常数为k,若某个时刻(时间以s计),A的浓度为2mol/L,B的浓度为3mol/L,则反应速率v=()。
A、6k mol·L-1 ·s-1B、12k mol·L-1 ·s-1C、18k mol·L-1 ·s-1D、36k mol·L-1 ·s-116、在温度T的标准状态下,若已知反应A→2B的标准摩尔反应焓△r HΘm,1,与反应2A→C的标准摩尔反应焓△r H Θ,则反应C→4B的标准摩尔反应焓△r HΘm,3与△r HΘm,1及△r HΘm,2的关系为△rHΘm,3=()。
m,2A、2△r HΘm,1+△r HΘm,2B、△r HΘm,1-2△r HΘm,2C、△r HΘm,1+△r HΘm,2D、2△r HΘm,1-△r HΘm,2二、填空题(21分)1、原电池(-)Pt |Fe2+(C1),Fe3+(C2)|| Fe2+(C3),Fe3+(C4)| Pt(+)负极上发生的电极反应式:____________________;正极上发生的电极:________________________。
该电池属于____________电池。
1、根据热力学第一定律,封闭体系的热力学能变化值反应的ΔU=____________。
2、决定电子运动状态的四个量子数中,__________反映了原子轨道的形状;_______反映了原子轨道的空间取向;对于自旋量子数ms,可以取的数值只能为__________________。
3、在等温等压条件下,某反应的KΘ=1,则其ΔrG mΘ的值等于_______________。
4、同离子效应能使弱电解质的解离度______________。
如HAc溶液中加入_________________或_________________(两类物质)均能起到同离子效应的作用。
5、在等温下,若化学平衡发生移动,其平衡常数___________(填减小、增大、不变)。
6、原子轨道沿两核连线以“头碰头”方式重叠形成的共价键叫_______键,以“肩并肩”方式重叠形成的共价键叫_______键。
7、根据杂化轨道理论,BF3分子中B采取_______杂化,BF3的空间构型为____________;NH3分子中N采取_________杂化, NH3的空间构型为____________。
8、已知PbI2的溶度积Ks=8.49×10-9,则PbI2在0.010 mol/dm3Pb(NO3)2溶液中的溶解度为_________ mol/dm3。
9、已知MnO4-+8H++5e-=Mn2++4H2O,φ(MnO4-/Mn2+)=1.51V。
试根据能斯特公式确定φ(MnO4-/Mn2+)与pH的关系式是_________________________________。
10、CCl4分子与H2O分子间的相互作用力有___________________________。
三、问答题(每题6分,共计18分)1、写出7N原子、25Mn原子、20Ca2+的核外电子排布式?N:7Mn:25Ca2+202、影响化学反应速率的主要因素有哪些?质量作用定律的意义是什么?对一般的化学反应,速率方程式的反应级数能否直接根据化学反应方程式来写?为什么?3、当铜锌原电池(-)Zn |Zn2+(1mol/L) || Cu2+(1mol/L)| Cu(+)工作一段时间后,原电池的电动势是否发生变化?为什么?四、是非题(每题1分,共计7分)1、1、反应的ΔH就是反应的热效应。
()2、2、催化剂能改变反应历程,降低反应的活化能,但不能改变反应的ΔrG mΘ。
()3、3、两种分子酸HX溶液和HY溶液有同样的pH,则这两种酸的浓度相同。
()4、4、多电子原子轨道的能级只与主量子数n有关。
()5、5、电极电势的数值与电极反应的写法无关,而平衡常数的数值随反应式的写法而变。
()6、对于某一化学反应,若升高温度,其正反应速率v增加,逆反应速率v减小。
()7、在微观粒子中,只有电子具有波粒二象性。
()五、计算题(共30分)1(6分)计算下列反应的(1)ΔrHmΘ(298.15K);(2) 298.15K进行1mol反应时的体积功w` 和(3)ΔrUmΘ(298.15K)。
R=8.314J•mol-1•K-1CH4(g) + 4 Cl2(g) = CCl4(l) + 4 HCl(g)ΔfHmΘ(298.15K)/kJ•mol-1 -74.81 0 -135.44 -92.3072、(6分)某温度时,8.0molSO2和4.0molO2在密闭容器中进行反应生成SO3气体,测得起始时和平衡时(温度不变)系统的总压力分别为300kPa和220kPa。
试利用上述实验数据求该温度时2SO2(g) + O2(g) = 2SO3(g)的标准平衡常数和SO3的转化率。
3、(9分)已知,0.799Ag e Ag Vϕ+Θ+==,如果在溶液中加入NaCl,使产生AgCl沉淀后,溶液中的[Cl–]=1mol/L,试计算其电极电位。
4、(9分)向含有KCl、KI各0.01mol·l-1的混合溶液中,逐滴加入沉淀剂AgNO3溶液,那种离子先沉淀?氯离子沉淀时溶液中碘离子的浓度是多少?已知:Ks(AgI)=8.51×10-17 ,Ks(AgCl)=1.77×10-10《大学化学基础》试卷2(答案)一、选择题(每小题1.5分,共24分)1 2 3 4 5 6 7 8C B CD C D B B9 10 11 12 13 14 15 16A C C C DBC D二、填空题(21分)1. Fe2+–e = Fe 3+、Fe 3++e = Fe2+、浓差电池2.ΔU = q+w_3. 角量子数,磁量子数,±1/24. 0 kJ/mol5. 降低,醋酸盐,强酸6. 不变7. σ键,π键8. sp2,平面三角形;不等性sp3,三角锥形9. 9.2×10-4mol/L。
10. φ(MnO4-/Mn2+)=φ(MnO4-/Mn2+)–(0.05917/5)lg[C Mn2+/(C 8H+• C MnO4-)]11.色散力、诱导力三、问答题(每题6分,共计18分)1、7N:1s22s22p3Mn:1s22s22p63s23p63d54s225Ca2+:1s22s22p63s23p6202、影响化学反应速率的主要因素有:浓度、温度、压力和催化剂。
质量作用定律的意义:对于元反应,化学反应速率与反应物的浓度(以反应方程式中反应物的化学计量系数为指数)的乘积成正比。
反应级数指反应速率方程中各反应物浓度的指数之和。
对于元反应,反应速率方程等于反应物浓度(以方程式中其系数为指数)的乘积,因此其反应级数为方程式中反应物的系数之和。
对于复杂反应,反应速率方程并不一定等于反应物浓度(以方程式中其系数为指数)的乘积,,所以反应级数不能直接根据反应方程式来写。
3、原电池的电动势会发生变化。
铜锌原电池工作一段时间后,电解质溶液中的铜离子浓度降低,锌离子浓度增大,根据能斯特公式可知,随着铜离子浓度降低,锌离子浓度增大,原电池电动势变小。
四、是非题(每题1分,共计7分)1.(×)2.(√)3.(×)4.(×)5.(√)6.(×)7.(×)五、计算题(共30分)1、(6分)ΔrH mΘ= 4×(-92.307)+(-135.44)-(-74.81)=-429.86 kJ/molw体=– p·△V= –△nRT = –(-1)×8.314×298.15= 2.48kJ/molΔrU mΘ=ΔrH mΘ+ w体=-429.86kJ/mol +2.48kJ/mol=-427.38 kJ/mol2、(6分)2SO2(g) + O2(g) = 2SO3(g)=300kPa起始量(mol) 8.0 4.0 P总压P SO 2=300kPa×8/(8+4) =200 kPa P O 2=300kPa×4/(8+4) =100 kPa 平衡分压(Pa) 200–2x 100–x 2x P 总压=220kPa200–2x +100–x+2x = 220 x=80kPaSO 2(g)的转化率=2×80/200=80%101.6101sp spK K Ag Cl +--⎡⎤===⨯⎣⎦⎡⎤⎣⎦3、(9分) 解:根据电极电位的能斯特公式100.0591lg1.6100.7990.5780.2211V ϕϕΘ-=+⨯=-=上面计算得到的电极电位实际上是下电对的标准电极电位。