胺的化学性质
- 格式:ppt
- 大小:968.50 KB
- 文档页数:17

有机化学基础知识点整理胺与胺类化合物的化学性质与反应胺是指含有氨基(-NH2)的有机化合物,是有机化学中重要的功能团。
胺类化合物根据氨基的位置和数量可以分为三类:一级胺、二级胺和三级胺。
本文将整理胺与胺类化合物的化学性质与反应,包括它们的物理性质、酸碱性质、氧化还原性和其它重要反应。
1. 胺类化合物的物理性质胺类化合物通常呈无色至黄色液体或固体,具有刺激性气味。
一级胺和二级胺能形成氢键,使它们的沸点和溶解度高于相应的烃。
2. 胺类化合物的酸碱性质胺类化合物可看作是替代了一个或多个氢原子的氨分子。
它们可以接受质子而表现出碱性,通常可以与酸反应生成相应的胺盐。
3. 胺类化合物的氧化还原性胺类化合物在氧化剂存在下能够发生氧化反应。
一级胺可被氧化为相应的亚硝基化合物(亚硝胺)和亚硝酰化合物。
二级胺可以被强氧化剂氧化为相应的亚硝胺。
4. 胺类化合物的重要反应4.1 胺的烷基化反应胺可以与烷基卤化物(例如溴烷)反应,生成N-烷基胺。
反应一般在碱的存在下进行。
4.2 胺的酰化反应胺与酸酐反应,生成相应的胺酯。
该反应是通过胺的氮原子与酸酐的羰基发生亲电加成而进行。
4.3 Hofmann 消解反应一级胺与次氯酸盐(或次氯酸)反应,生成相应的氨。
这个反应通常用于检验胺的存在或从胺类化合物中有选择地制备氨。
4.4 Gabriel 合成一级胺与次氯酸钠和碳酸钾反应,生成相应的无机胺盐。
该盐再与酰卤反应,生成相应的一级胺。
4.5 Diazotization 反应胺与亚硝基酸反应生成相应的亚硝基胺,这是一种重要的反应,也常用于有机合成中。
除了上述的反应,胺类化合物还可以进行亲电取代反应、亲核取代反应、加成反应等等。
综上所述,胺与胺类化合物是有机化学中重要的功能团,具有丰富的化学性质和反应。
了解胺的性质和反应有助于理解有机化学的基础知识,并为有机合成提供重要的反应途径。


胺的化学性质(1)碱性 胺和氨相似,分子中氮原子上具有未共用的电子对,能接受一个质子形成铵离子,故胺具有碱性,能与大多数酸作用成盐。
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
胺的碱性强弱,可用Kb 或pKb 表示:如果胺的K b 值愈大或pK b 愈小,则此胺的碱性愈强。
胺的碱性强度往往可用它的共轭酸RNH 3+的强度来表示。
胺的碱越强,它的共轭酸越弱,Ka 越小,pKa 越大。
碱性: 脂肪胺 > 氨 > 芳香胺脂肪胺:在气态时和在溶液中所显示的酸碱性不同。
在气态时碱性为: (CH 3)3N > (CH 3)2NH > CH 3NH 2 > NH 3 在水溶液中碱性为: (CH 3)2NH > CH 3NH 2 > (CH 3)3N > NH 3 气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大,碱性越强。
在水溶液中,是电子效应与溶剂化共同影响的结果。
从伯胺到仲胺,增加了一个甲基,由于电子效应,使碱性增加。
但三甲胺的碱性反而比甲胺弱,这是因为一种胺在水中的碱度不仅要看取代基的电子效应,还要看它接受质子后形成正离子的溶剂化程度。
氮原子上连有氢越多(体积也越小),它与水通过氢键溶剂化的可能性就越大,胺的碱性越强。
在伯胺到叔胺之间,溶剂化效应占主导地位,使叔胺碱性比甲胺还弱。
(2)酸性 伯胺和仲胺的氮原子上还有氢,能失去一个质子而显酸性。
若碱金属的烷基氨基化合物,其烷基是叔烷基或仲烷基,如N,N-二异丙氨基锂,氮原子的空间位阻大,它只能与质子作用但不能发生其他的亲核反应,这种能夺取活泼氢而又不起亲核反应的强碱性试剂,称为不亲核碱。
这种试剂在有机合成上特别有用。
R NH 2+ HCl R NH 3ClR NH 2+ HOSO 3HR NH 3 OSO 3HR NH 3Cl + NaOHRNH 2 + Cl + H 2OR NH 2+ H 2O R NH 3 + OHK b =R NH 3 OHRNH 2pK b = lgK b(3)烷基化 和氨一样,胺与卤代烷、醇、硫酸酯、芳磺酸酯等试剂反应,氨基上的氢被烷基取代,这种反应称胺的烷基化反应。

胺的化学性质与应用胺是一类重要的有机化合物,由于其特殊的化学性质和广泛的应用领域,对其进行深入了解和研究具有很高的实际意义。
本文将介绍胺的化学性质以及在不同领域的应用。
一、胺的化学性质胺是由氨基基团(NH2)取代烃基而来,根据氨基基团的取代位置和数量,胺可以分为原胺、仲胺和叔胺。
胺具有以下几个重要的化学性质:1. 亲核性由于氨基基团的氮原子可以提供孤对电子,胺具有很强的亲核性。
它可以与电子不足的化合物发生亲核取代反应,如与酰氯反应生成胺的酰胺。
2. 碱性氨基基团的氮原子带有孤对电子,在水溶液中可以接受质子,表现出碱性。
胺可以与强酸反应生成盐,如与盐酸反应生成胺盐。
3. 缔合性胺具有良好的配位能力,可以与过渡金属形成络合物。
胺的缔合性使其在催化剂和染料等领域得到广泛应用。
二、胺的应用1. 药物合成胺在药物合成中扮演着重要的角色。
许多药物中都含有胺的结构基团,胺的亲核性和碱性使其成为合成活性药物的重要原料。
例如,抗生素、抗癌药物和神经递质等都含有胺基团。
2. 去除污染物胺可用于环境保护领域,如氨基甲酸盐可作为二氧化碳的吸收剂用于煤电厂的烟气脱硫处理。
另外,胺也可用于废水处理,通过与废水中的有机物发生化学反应,将有机污染物转化为无毒的化合物。
3. 表面活性剂由于胺具有亲油基团和亲水氨基基团,因此它可以用于表面活性剂的制备。
胺的表面活性剂应用广泛,例如用于润湿剂、去垢剂和柔软剂等。
4. 高分子材料胺也广泛应用于高分子材料的合成中。
通过与环氧树脂等反应,可以得到具有良好性能的聚胺树脂。
聚胺树脂在涂料、粘合剂和复合材料中具有重要的应用价值。
5. 植物生长调节剂某些胺类化合物具有植物生长调节剂的特性,可以促进植物的生长和发育。
例如,氮代胺类生长调节剂可以增加作物的光合作用效率,提高光合产物的积累。
结论总的来说,胺是一类具有特殊化学性质和广泛应用的有机化合物。
它的亲核性、碱性和缔合性使其在许多领域发挥着重要作用,如药物合成、环境保护、高分子材料以及植物生长调节剂等。

引言概述:胺是一类常见的有机化合物,具有重要的化学性质。
本文将从胺的结构、性质以及应用等方面进行详细探讨,希望能为读者提供全面的了解。
正文内容:一、胺的结构1.胺的一般结构特点2.长链胺和短链胺的结构区别3.脂肪胺与芳香胺的结构差异二、胺的物理性质1.胺的气味特征及相关反应2.胺的溶解性和蒸汽压3.胺的密度和沸点随碳链长度的变化三、胺的化学性质1.胺的碱性及其与酸的反应2.胺的酸性及其与碱的反应3.胺的氧化性反应4.胺的亲电性反应5.胺的求电子性反应四、胺的应用1.胺作为重要溶剂的应用2.胺作为表面活性剂的应用3.胺作为螯合剂的应用4.胺作为催化剂的应用5.胺作为医药及农药中的应用五、胺的特殊性质1.胺的亲核取代反应2.胺的氢键作用3.胺的配位性质4.胺的键能及其影响因素5.胺的空间构型和活性总结:胺作为一类重要的有机化合物,具有丰富的化学性质。
本文从胺的结构、物理性质、化学性质及其应用等方面进行了详细的阐述。
通过对胺的研究,我们可以更深入地了解胺在化学领域的作用以及其在其他领域的应用前景。
希望本文对读者对胺的化学性质有所帮助。
引言概述:胺是一类具有氨基基团(NH2)的有机化合物,它们是氨分子上一个或多个氢原子被有机基取代而形成的化合物。
胺分子的化学性质包括它们的酸碱性、氧化性、还原性以及它们在化学反应中的活性。
正文内容:一、胺的酸碱性1.胺是碱性物质,氨分子能够接受质子形成胺的盐酸盐。
2.胺可以与酸反应胺盐,这是因为氨基团上的孤对电子能够与酸中的质子形成离子键。
二、胺的氧化性1.一些胺具有氧化性,可以被氧化剂氧化成氧化胺。
2.例如,苯胺可以被过氧化氢氧化成苯酚。
三、胺的还原性1.胺具有还原性,它们可以将其他物质还原成较低的氧化态。
2.例如,亚硝胺可以还原成胺,同时氮氧键被还原成氮氢键。
四、胺的化学反应活性1.胺具有亲电性,可以发生亲电取代反应。
2.胺与酰氯、醛和酮等电子不足的化合物反应,酰胺、亚胺和烯胺等化合物。

胺的化学性质及制备Ⅰ、胺的化学性质C N H(R)N H(R)主要化性:1、胺的N 有孤对电子,具有一定的碱性;2、胺具碱性,亦具亲核性,可与卤代烃、酰化剂发生烃基化、酰基化反应(叔胺不可);3、各级胺可与HNO 2发生特殊反应;4、芳胺中存在共轭,N 的给电子作用使芳胺的碱性↓,而苯环上的亲电取代反应活性↑;5、芳胺易氧化。
一、碱性NH 3 +HOH[NH 4]+ + OH -..RNH 2 +HCl3]+ Cl -..1、注:(1)胺是弱碱,不能使酚酞显色;芳胺由于N 上孤对电子参与了共轭,碱性更弱;(2)成盐可改善其水溶性,也可用于提纯胺。
例如:+NH 2COOCH 2CH 2N(C 2H 5)2 HClNH 2COOCH 2CH 2N(C 2H 5)2H Cl普鲁卡因盐酸普鲁卡因(局麻剂)例如:乙酰苯胺中常混有未反应完的苯胺,如何提纯?解:乙酰苯胺HCl苯胺不溶溶解分离固体洗涤、干燥2、碱性影响因素(1)电子效应:N 上ρe ↑,碱性↑; (2)空间效应:N 周围位阻↑,碱性↓;(3)溶剂化效应:N +的溶剂化程度↑,碱性↑。
溶剂化效应:溶剂分子与离子相互作用而累积在离子周围,提高了离子的稳定性。
氨的盐通过氢键可与四个水分子溶剂化,伯胺盐可与三个水分子溶剂化,仲胺盐可与两个水分子溶剂化,叔胺盐可与一个水分子溶剂化,因此,在水溶液中,溶剂化程度顺序是:NH 3>伯胺>仲胺>叔胺+R 2NH H ............O HHOHH+R 3NH ......OH H(4)综合上述因素,在水溶液中,胺的碱性大小顺序为:季铵碱>脂肪胺>氨>芳胺①脂肪胺碱性与R 数目无正比关系,一般的:脂环仲胺>脂肪仲胺>脂肪伯胺、叔胺(掌握:二甲胺>甲胺>三甲胺)②芳胺碱性规律:芳伯胺>芳仲胺>芳叔胺;取代芳胺碱性与取代基性质有关。
(5)综合前一章节中的酰胺、酰亚胺,则水溶液中碱性强弱顺序为:季铵碱>脂胺>氨>芳胺>酰胺>酰亚胺(脂环仲胺>脂肪仲胺>脂肪伯胺、叔胺; 芳伯胺>芳仲胺>芳叔胺)二、亲核反应 (一)碳酰化1、N 上ρe ↑,体积↓,酰化活性↑;叔胺不能发生酰化反应;2、芳胺因共轭活性差,只能与酰卤和酸酐发生酰化反应得到酰化芳胺,产物应用价值是: (1)酰化苯胺使N 对苯环亲电反应致活性降低、且指导后续亲电取代主要进入对位,水解又可复原出氨基;(2)苯胺易氧化,但酰化后进行氧化可不受影响,之后可复原为氨基,故常用于在反应中保护氨基。

.含氮有机化合物第十三章它们在生物体中起着重要的含氮有机化合物是指含有碳氮键的有机化合物,作用。
第一节胺一、胺的分类和命名个氢或几个氢原子被烃基取胺是氨的烃基衍生物,它可看作是氨分子中的1代后的产物。
(一)胺的分类.根据胺分子中氮原子上所连烃基的数目不同,可分为伯胺、仲胺和叔胺。
1′R″R N R′—NH—R RR—NH2叔胺伯胺肿胺2.根据胺分子中氮原子上所连的烃基种类不同,可分为脂肪胺和芳香胺。
—NHR—NH Ar22芳香胺脂肪胺氮原子与脂肪烃基直接相连为脂肪胺,与芳环直接相连为芳香胺。
.根据胺分子中氨基的数目不同,可分为一元胺、二元胺和多元胺。
3—CHNH—NCH一元胺:CH——NH 二元胺:H—CH2232222例如:芳香胺脂肪胺NHNHCH2伯胺:23甲胺苯胺NHCHCHCH仲胺:NH332甲乙胺二苯胺CH3CH2CHNCHCHCH叔胺:N3322甲乙丙胺三苯胺1 / 22.请注意:伯胺、仲胺、叔胺与伯醇、仲醇、叔醇的区别,胺是根据氮原子上而醇则是根据羟基所连的烃基来分为伯所连烃基数目来分为伯胺、仲胺、叔胺,醇、仲醇、叔醇。
例如:CHCH33CHCHOHCNHC332CHCH33叔醇伯胺(二)胺的命名1.简单的胺以胺为母体,按烃基的名称称为某胺。
例如:NHCHNHCHCHCHNH2322322甲胺丙胺苯胺.仲胺和叔胺的氮原子上连的烃基相同时,用二或三标明烃基的数目,写2在烃基名称前;烃基不同时,从简单到复杂依次写出烃基的名称。
例如:)HN)CHNH (CHCH)N (C (32353632三苯胺二甲胺三乙胺CH3CH2CHNCHNHCHCHCHCHCH3223332甲乙胺甲乙丙胺.芳香仲胺和叔胺的氮原子上连有烃基时,以芳香胺为母体,在烃基前标3上“N-”,以区别连接在芳环上的烃基。
例如:CH3N)CHN(NHCH233CHCH32N-甲基-N-乙基苯胺二甲基苯胺,N-N甲基苯胺N-4.多元胺可参照多元醇命名,二元胺称为某二胺。

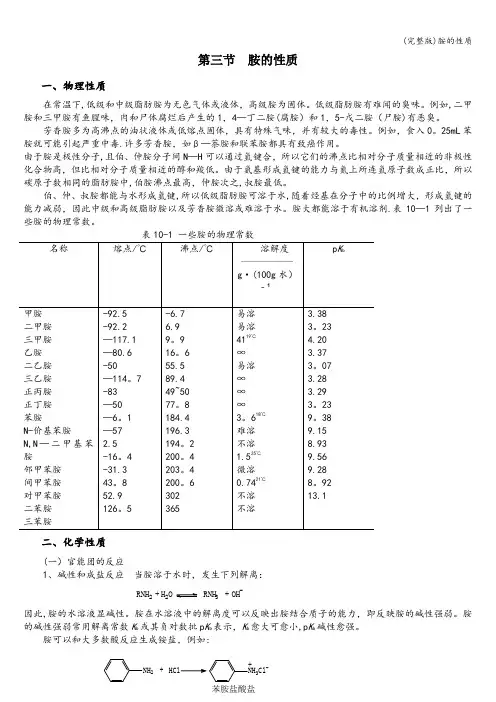
第三节 胺的性质一、物理性质在常温下,低级和中级脂肪胺为无色气体或液体,高级胺为固体。
低级脂肪胺有难闻的臭味。
例如,二甲胺和三甲胺有鱼腥味,肉和尸体腐烂后产生的1,4—丁二胺(腐胺)和1,5-戊二胺(尸胺)有恶臭。
芳香胺多为高沸点的油状液体或低熔点固体,具有特殊气味,并有较大的毒性。
例如,食入0。
25mL 苯胺就可能引起严重中毒.许多芳香胺,如β—萘胺和联苯胺都具有致癌作用。
由于胺是极性分子,且伯、仲胺分子间N —H 可以通过氢键合,所以它们的沸点比相对分子质量相近的非极性化合物高,但比相对分子质量相近的醇和羧低。
由于氨基形成氢键的能力与氮上所连氢原子数成正比,所以碳原子数相同的脂肪胺中,伯胺沸点最高,仲胺次之,叔胺最低。
伯、仲、叔胺都能与水形成氢键,所以低级脂肪胺可溶于水,随着烃基在分子中的比例增大,形成氢键的能力减弱,因此中级和高级脂肪胺以及芳香胺微溶或难溶于水。
胺大都能溶于有机溶剂.表10—1列出了一些胺的物理常数。
名称 熔点/℃ 沸点/℃ 溶解度g ·(100g 水)‐¹p K b甲胺 二甲胺 三甲胺 乙胺 二乙胺 三乙胺 正丙胺 正丁胺 苯胺N-价基苯胺N,N —二甲基苯胺邻甲苯胺 间甲苯胺 对甲苯胺 二苯胺 三苯胺-92.5 -92.2 —117.1 —80.6 -50—114。
7 -83 —50 —6。
1 —57 2.5 -16。
4 -31.3 43。
8 52.9 126。
5 -6.7 6.9 9。
9 16。
6 55.5 89.4 49~50 77。
8 184.4 196.3 194。
2 200。
4 203。
4 200。
6 302 365 易溶 易溶 4119℃ ∞ 易溶 ∞ ∞ ∞3。
618℃难溶 不溶1.525℃ 微溶0.7421℃不溶 不溶 3.38 3。
23 4.20 3.37 3。
07 3.28 3.29 3。
23 9。
38 9.15 8.93 9.56 9.28 8。


有机化学中的胺性质和反应胺是有机化合物中含有氮原子的一类化合物。
它们的结构形式为R-NH2,其中R代表一个有机基团。
胺分为三类:一级胺、二级胺和三级胺,根据氮原子与有机基团的连接数量不同进行分类。
胺具有多种性质和反应,对于化学研究和应用具有重要意义。
一、胺的性质1. 氨基特性:胺分子中的氮原子可供给电子对给予亲电试剂。
由于氮原子上的空轨道与孤对电子共振,形成一个带正电的亲电中心,使胺表现出亲电性质。
2. 氢键形成:胺分子中的氢与氮之间形成氢键。
氮原子上的孤对电子可与溶剂中的质子结合形成氢键,使胺分子在溶液中形成聚集态。
3. 碱性:胺分子中的氮原子带有孤对电子,使其具有碱性。
一级胺、二级胺和三级胺的碱性依次降低。
4. 氧化性:胺分子中的氮原子可被氧气氧化为氮氧化物,如N2O、NO等。
氧化性随着胺分子中氮原子上孤对电子的减少而减弱。
二、胺的反应1. 氨基取代反应:一级胺可通过与亲电试剂发生氨基取代反应。
亲电试剂将胺分子中的氨基取代为其他基团,形成新的有机化合物。
例如,一级胺与酸酐反应生成酰胺,与卤代烷反应生成胺盐。
2. 胺氧化反应:胺分子的氮原子能够被氧气或氧化剂氧化,生成相应的氮氧化物。
例如,一级胺与氧气反应生成亚硝胺,进一步氧化可生成互作用较强的亚硝酸。
此外,一氧化氮、二氧化氮等氮氧化物也可通过胺的氧化反应制备。
3. 烷基化反应:二级胺和三级胺可发生烷基化反应。
烷基卤化物与胺反应,发生亲电取代,生成相应的烷基胺。
此反应在有机合成中常用于引入烷基基团。
4. 脱水反应:胺分子中的氢可以与酸类或醛酮类化合物中的氧发生脱水反应,生成亲水胺。
脱水反应常用于制备二胺、脲、胺酮等有机化合物。
总结:胺在有机化学中具有重要的性质和反应。
它们既可以表现出亲电性质,参与氨基取代反应,也可以通过氧化反应生成氮氧化物。
此外,胺还可发生烷基化和脱水等反应。
了解胺的性质和反应有助于理解和应用于有机化学的领域中。
通过进一步的研究和发展,有机化学家们可以利用这些性质和反应来合成新颖的化合物,推动有机化学的发展和应用。
胺的化学反应胺的氧化与cope消除反应全文共四篇示例,供读者参考第一篇示例:胺是一类含有氮原子的有机化合物,具有强碱性和官能化学性质。
胺的化学反应主要包括氧化反应和Cope消除反应。
胺的氧化反应是指胺与氧气或氧化剂发生氧化反应,生成氧化胺或其他氧化产物的过程。
氧化反应通常需要在适当的条件下进行,例如在碱性或酸性条件下、高温或高压条件下或加入催化剂等。
常见的氧化剂包括过氧化氢、高氯酸、二氧化氮等。
一些脂肪胺在氧气或氧化剂的作用下可以发生氧化反应,生成相应的氧化胺。
以正己胺为例,其氧化反应如下:C6H15NH2 + O2 → C6H15NHOH在工业生产中,氧化胺是一类重要的化学品,广泛应用于染料、药物、杀虫剂等领域。
胺还可以参与Cope消除反应。
Cope消除反应是通过胺分子内部的C—N键裂解,生成烯烃和亚胺的反应。
该反应一般需要高温或酸碱催化剂的作用。
苯基胺在适当条件下可以发生Cope消除反应,生成苯和氮气:Cope消除反应在有机合成中具有重要的应用价值,可以合成烯烃等高附加值化合物。
胺的化学反应是一个广泛且重要的研究领域,掌握胺的氧化和Cope消除反应机制对相关领域的科研工作和工业生产具有重要意义。
希望今后可以有更多关于胺的化学反应的研究和应用。
第二篇示例:胺是一类含氮有机化合物,具有氨基基团(-NH2),可参与多种化学反应。
在化学反应中,胺可以发生氧化反应和cope消除反应,下面将分别介绍这两种反应的机理和应用。
胺的氧化反应是指胺分子中的氨基(-NH2)被氧化剂氧气(O2)或者氧化剂化合物氧化成氨基氧(-NO)或氨基氧化物(-NO2)。
氧化反应是一类重要的有机合成反应,可以制备一系列含氮有机化合物。
胺的氧化反应一般分为直接氧化和间接氧化两种。
直接氧化是指将胺与氧气或氧化剂直接反应生成亚胺、亚胺氧化物或氨基氧基化合物。
苯胺和氧气在存在金催化剂的条件下可以直接发生氧化反应生成亚胺化合物。
间接氧化是指将胺先与氧化剂反应生成亚胺化合物或者氨基氧化物,再进一步氧化生成氨基氧基化合物。
胺的结构式胺是一种含氮有机化合物,它的化学结构式可以写作R-NH2。
在这个结构式中,R代表一个有机基团,例如甲基(CH3)、乙基(C2H5)、苯基(C6H5)等。
根据氮原子与其他原子的配位数不同,胺可以分为三类:一、一级胺:它的氮原子只与一个有机基团相连,化学式为R-NH2。
二、二级胺:它的氮原子与两个有机基团相连,化学式为R-NH-R'。
三、三级胺:它的氮原子与三个有机基团相连,化学式为R-N(R')2。
在这三类胺中,一级胺的性质最为活泼,而三级胺最为惰性。
这是因为随着氮原子的配位数增加,它的反应性会降低。
除了以上三种胺之外,还有一种特殊的胺叫做芳香胺。
芳香胺分子中的氮原子与芳香环上的碳原子相连,化学式为Ar-NH2,其中Ar代表芳香基,例如苯基(C6H5-)等。
胺分子的空间构型通常是类似于氨分子的金字塔形结构,其中氮原子在金字塔的顶部,三个或两个有机基团分别位于底部的三个或两个角上。
这个金字塔的构型与氨分子同源,因为它们有相似的电子排布方式。
但是,与氨分子不同的是,胺分子还具有键角张力的效应。
在胺分子中,由于氮原子与有机基团之间存在着电子云的共存和排斥,使得N-H键的键角相对较大,约为107°-110°,而不是氨分子中的109.5°。
胺分子中N-H键的键长虽然比C-H键短(1.1 Å左右),但是它的键能却比C-H键低很多,只有390-510 kJ/mol左右(与有机基团的不同和二级胺、三级胺的不同而有所差异)。
因此,胺分子在生物体内扮演着重要的角色,例如作为氨基酸的组成部分和作为生物催化剂的重要组成部分等。
在化学反应中,胺分子的氮原子可以被质子化或取代。
例如,当一级胺和酸反应时,氮原子可以与质子结合形成胺的盐酸盐(R-NH3+Cl-);当一级胺和卤代烃反应时,氮原子可以取代卤素原子形成一级胺的卤代烷(R-NH-R');当二级胺和卤代烃反应时,可以形成二级胺的烷基卤代物(R-NH-R')等。