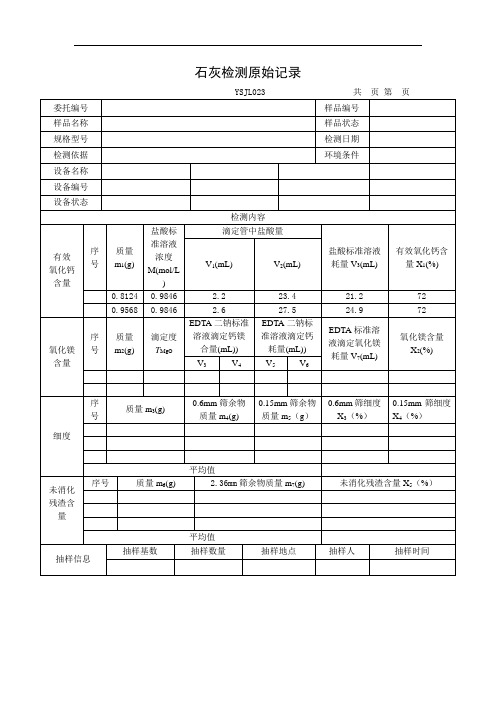
石灰钙镁含量测定用盐酸标准溶液滴定记录(4平行8对照)自动计算
- 格式:xlsx
- 大小:11.77 KB
- 文档页数:1

石灰钙镁含量试验检测记录表实验目的:测定石灰样品中的钙和镁含量。
实验器材:1.石灰样品2.三角瓶3.锥形瓶4.集气瓶5.试剂瓶6.电子天平7.称量瓶8.烧杯9.显微镜10.pH计试验步骤:1.取适量石灰样品,并在三角瓶中加入适量蒸馏水,摇匀,静置1小时,直到悬浮液达到平衡状态。
2.将上述悬浮液转移到锥形瓶中,并加入适量电导水,使液面留在锥形瓶中部。
3.在集气瓶上方浸泡试剂瓶的一端,将试剂瓶瓶口与锥形瓶瓶口连接,使试剂瓶内充满氮气。
4.倾斜集气瓶,将氮气缓慢通过试剂瓶泵入锥形瓶中,使石灰中钙和镁溶解为钙离子和镁离子。
5.经过一定时间,关闭集气瓶气流,使石灰中的钙和镁沉淀为钙镁碳酸盐。
6.将上述沉淀转移到称量瓶中,并加入适量烧杯中的蒸馏水,摇匀,静置1小时。
7.用电子天平将称量瓶和石灰样品的重量差记录下来,并计算出样品的总重量。
8.将所得总重量除以石灰样品的重量差,即可得到石灰样品中钙和镁的含量。
9.用显微镜观察沉淀样品的形态,并用pH计测定样品的pH值。
实验数据记录:样品编号:_________样品重量差:_________克总重量:_________毫克钙含量:_________%镁含量:_________%实验结果分析:通过以上实验,我们可以得到石灰样品中钙和镁的含量。
根据实验数据计算出的结果,我们可以得到样品的钙含量为_________%,镁含量为_________%。
同时,根据显微镜观察结果,我们可以得知沉淀样品的形态,以及通过pH计测定的样品的pH值。
实验结论:根据本次石灰钙镁含量试验的结果分析,我们可以得知石灰样品中的钙和镁的含量,以及样品的形态和pH值。
这些数据和信息对于进一步的石灰样品分析和应用具有重要意义。

石灰石中钙镁含量的测定实验报告石灰石是一种含有大量钙镁元素的岩石,因此石灰石的钙镁含量对于冶金、建筑、工业等领域都有重要的意义。
为了准确测定石灰石中钙镁含量,本次实验使用了EDTA(乙二胺四乙酸)滴定法。
一、实验设计1.实验目的测定石灰石中钙镁含量,掌握EDTA滴定法的实验原理和操作技能。
2.实验原理EDTA是一种宏观螯合剂,能与钙、镁等金属离子形成稳定的螯合物,并呈棕红色溶液。
可通过下列反应方程式表示:Mg(OH)2+EDTA^4-→MgY^2-+2OH-MgY^2-和CaY^2-是EDTA与Mg2+和Ca2+形成的稳定络合物。
在此反应中,滴定剂EDTA是易于反应的配合物。
Mg2+和Ca2+是待测的反应物。
(1)将样品中的石灰石转化为氢氧化物(2)将氢氧化物溶解于硝酸中(3)滴定剂EDTA与样品中的镁、钙形成络合物,结合了特定的指示剂之后,使整个溶液发生变色(4)通过计算滴定液的用量,计算出样品中的钙镁含量。
3.实验仪器分析天平、瓶塞、锥形瓶、烧杯、蒸馏水、滴定管、磁力搅拌器等。
4.实验步骤(1)称取0.4克石灰石粉末样品,加入锥形瓶中。
(2)加入20ml蒸馏水和10ml硝酸,加上烧杯盖,放置在锅炉上加热,用于将石灰石转化为氢氧化物。
(3)加热至溶液透明,并持续加热5分钟,除去NOx后,冷却到室温。
(4)转移样品溶液到250ml锥形瓶中,用蒸馏水稀释至刻度线。
(5)在250ml锥形瓶中加入Ammonium Chloride(氯化铵)-Ammonia Buffer(氨缓冲液),以使溶液呈弱碱性。
(6)加入Eriochrome Black T指示剂(EBT),使溶液呈深红色。
(7)滴加EDTA滴定液,直至溶液颜色变为蓝色,并停止滴加。
5.实验结果在该实验中,使用了粉状石灰石样品,实验结果如下:样品重量:0.4克滴定液用量:21.05ml计算结果如下:由于EDTA能与钙和镁配位形成螯合物,因此在实验时需注意注意使用纯度高的EDTA 滴定液。

石灰石或白云石中钙镁含量的测定石灰石或白云石中钙镁含量的测定一、实验目的1.练习酸溶法的分解试样方法。
2.学习应用配位滴定法测定石灰石或白云石中钙镁的含量。
3. 学习采用掩蔽剂消除共存离子的干扰。
二、实验原理石灰石、白云石的主要成分是CaCO3 和MgCO3以及少量Fe、Al、Si 等杂质,采用掩蔽剂即可消除共存离子的干扰,故通常不需分离直接滴定。
试样用HCl 分解后,钙镁等以Ca2+、Mg2+离子进入溶液,试样中含有少量铁铝等干扰杂质,滴定前在酸性条件下加入三乙醇胺掩蔽。
调节试液pH 为10,用K-B指示剂作指示剂,用EDTA 标准溶液滴定试液中Ca、Mg总量,终点(棕红色---墨绿色)。
于另一份试液中,调节pH≥12,Mg2+生成Mg(OH)2沉淀,用钙指示剂作指示剂,用EDTA 标准溶液单独滴定Ca2+,测得试液中Ca含量。
Ca、Mg总量减去Ca含量即为Mg含量。
三、仪器和药品酸式滴定管,锥形瓶(250 cm3),容量瓶稀释,摇匀后加入NH 3—NH 4Cl 缓冲溶液5mL 调节试液pH 为10,加入米粒大小(0.01g )的酸性铬蓝K- 萘酚绿B 混合指示剂(K- B),用EDTA 标准溶液滴定,溶液由棕红色转变为墨绿色即为终点。
平行测定三次。
Mg % = C EDTA V Mg ×M Mg ×10 - 3 ×00.250.250 m 试样×100%五、数据记录和处理1.试样质量 g EDTA 标准溶液浓度 mol/L2.钙含量的测定3. 钙、镁总量的测定4.镁含量的计算六、讨论操作注意事项1.称样:用差量法准确称取一份试样于烧杯中(1)将烧杯用自来水冲洗,再用纯水淌洗三遍。
(2)称量瓶的取放要用纸条,不能用手直接拿。
(3)用差量法称一份在称量范围的试样于烧杯中(4)不能有试样洒在烧杯外(5)记录数据(四位有效数字)2.酸式滴定管的准备(1)检查玻璃塞是否配套,有无橡皮套。

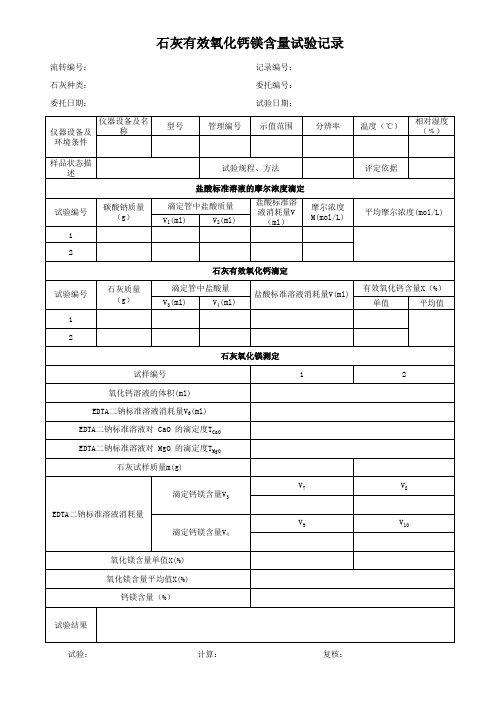
试表18-石灰有效钙镁含量试验报告试验报告:石灰有效钙镁含量试验一、实验目的本试验的目的是探究石灰的有效钙镁含量,并通过试验结果分析石灰的适用性和优劣,为农田土壤改良提供参考依据。
二、实验原理有效钙镁含量是指土壤中可溶解于水中的钙镁离子的含量。
石灰是一种常用的土壤改良剂,其中含有丰富的钙镁元素,可提高土壤的酸碱性及结构,促进植物生长。
三、实验材料2.土壤样品:采集自农田中的不同类型土壤样品。
3.蒸馏水:用于溶解石灰样品。
4.离心机:用于离心石灰水溶液。
5.试剂:含有钙镁离子的指示剂。
6.显微镜:用于观察试验结果。
四、实验步骤1.准备石灰水溶液:将石灰样品沉淀,取上部悬浮液与等量的蒸馏水混合,静置一段时间得到石灰水溶液。
2.过滤石灰水溶液:将石灰水溶液过滤,去除悬浮的杂质。
3.离心石灰水溶液:将石灰水溶液离心,分离出溶液中的固体颗粒。
4.取一部分过滤后的石灰水溶液,加入含有钙镁离子的指示剂,观察颜色的变化。
5.将试剂与石灰溶液混合均匀,观察变红的程度,通过颜色深浅判断石灰溶液中钙镁离子的含量。
五、实验结果与分析六、实验注意事项1.实验过程中要注意安全,避免直接接触试剂和石灰样品。
2.实验前要对实验室用具进行清洗和消毒,保证实验环境的卫生和无污染。
3.实验前要对石灰样品进行充分的掺混,保证取样的均匀性。
4.实验结果可能受到实验条件和仪器设备的影响,要重复实验以验证结果。
七、实验结论与展望通过本次试验,我们成功地测试了石灰样品的有效钙镁含量。
实验结果可以为农田土壤改良提供参考依据,并帮助农民选择合适的石灰样品。
此外,还可以通过进一步的实验研究,去测定石灰样品对不同类型土壤的适应性和改良效果,为农田改良提供更加准确和科学的指导。
总结:本试验通过测试石灰样品的有效钙镁含量,为农田土壤改良提供了参考依据。
通过实验结果,可以帮助农民选择适合的石灰样品,提高土壤的肥力和产量。
接下来,还可以通过进一步的研究,去探究石灰样品对不同类型土壤的适应性和改良效果,为农田改良提供更全面、准确和科学的指导。
石灰石或白云石中钙镁含量的测定
石灰石或白云石是一种广泛存在于天然界中的岩石,由于其含有大量钙镁元素,已经成为广泛使用的工业材料。
钙镁含量是判断石灰石或白云石品质的重要指标,因此,测定其钙镁含量对于相关研究和应用都有着重要的意义。
本文将介绍几种常用的测定石灰石或白云石中钙镁含量的方法。
一、滴定法
滴定法是一种测定钙镁含量的常用方法。
实验中,首先将石灰石或白云石样品溶解在氢氧化钠中,生成对应的钙镁盐,然后用EDTA溶液滴定,测定化学计量比。
用以下公式计算出样品中钙镁含量的百分比:
%CaCO3 = (V0 - V1) × N × 50 / m
其中,V0是蒸馏水的初始体积;V1是EDTA滴加到pH指示剂转色点时的体积;V2是EDTA继续滴加至乳白色沉淀消失时的体积;N是EDTA溶液的实验当量浓度;m是待测样品的质量。
二、荧光法
荧光法是一种非常灵敏、准确的测定钙镁含量的方法。
实验中,首先将石灰石或白云石样品加入荧光试剂,然后用荧光光谱仪测定样品的荧光光谱。
由于钙和镁的荧光光谱曲线不同,因此可以通过对比荧光光谱曲线,测定出样品中钙镁的含量。
三、光谱法
总结而言,以上三种方法都是测定石灰石或白云石中钙镁含量的常用方法,可以根据实际需要选择合适的方法进行测定。
通过对样品中钙镁含量的测定,可以更加准确地判断其品质,并为相关研究和应用提供支持。
实验10 建筑材料石灰中钙镁含量测定教学目的与要求:1.学习盐酸直接滴定法测定钙镁含量的原理和方法;2.了解络合滴定法测定钙镁含量的原理和方法;3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;4.进一步熟练掌握滴定操作;5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:重点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.培养学生的动手操作能力及创新意识。
难点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.盐酸直接滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:898℃问题1:石灰有哪些用途?首先,概括一下在建筑、农业、工业上的用途,其中的熟石灰功不可没。
建筑:三合土、石灰浆(Ca(OH)2+CO2=CaCO3↓+H2O)。
农业:配制波尔多液作为农药(Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓)。
将适量的熟石灰加入土壤,可以中和酸性,改变土壤的酸碱性。
工业:制氢氧化钠(Ca(OH)2+Na2CO3=CaCO3↓+2NaOH)。
配制价格低廉的漂白粉(Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O)。
问题2:石灰的主要成分有哪些?石灰的主要成分是氧化钙(CaO),其次为氧化镁(MgO)。
问题3:建筑用石灰有哪些?建筑用石灰有:生石灰(块灰),生石灰粉,熟石灰粉(又称建筑消石灰粉、消解石灰粉、水化石灰)和石灰膏等几种形态。
问题4:测定石灰中钙镁含量的意义?根据石灰中钙、镁含量的高低,可以判断石灰的质量等级,并根据其含量计算其参加量,有效地利用资源。
问题5:测定石灰中钙镁含量的方法有哪些?测钙的方法:配位滴定法、酸碱滴定法(返滴定法和直接滴定法)、间接滴定法。
配位滴定法:酸碱滴定法:1、返滴定法:用过量的盐酸标准溶液直接滴在碳酸钙样品上,剩余的盐酸用标准氢氧化钠溶液滴定;2、直接滴定法:T0811-1994.(p35)间接滴定法:将CaCO3转化为CaC2CO4后,用H2SO4溶解,再用KMnO4标准溶液滴定,把C2O42-氧化为CO2,当把C2O42-氧化完全后,滴入的KMnO4溶液不再褪色。