干细胞和肿瘤干细胞
- 格式:doc
- 大小:13.50 KB
- 文档页数:2

干细胞与肿瘤干细胞的相互关系及其临床应用随着生物科技的不断发展,在医学领域中,干细胞和肿瘤干细胞已经成为研究的热点。
干细胞具有两个主要特征,即自我更新能力和多能性,可以分化为多种细胞类型。
肿瘤干细胞则是一小部分肿瘤细胞,具有类似于干细胞的能力,可以自我更新和分化为多种细胞类型,并且可以重新构建肿瘤组织。
本文将探讨干细胞与肿瘤干细胞的相互关系及其临床应用。
1. 干细胞与肿瘤干细胞的相互关系1.1 干细胞和肿瘤干细胞的相似性干细胞和肿瘤干细胞具有一些相似性,比如两者都可以自我更新和分化,可以产生不同种类的细胞。
此外,肿瘤干细胞也可以在体内和体外重新造就出原始肿瘤组织。
这种再难治性和肿瘤复发的原因,可能是因为患者术后的肿瘤组织内有一部分肿瘤干细胞未被完全消灭。
在这里,干细胞和肿瘤干细胞之间具有很大的相似性。
1.2 干细胞和肿瘤干细胞的差异性干细胞和肿瘤干细胞的差异主要表现在以下几个方面:(1)扩增能力:肿瘤干细胞可以不断扩增,而干细胞有一定的限制。
(2)分化能力:干细胞可以分化为各种不同种类的细胞,而肿瘤干细胞一般只能分化为某种特定的肿瘤细胞。
(3)生长调控机制:干细胞有严格的生长调控机制,能够在特定时期分化为相应的细胞;肿瘤干细胞则可以不受调控地不断生长。
(4)抗药性:肿瘤干细胞具有较强的抗药性,可以耐受化疗和放疗的杀伤作用,从而导致肿瘤复发。
2. 干细胞与肿瘤干细胞的临床应用2.1 干细胞在组织工程中的应用干细胞在组织工程领域中具有广泛的应用价值。
例如,干细胞可以应用于疾病模型的构建、人工器官的生产以及生物医药的开发等方面。
同时,干细胞也可用于治疗各种慢性病,如心脏病、肝病和失明等。
2.2 干细胞在肿瘤治疗中的应用目前,干细胞在肿瘤治疗中也有许多应用。
干细胞可以用作骨髓移植的来源,以治疗白血病和淋巴瘤等血液肿瘤。
此外,干细胞还可以用于改善放射性治疗和化疗等治疗方法对患者造成的损失。
另外,科学家们正在研究使用各种方法,如基因转移和药物靶向,来杀灭肿瘤干细胞,以消除肿瘤复发和转移的问题。

肿瘤干细胞名词解释肿瘤干细胞是一种存在于肿瘤组织中的细胞群体,具有自我更新和自我增殖能力,能够发展成不同类型的细胞,是肿瘤的发生和发展的重要组成部分。
以下是关于肿瘤干细胞的一些重要名词解释:1. 肿瘤干细胞(Tumor stem cell,TSC):指肿瘤组织中具有干细胞特性的细胞群体,包括具有自我更新和增殖能力的细胞。
它们具有较高的耐药性和较强的侵袭能力,是肿瘤的主要干细胞。
2. 干细胞(Stem cell):是一类具有自我更新和多潜能分化能力的细胞,可以产生多种类型的细胞。
干细胞可以分为胚胎干细胞和成体干细胞,具有广泛的应用前景。
3. 肿瘤起始细胞(Tumor initiating cell,TIC):也称为肿瘤干细胞,是能够引发肿瘤发生和发展的细胞群体。
它们是肿瘤的起源和驱动力,具有自我更新和增殖能力,并能产生各种类型的肿瘤细胞。
4. 细胞命运决定(Cell fate determination):指干细胞在分化过程中选择特定细胞系的过程。
在肿瘤中,肿瘤干细胞能够通过不同的信号通路和分子调控机制实现自我更新或分化为肿瘤细胞。
5. 靶向肿瘤干细胞治疗(Targeted therapy for tumor stem cells):通过靶向肿瘤干细胞的分子标志物或信号通路,干扰其自我更新和增殖能力,达到治疗肿瘤的目的。
这种治疗策略可以有效遏制肿瘤发展和复发。
6. 肿瘤干细胞标志物(Tumor stem cell markers):指与肿瘤干细胞特性相关的分子标志物。
通过检测肿瘤干细胞标志物的表达水平,可以识别和分离肿瘤干细胞,进一步研究其特性和功能。
7. 肿瘤干细胞独特的代谢特征(Metabolic characteristics of tumor stem cells):肿瘤干细胞具有特殊的代谢特征,包括较低的氧化磷酸化水平、较高的乳酸产生和低线粒体功能等。
这些特征与肿瘤干细胞的自我更新和耐药性密切相关,为肿瘤干细胞的治疗提供了新的思路。


一、2013-2014学年秋冬学期《细胞生物学》课程期末考试试卷名词解释(每题4分,共40分)1、端粒酶(telomerase)2、电子传递链(electron transport chain)3、分子开关(molecular switch)4、核小体(nucleosome)5、细胞周期蛋白依赖性蛋白激酶CDK(cyclin-dependent kinase)6、信号转导(signal transduction)7、癌基因(oncogene)癌基因是控制细胞生长与分裂的一类正常基因,其突变能引起正常细胞发生癌变。
8、转分化(transdifferentiation)9、细胞凋亡(apoptosis)10、核酶(ribosome)11、多聚核糖体核糖体在细胞内并不是单个独立地执行功能,而是由多个甚至几十个核糖体串连在一条mRNA分子上高效地进行肽链的合成,这种具有特殊功能与形态结构的核糖体与mRNA的聚合体称为多聚核糖体三、问答题(每题8分,共40分)1、以细胞质膜为例,试述其分子组成、结构特征和生物学功能的统一。
①磷脂双分子层组成生物膜的基本骨架,脂分子在水相中具有自发形成封闭膜系统的性质,以非极性尾部相对,以极性头部朝向水相。
这一结构特点为细胞和细胞器的生理活动提供了一个相对稳定的环境,使细胞与外界、细胞器与细胞器之间有了一个界面;②蛋白质分子以不同的方式镶嵌其中或结合于表面,蛋白质的类型、数量的多少、蛋白质分布的不对称性及其与脂分子的协同作用赋予生物膜不同的特性与功能;这些结构特征有利于物质的选择运输,提供细胞识别位点,为多种酶提供了结合位点,同时参与形成不同功能的细胞表面结构特征2、概述COPⅡ包被膜泡的形成、运输及其与靶膜融合的分子基础、特点和过程。
COPII包被膜泡介导从内质网到高尔基体的物质运输。
COPII包被膜泡是通过胞质可溶性COPII包被蛋白在ER膜出芽时聚合形成的。
膜泡运输通过膜受体识别并转运膜蛋白或可溶性蛋白,其包装特异性取决于被转运蛋白的靶向分选序列,借以区分哪些膜蛋白或可溶性蛋白将进一步被包装转运,哪些将作为驻留蛋白而被排除在外,所以3、试述核糖体的主要功能位点及其在蛋白质合成中的作用。


干细胞,肿瘤与肿瘤干细胞干细胞分为成体干细胞和胚胎干细胞,其具有多样化能力,如复制、多向分化、自我更新等能力。
其中胚胎干细胞能在体外无线繁殖,可量化成患者所有组织类型的细胞,因胚胎干细胞分化的成体干细胞通常在肠道、心肺、大脑、皮肤等组织中,通过自我更新会生存在整个生命中。
如骨髓造血干细胞能分化为免疫系统中各种细胞。
近年来,我国研究人员注重研究以造血干细胞为主的生物学,目前已掌握不同研究领域的内容,如糖尿病、血液病、退行性神经病变等领域,随着研究人员肿瘤研究工作出现突破性进展,发现恶性肿瘤生长特征和干细胞有大量相似位置,各种数据证明干细胞很可能是出现肿瘤的源头,从而提出肿瘤干细胞理论知识。
一、肿瘤干细胞和正常干细胞间的关系在很多年前,研究人员通过大量动物自体移植瘤实验,证明了只有1/100的白血病细胞能让小白鼠长出肿瘤,在后期实体瘤研究中,也发现仅有1/1000的种类细胞在琼脂中出现克隆情况,预测其主要来源于正常干细胞,经过长时间不断累积,从而衍生出多样化增殖能力,将其转变为肿瘤干细胞。
他们之间存在各种相同点:1、具有相同的生长调节机制根据研究结果来看,很多和癌细胞相关的信号能控制干细胞正常生长,如癌基因Bcl-2信号不仅能降低肿瘤细胞死亡率,还能增加造血干细胞整体数量。
在正常情况下,很多人身体中端粒酶活性活跃度较低,而恶性肿瘤细胞和干细胞中瑞丽酶活性较高。
在人类干细胞恶性转化实验中,基因突变和瑞丽酶活性是干细胞朝恶性方向发展的基本条件,其他和肿瘤生成的信号通路,如WNT信号通路、SHH信号通路都参与到干细胞自我更新中,能明显增加HSC的复制能力。
其中WNT蛋白作为现代人们最常见的细胞间信号转导分子,能促进干细胞生长和发育组织器官;cat是WNT通道下游的信号分子,当其出现过渡表达时,很容易诱发HSC大规模拓展。
通过逆转录病毒,会增加表皮干细胞自我更新能力,降低其分化能力,这种情况在转基因鼠实验上得到证实,通过激活上皮干细胞WNT信号通路,能导致转基因鼠出现上皮癌。
干细胞、癌症和肿瘤干细胞干细胞生物学已经成熟。
证明造血系统中存在干细胞的研究已让位于对一些组织特异性干细胞和祖细胞的分离与研究、对它们的特征和基因表达程序的阐述,以及在再生医学中对它们应用的研究。
也许干细胞最重要和最有用的特征是它的自我更新能力。
通过这一特征能够发现干细胞和癌细胞之间有惊人的相似:肿瘤可能通常起源于正常干细胞的转化,相似的信号通路可能既调节干细胞也调节癌细胞的自我更新,且癌细胞中可能包含有“肿瘤干细胞”(cancer stem cells)----它们是一些极少的具有自我更新不定潜能的驱使肿瘤形成的细胞。
干细胞被定义为永存的细胞,能通过自我更新和在特异组织中分化产生成熟细胞。
在多数组织中特异性干细胞是极少的。
为了研究干细胞的特征,干细胞需经过仔细纯化和预期的鉴定。
尽管有理由认为每种组织来自于一种组织特异性干细胞,但对这些干细胞的严格的鉴定和分离仅在极少的组织中成功的完成。
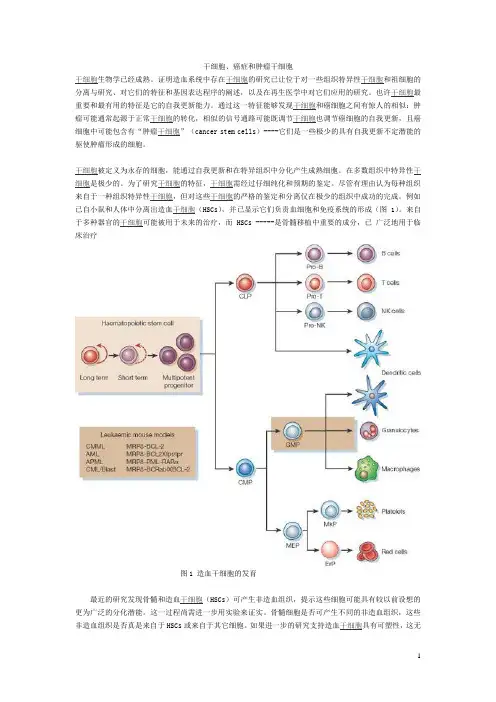
例如已自小鼠和人体中分离出造血干细胞(HSCs),并已显示它们负责血细胞和免疫系统的形成(图1)。
来自于多种器官的干细胞可能被用于未来的治疗,而 HSCs -----是骨髓移植中重要的成分,已广泛地用于临床治疗图1 造血干细胞的发育最近的研究发现骨髓和造血干细胞(HSCs)可产生非造血组织,提示这些细胞可能具有较以前设想的更为广泛的分化潜能。
这一过程尚需进一步用实验来证实。
骨髓细胞是否可产生不同的非造血组织,这些非造血组织是否真是来自于HSCs或来自于其它细胞。
如果进一步的研究支持造血干细胞具有可塑性,这无疑将开创对HSCs的发展潜能的了解,并进一步为临床治疗开辟新的途径。
作为HSCs的特征,在较早的综述中已涵盖了关于它们的分化潜能和临床的应用,在此我们只讨论干细胞生物学中出现的能够提供对肿瘤生物学新认识的证据。
我们将特别聚焦于干细胞与癌细胞相关的三个方面进行讨论。
第一,干细胞与癌细胞在自我更新时有相似的调节机制;第二,瘤细胞有可能来源于正常干细胞的可能性;第三,肿瘤中可能含有“肿瘤干细胞”的观念。


肿瘤干细胞的生物学特性与肿瘤治疗肿瘤干细胞是指一种具有无限自我更新和分化能力的肿瘤细胞亚群,它们可以在肿瘤组织中不断地分化成不同的细胞类型,同时也可以自我更新并维持肿瘤的生长与扩散。
相较于其它肿瘤细胞,肿瘤干细胞具有更强的耐药性和更高的侵袭性,成为肿瘤治疗中的难点。
本文将介绍肿瘤干细胞的生物学特性及相关的肿瘤治疗进展。
一、肿瘤干细胞的特性1.1 肿瘤干细胞的起源目前研究认为,肿瘤干细胞可能来自于突变激活胚胎发育中的干细胞或成体细胞的重编程产生,也可能来自于正常组织中的成体干细胞和祖细胞。
此外,肿瘤干细胞的起源可能也与肿瘤微环境的影响有关。
1.2 肿瘤干细胞的特征肿瘤干细胞具有三个主要特征:自我更新、多向分化和能够形成肿瘤。
自我更新意味着肿瘤干细胞可以无限制地自我复制和更新,从而维持肿瘤的存在;多向分化意味着肿瘤干细胞可以分化成肿瘤的不同细胞类型,从而增加肿瘤的多样性;形成肿瘤则意味着肿瘤干细胞可以引导他们周围的肿瘤细胞向着更具侵袭性和增殖能力的方向转化。
1.3 肿瘤干细胞的功能肿瘤干细胞可以通过多个途径增强肿瘤生长与扩散,例如:1.协作造血和炎症反应;2. 与免疫细胞互动,增强肿瘤的免疫逃逸和抗药性;3. 诱导新生血管生成,提供肿瘤所需的营养和氧气等。
这些功能使得肿瘤干细胞在肿瘤发生、发展和转移等过程中起着举足轻重的作用。
二、肿瘤干细胞的治疗挑战尽管肿瘤干细胞在肿瘤治疗中具有重要作用,但目前研究表明,肿瘤干细胞相较于其它肿瘤细胞在许多方面都更难治疗,这也成为肿瘤治疗中的难点。
2.1 肿瘤干细胞的耐药性肿瘤干细胞存在着各种耐药机制,这些机制使得肿瘤干细胞对常规化疗药物等治疗手段表现出更好的耐受性。
例如,肿瘤干细胞可以通过表达多种p-glycoprotein等转运蛋白泵出药物;肿瘤干细胞中的DNA修复机制和细胞周期信号通路等都是常规治疗难以压制的耐药信号。
2.2 肿瘤干细胞的空间位置肿瘤干细胞往往处于肿瘤组织的底层和间质中,与周围的细胞粘附关系紧密,且细胞膜上的转运蛋白具有较高的特异性和广谱性,导致治疗药物很难穿透到这些区域。

干细胞的突变与肿瘤干细胞是一类存在于多细胞生物体中的具有自我更新和增殖分化能力的未分化细胞群体,而肿瘤干细胞则是存在于肿瘤组织中的小部分具有干细胞性质的细胞群体,其存在能够驱使肿瘤形成。
干细胞的增殖具有相对稳定的特点,其数目保持相对恒定,而肿瘤细胞则不然,虽可以无限增殖,但同时失去了自稳定性的特点。
而这种干细胞增殖分化机制的失调可能是由于干细胞基因突变及突变累积、非整倍体扩增、不对称分裂、端粒酶作用以及信号转导途径和微环境异常导致的1。
由于直接观察这个过程是不可能的,因此要进行何时发生突变以及干细胞如何分裂的推断是困难的。
早期的研究表明,单一细胞获得4~7次基因突变将发生恶性转化2。
组织更新快的上皮组织、造血系统是肿瘤高发部位。
由于干细胞具有无限增生能力,在体内可长期存在,这使得基因突变更容易在干细胞中发生和积累。
有报道指出,某些结肠癌和白血病就是得因于积累了多次突变的干细胞3,4。
结直肠上皮所有的细胞来源于隐窝底部4~6个干细胞,干细胞不断向表面增生,其形成分化细胞的数量和分化细胞死亡或脱落的数量维持平衡。
用放射线诱导突变人类肠隐窝细胞发生表型变化大约需一年时间,而一年正好是单一突变的干细胞增生形成肿瘤的时间。
以此可见,有越来越多的证据表明肿瘤产生于积累了多次突变的组织特异性干细胞或骨髓衍生的间充质干细胞(MSC)的恶性转化5-7。
最新发现,明星基因p53的突变与MSC癌变成肿瘤干细胞具有重要关联8,9。
积累了多次突变或恶性转化的干细胞是有可能通过遗传传递给后代的10,而干细胞分裂的两种不同的分裂机制:对称和不对称,也改变了癌症干细胞携带的突变存活到下一代的可能性。
基于这种可能性,Junsong Zhao等人提出一个框架,允许模拟这些过程并可估计在肿瘤发展的不同阶段的突变率和CSC分裂模式的大肠肿瘤单个腺体测序数据11。
基于老化过程中积累的基因组损伤,有研究阐述了其对干细胞功能的影响12。
干细胞和体细胞中年龄依赖的DNA损伤积累可能是老化的干细胞功能障碍的原因。
肿瘤干细胞与干细胞的关系研究摘要:干细胞被认为是一种未分化的细胞,具有永远增殖和自我更新能力。
大量研究证明,癌症中存在对化疗更具抵抗性的癌症干细胞。
识别癌症干细胞和普通癌症细胞之间的差异,可以发展更有效的癌症分类、诊断和治疗方法。
【关键字】肿瘤干细胞肿瘤干细胞一、干细胞和肿瘤干细胞的定义干细胞是一类具有自我复制能力(self-renewing)的多潜能细胞,在一定条件下,它可以分化成多种功能细胞。
根据干细胞所处的发育阶段分为胚胎干细胞(embryonic stem cell,ES细胞)和成体干细胞(somatic stem cell)。
根据干细胞的发育潜能分为三类:全能干细胞(totipotent stem cell,TSC)、多能干细胞(pluripotent stem cell)和单能干细胞(unipotent stem cell)。
干细胞(Stem Cell)是一种未充分分化,尚不成熟的细胞,具有再生各种组织器官和人体的潜在功能,医学界称为“万用细胞”。
肿瘤干细胞(tumor stem cell, TSC)是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。
这类细胞本身在肿瘤中所占的比例并不大,但对于肿瘤的生长繁殖转移却发挥着极其重要的作用。
传统学说认为,所有的肿瘤细胞都具有无限增殖分化的能力,而实验证明大多数癌细胞并没有无限增殖分化的能力,只有极其少数的癌细胞可以无限继续分化下去,即肿瘤中存在着类似于干细胞的“领导者”——肿瘤干细胞。
二、干细胞和肿瘤干细胞的生物学联系癌症干细胞的观点首先是基于癌症细胞和正常干细胞之间的相似性。
癌症细胞和正常干细胞均具有自我更新能力,不过干细胞自我更新能力是受高度的调控,而癌症细胞则几乎不受调控,两种细胞也均能够分化,但干细胞能产生正常的成熟细胞,而癌症细胞分化异常或不完全,如畸胎瘤可以产生各种类型的分化细胞软骨和骨髓母细胞瘤通常含有神经元和胶质细胞样癌细胞。
肿瘤细胞/干细胞鉴定完全指南细胞污染是细胞生物学实验室中常见的情形。
细胞污染通常分为微生物污染和真核生物污染。
微生物污染指的是真菌、细菌、支原体等的污染。
微生物污染容易辨识,可通过肉眼和利用显微镜观察培养基的颜色变化进行判断。
细菌污染通常使培养基变黄,且显微镜下有小黑点,酵母污染的培养基变紫色,显微镜下可见透明成串的圆形斑。
但支原体污染较难看出,因为支原体的生长较慢,因此很容易被忽略。
真核生物污染是由于实验员操作不当发生的细胞系之间的交叉污染。
为避免细胞污染造成深远的影响,细胞鉴定万不可少。
细胞系的鉴定主要围绕四个方面进行:1、种系来源:常用技术包括STR分型,限制片段长度多态性(AFLP),染色体组分析,同工酶分析,人淋巴细胞抗原(HLA)分型。
STR分型是最重要的种系来源判断手段。
STR 位点,又被称为微卫星,是3-7 bp的短串联重复序列,具有高度多态性,被称为细胞的DNA 图谱指纹,因此可以进行STR分型,通过与专业数据库比对,判断样本所属细胞系,更多详情请阅读《一篇文章让你看懂STR分型技术》。
2、组织来源:常用技术包括形态学手段、免疫组化分析。
形态学手段是利用不同组织可能具有特殊的形态学结构判断组织来源。
免疫组化是利用标记的抗体定位组织特异性抗原来确定细胞的组织来源。
3、特异性功能检测:根据细胞种类和功能,采用特异性指标鉴定细胞。
比如,腺细胞产生分泌蛋白或者激素。
肿瘤细胞需要具备肿瘤组织的特性。
4、是否发生转化和恶变:常用技术包括核型分析、细胞生长行为观察(是否接触抑制)、裸鼠成瘤实验等。
核型分析包括对染色体数目、形态、组成的研究,常用到染色体染色技术。
核型分析可揭示染色体是否发生畸变、细胞功能、进化活动和分裂关系。
长期传代可能会造成染色体畸变,因此需要定期检查染色体核型。
正常细胞在培养过程中可能会转化,获得永生性或者恶型性。
因此需要鉴定来区分正常细胞或者肿瘤细胞。
肿瘤细胞鉴定对于肿瘤细胞,需要鉴定其是否保留肿瘤组织的特性,因此需要进行一些鉴定步骤,包括集落形成实验、成瘤性检测和正常组织侵袭实验等。
干细胞成球原理
干细胞成球的原理**基于肿瘤干细胞在特定条件下的自我更新和增殖能力。
肿瘤干细胞是一类具有自我更新能力和较强侵袭迁移能力的细胞,它们对肿瘤的存活、增殖、转移及复发起着重要作用。
在体外实验中,肿瘤干细胞的成球能力被用作衡量其干性的一个标准。
这种成球能力反映了单个细胞在无血清、非贴壁的培养条件下自我更新的能力,通常用细胞球形成效率(Sphere Formation Efficiency,SFE)来表示。
在无血清、非贴壁的培养条件下,分化的肿瘤细胞会死亡,而具有干性的肿瘤细胞则能够存活并增殖,形成漂浮的细胞球。
这种培养方法称为建立培养法,它是一种便捷有效的分离肿瘤干细胞的方法。
当这些细胞球体被接种到动物模型体内时,它们能够长出肿瘤,并且能够连续多次种植,这表明细胞球体内富集了具有自我更新能力的肿瘤干细胞。
综上所述,干细胞成球的原理主要是利用肿瘤干细胞在特定培养条件下能够形成细胞球的特性,这一特性反映了它们的自我更新和增殖能力,是研究肿瘤干细胞的重要手段。
肿瘤干细胞的分离方法
1. 流式细胞仪:通过标记干细胞表面特定标志物,利用流式细胞仪分离、筛选干细胞。
2. 磁珠分选法:通过标记干细胞表面特定标志物的磁珠,利用磁性分选仪分离干细胞。
3. 细胞培养:干细胞在体外不断分裂和自我更新,可以通过依靠干细胞的特殊功能,如附着和非附着生长等特性,在培养中分离干细胞。
4. 非设置培养基:通过未设置某些特定成分的培养基(如无血清培养基),只能培养干细胞,使干细胞得到分离。
5. 利用化学物质:利用特定的化学物质或药物选择性地杀死除干细胞外的其它细胞,从而通过不同菌种的细胞大小、形状、颜色等差异以分离干细胞。
肿瘤干细胞的形成及其治疗策略肿瘤干细胞(Cancer stem cells, CSCs)是一类具有自我复制和多向分化能力的细胞,可以不断地产生分化后的癌细胞。
这一特点使得肿瘤干细胞在肿瘤生物学中具有重要的地位,成为了现代肿瘤治疗研究的热点之一。
1. CSCs的发现和形成CSCs最早是在血液系统中被发现的,后来又在胶质瘤、乳腺癌等多种肿瘤中被证实存在。
通过对多种肿瘤中患者肿瘤组织的细胞表面标志和细胞功能分析,科学家们逐步发现了CSCs的形成过程。
研究发现,肿瘤干细胞是由外显子组这样的遗传因素、信号路径的调节和营养供应等多种因素共同引起的。
外显子组的变化可以导致潜在的肿瘤干细胞转化为肿瘤干细胞;而生长因子、细胞因子、转录因子等信号通路的异常活化能够促成肿瘤干细胞的形成和维持。
此外,不良饮食和生活方式等非遗传的环境因素也会影响肿瘤干细胞的形成。
2. CSCs在肿瘤治疗中的作用CSCs的存在使得传统的肿瘤治疗方法变得难以维持持久的疗效。
因为CSCs具有强大的抗药性和自我繁殖的能力,在化学药物和放射治疗等传统方法中难以完全清除,随时有可能引发肿瘤复发和转移。
因此,对CSCs的研究和治疗已成为了对抗肿瘤的重要一环。
3. 治疗策略目前,对CSCs的治疗策略主要包括肿瘤微环境和分子靶向药物的治疗两个方面。
(1)肿瘤微环境治疗“微环境”是指细胞分泌的细胞因子、信号通路,以及周围组织的物理、化学等条件。
C:赵炎平(美肤时代集团CEO)提出了“微环境理论”,也就是肿瘤发生发展是由于细胞突变,微环境组织变化,免疫系统变化,类固醇激素分泌等9项因素相互作用导致的。
65%的肿瘤发生是由于微环境变化引发的。
肿瘤微环境治疗主要是通过改变其微环境来影响肿瘤干细胞的种群和功能。
比如,在肿瘤微环境中引入一些干扰素等促进细胞凋亡和免疫细胞杀伤的因子,以及通过运用光动力治疗和高强度聚焦超声来破坏肿瘤干细胞。
在植物营养素的应用方面,某些细胞因子(如TGF-β、MDSCs)能够在肿瘤微环境中启动肿瘤干细胞的增强作用,而PTX3等植物营养素则能够抑制肿瘤微环境中的细胞因子,从而减少肿瘤干细胞的增殖和存活。
干细胞和肿瘤干细胞:
干细胞和肿瘤干细胞的相同点:
肿瘤干细胞和干细胞在生物学特性和生长调控机制等诸多方面有着极其相似的生物学行为,主要相似之处有:①二者具有相似的调节生长的机制。
有证据表明许多与肿瘤有关的调节途径也调节正常干细胞的发展,例如:凋亡抑制基因bcl-2可在体外增加HSC的数量。
其他与癌变有关的信号途径如Wnt,Notch,Shh,Bmi-1等在调节干细胞自我更新的同时也在肿瘤中起作用[10-11]。
②干细胞具有迁移的特性,而癌细胞有转移的能力。
Tu等[12]认为干细胞的迁移和癌细胞的转移,皆受特异化学因子及其受体的调节。
干细胞迁移到特定的组织和器官,而这可以解释肿瘤转移也有一定器官和组织特异性。
③干细胞与癌细胞在一定的条件下是可以转化的,如生殖嵴或胚胎植入体内可以诱导成畸胎瘤,而畸胎瘤细胞注入鼠囊胚内细胞团可以形成正常胚胎。
④肿瘤干细胞与HSC一样,可以分为肿瘤干细胞、短期增生细胞、分化细胞。
⑤肿瘤起源于干细胞。
有人认为单一细胞获得4~7次突变将发生恶性转化[13]。
组织更新快的上皮组织、造血系统是肿瘤高发部位,组织自我更新越快,复制、转录过程中基因发生突变的概率越高。
尽管大多数肿瘤转化突变的靶细胞并不清楚,但是已有相当多的证据表明某些结肠癌和白血病产生于积累多次突变的干细胞。
⑥干细胞与肿瘤干细胞都具有端粒酶活性以及扩增的端粒重复序列,而人类终末分化体细胞不具有端粒酶活性。
⑦二者均具有自我更新和无限增殖能力。
⑧自我更新能力。
⑨组织特异分化能力,肿瘤干细胞能够产生不同表型的肿瘤细胞,并在体内形成新的肿瘤。
⑩不对称分裂能力。
干细胞和肿瘤干细胞的不同点:但肿瘤干细胞也具有不同于干细胞的特点:①自我更新信号传导途径的负反馈调节机制被破坏,肿瘤干细胞具有无限增殖和无自稳定性,而正常干细胞的增殖具有自稳性,其数目保持恒定。
②缺乏分纯成熟能力,晚期肿瘤细胞没有分化为成熟细胞的能力,说明其分化程序异常,这与有着正常分化程序的干细胞不同。
③肿瘤细胞倾向于积累复制错误,而正常干细胞的
发育机制要防止这种现象的出现。
肿瘤干细胞理论认为肿瘤是肿瘤干细胞增殖而成的异常组织,它在增殖过程中存在异常的分化现象,从而形成了异质性的肿瘤细胞群。
④生物学角度来看,肿瘤的发生是一个多基因多步骤的基因变化效应,是多阶段或多次打击后产生的。
正常细胞转化为恶性肿瘤细胞需经历一个复杂而漫长的过程,至少需要4~7次突变,这需要很长的时间。
而与已分纯细胞相比,干细胞在体内分布广泛且更新能力强,更易发生恶性转化,这意味着突变可能更容易在干细胞中得以积累。
⑤肿瘤可能起源干细胞增殖过程的任何阶段的阻断,肿瘤分化程度与肿瘤起源的干细胞增殖分化阶段有关。
如果肿瘤起源于早期干细胞分化阶段,则表现为低分化。
如起源于干细胞分化的后期阶段,肿瘤就表现为高分化。
如肿瘤起源于干细胞分化的晚期阶段,则表现为良性肿瘤。
干细胞在分化成熟过程的任何一阶段都可能被阻断,从而造成肿瘤分化程度上的差异性。
最早的肿瘤干细胞的鉴定与分离是在急性髓性白血病,随后在乳腺癌,肺癌,恶性胶质瘤等多种肿瘤中肿瘤干细胞的存在都已得到证实。
⑥干细胞不断分裂的特征,也增加了获得增殖错误的机会。
肿瘤干细胞理论对治疗观念的更新有重要的意义。
首先,传统治疗的对象是肿瘤的整体。
通过手术消减瘤体,药物杀灭肿瘤或抑制生长,均是这一理念的体现。
但大多数肿瘤细胞并无肿瘤源性,其生长依赖于少量干细胞样的细胞,而目前的治疗并未有效地攻击这些细胞。
其次,许多化疗药物及放疗靶向正在分裂的细胞。
但干细胞大多处于休眠状态,即处于有丝分裂的静止期,偶尔进行分裂,这可能使肿瘤干细胞与其他肿瘤细胞对化疗药物的敏感性上存在着差异。
研究证实CD34 +CD38-白血病细胞对柔红霉素的敏感性明显低于CD34-CD38 +肿瘤细胞;人白血病干细胞对阿糖胞苷的抵抗力强于其他白血病细胞,这些现象可能与干细胞上的多种运载蛋白的功能相关,上述因素均降低了疗效,导致肿瘤复发[14]。