高二化学乙酸和乙酸乙酯-P
- 格式:pdf
- 大小:388.39 KB
- 文档页数:11

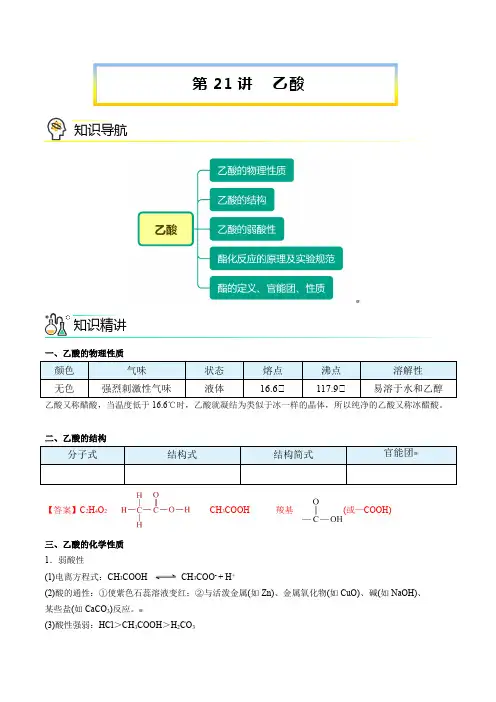
一、乙酸的物理性质颜色 气味 状态 熔点 沸点 溶解性 无色强烈刺激性气味液体16.6℃117.9℃易溶于水和乙醇乙酸又称醋酸,当温度低于16.6℃时,乙酸就凝结为类似于冰一样的晶体,所以纯净的乙酸又称冰醋酸。
二、乙酸的结构分子式 结构式 结构简式官能团【答案】C 2H 4O 2CH 3COOH羧基(或—COOH)三、乙酸的化学性质 1.弱酸性(1)电离方程式:CH 3COOHCH 3COO - + H +(2)酸的通性:①使紫色石蕊溶液变红;②与活泼金属(如Zn)、金属氧化物(如CuO)、碱(如NaOH)、 某些盐(如CaCO 3)反应。
(3)酸性强弱:HCl >CH 3COOH >H 2CO 3第21讲 乙酸知识导航知识精讲(4)应用:除水垢CaCO3 + 2CH3COOH === Ca(CH3COO)2 + CO2↑+ H2O 2.酯化反应实验装置实验步骤在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓H2SO4和2 mL乙酸,再加入几片碎瓷片。
连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上。
实验现象饱和Na2CO3溶液的液面上有无色透明的油状液体生成,且能闻到香味。
实验结论①乙酸与乙醇在浓H2SO4存在且加热的条件下,反应生成了不溶于水的物质。
②化学方程式:____________________________________________________【答案】CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O乙酸乙酯的物理性质:颜色气味状态密度溶解性无色透明有芳香气味油状液体比水小难溶于水,易溶于有机溶剂四、酯化反应的概念与原理1.定义:酸与醇反应生成酯和水的反应,叫酯化反应。
2.特点:酯化反应属于取代反应,也是可逆反应,乙酸乙酯会与水发生水解反应生成酸和醇。
3.原理:酸脱羟基,醇脱氢。
五、酯酯的官能团是酯基(,或写作—COOR),很多鲜花和水果的香味都来自酯。

资源信息表12.2 醋和酒香(共2课时)第2课时酯化反应和乙酸的用途一、设计思想学习乙酸的目的在于利用乙酸的化学性质进行有机合成,制取新的有机物。
因此,本节学习的前提是弄清乙酸的重要化学性质。
乙酸的重要性质之──酸性,在上一课时通过实验进行了探究,本课时以乙酸和乙醇的酯化反应为中心展开教学。
由于酯化反应既是羧酸的性质,又是醇的性质,所以学习乙酸的同时,使学生对学过的乙醇的性质进一步认识理解。
对酯化反应历程的认识是本节课的难点。
由于乙酸与乙醇的分子间脱水形式有两种可能,在酯化反应中究竟按哪种方式脱水,是无法在本节通过实验进行验证的,只能通过“示踪原子法”的讲解和flash动画模拟反应历程来说明,也加强学生的科技意识。
在介绍酯化反应方程式时,为酯的水解反应埋下伏笔,并利用化学平衡原理知识,解决了反应条件的选择问题。
同时,乙酸的性质又决定乙酸的用途,在性质学习之后,通过讨论了解乙酸在生活和生产的应用,体会有机物与日常生活和生产的紧密联系。
二、教学目标1.知识与技能(1)乙酸的酯化反应。
(B)(2)乙酸的用途。
(A)2.过程与方法通过实验和实验分析,体验通过观察实验—分析实验现象—得出结论的科学研究方法,了解实验操作的一些基本方法。
3.情感态度与价值观(1)通过同位素示踪原子的应用,形成科技意识。
(2)通过乙酸在生活和生产中的应用,感悟有机物与日常生活和生产的紧密联系。
三、重点和难点教学重点:乙酸的酯化反应实验和实验分析。
教学难点:乙酸的酯化反应的机理。
四、教学用品多媒体、酯化反应机理的教学课件、试管、导管、烧杯、酒精灯、乙酸、乙醇、浓硫酸、饱和Na2CO3溶液。
五、教学流程1.流程图2.流程说明1[复习提问]乙酸的酸的通性。
[实验引入] 在大试管里加入3mL乙醇、2mL冰醋酸,再缓缓加入2mL浓硫酸,边加边振荡。
在另一支试管中加入饱和碳酸钠溶液。
按课本上的装置(制乙酸乙酯的装置)组装好。
2 flash动画展示反应机理,并介绍同位素原子示踪法六、教学案例1.教学过程]酸跟醇生成酯时,部分酯发2.主要板书四、乙酸的用途3.相关链接巧记乙酸乙酯的制取实验乙醇乙酸意缱绻,催化吸水求硫酸。

优势教育学科教学目标 1.酸酯授课日期及时段乙酸一. 乙酸的组成和结构分子式:C2H4O2结构式:CHHCH OO H结构简式:CH3COOH或H3C COOH分子比例模型:乙酸的官能团是—COOH,叫做羧基。
二. 乙酸的物理性质乙酸是一种有强烈刺激性气味的无色液体,是调味品食醋的主要成分,俗称醋酸。
当温度低于16.6 ℃时,乙酸就凝结成像冰一样的晶体,所以纯净的乙酸又称冰醋酸,乙酸易溶于水和乙醇。
三. 乙酸的化学性质1.弱酸性乙酸是一种弱酸,其酸性比碳酸强,其水溶液具有酸的通性:-+33CH COOH CH COO+H(1)与酸碱指示剂作用,如可以使紫色石蕊试液变红。
(2)与碱反应,如CH3COOH+NaOH===CH3COONa+H2O。
(3)与碱性氧化物反应,如2CH3COOH+CaO===(CH3COO)2Ca+H2O。
T—课堂同步(4)与活泼金属反应,如2CH3COOH+Zn===(CH3COO)2Zn+H2↑。
(5)与某些盐反应,如2CH3COOH+CaCO3===(CH3COO)2Ca+CO2↑+H2O。
2.酯化反应:酸(包括有机羧酸和无机含氧酸)与醇作用生成酯和水的反应。
CH3COOH+CH3CH2OH 浓H2SO4△CH3COOCH2CH3+H2O酯化反应的历程是:酸脱羟基醇脱氢。
【名师点拨】①加入试剂的顺序为C2H5OH―→浓H2SO4―→CH3COOH。
②用盛饱和Na2CO3溶液的试管收集生成的乙酸乙酯,一方面中和蒸发出来的乙酸、溶解蒸发出来的乙醇;另一方面降低乙酸乙酯的溶解度,有利于酯的分离。
③导管不能插入到Na2CO3溶液中,以防止倒吸回流现象的发生。
④加热时要用小火均匀加热,防止乙醇和乙酸大量挥发、液体剧烈沸腾。
⑤装置中的长导管起导气和冷凝回流作用。
⑥充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯。
四. 羧酸1. 羧酸是由烃基与羧基相连组成的有机化合物。

乙酸乙酯教学设计化学组:贾利英(一)素质教育目标一、知识教学点1、乙酸的物理性质2、乙酸的分了组成以及结构3、酸的化学性质4、酯以及酯化反应的概念、特点以及本质。
5、酯化反应实验的装置特点以及式样操作的技术处理6、乙酸的用途二、能力训练点1、归纳思维能力通过乙酸化学性质的学习,组织学生讨论分析乙酸的官能团是族基,分析醇和羟基酸反应特点、断键方式总结成酯规律2、观察实验能力酯化反应是本节课的重要内容之一,应充分利用这个实验教材,组织引导须生观察操作的规范以及操作的顺序,装置设计特点、产物的收集装置特点、研究装置的合理性和科学性,促进观察能力的提局。
3、分析思维能力通过引导学生应用"结构,性质一用途”模式的学习以及"乙酸的化学性质一乙酸的官能团一液基的化学性质”的学习,让学生时间分析能力,另外设置知识台阶,引导学生分析,提高思维能力(如:酯化反应的实验设计)三、德育渗透点1、学习兴趣的培养,化学美育的教育通过对酯化反应的学习,操作的规范,试剂的滴加顺序的科学、严谨,反应设计的科学精巧以及吸收装置的合理性,都体现一种化学设计美,这也正是培养学生学习兴趣的好素材。
2、探索问题,创新意识的培养对于酯化反应的教学,引导学生讨论设计研究历程的方法,提出示踪原子的方法,迁移高中阶段哪些问题可以用示踪原子的研究,培养学生用于探索的科学精神。
3、本节课也要体现“本质决定现象”、“由个别到一般”的辨证唯物主义思想的渗透。
4、应通过引导学生了解日常生活中应用到的酯的常识以及苯、汽油、乙醇等有机溶剂的常识,熏陶化学与H常生活的密切关系,培养学生对生活中的化学的探索精神。
(二)学法引导1、本节教材内容较多,比较复杂,在教学中应紧紧抓住“官能团决定性质”的模式,围绕寇基的结构与性质展开学习。
2、复习初中酸的通性与辅助实验相结合的方式学习乙酸的酸性(三)实验仪器乙酸分子模型,多媒体,乙醇、冰醋酸、固体冰醋酸、醋酸溶液、石蕊、碳酸钠粉末、饱和碳酸钠溶液、浓硫酸、试管、铁架台、酒精灯、蒸馅水、烧杯、胶头滴管[复习]乙醛的氧化反应——CHjCHO 辿_> CH3COOH乙酸(板)0 IICH3COOH [展模]分子结构及特点结构式CH,-C-OH< II官能团一一c—o—H―族羟基毯基(提出毯酸)结构决定性质、先物性[展瓶+实验]归纳:二、物性:醋酸;刺味液体;冰醋酸: ”冰状固体]食醋主成份L 一易溶水、J_)乙醇(备下用)有机酸原因比H— OH强极性一相似则相溶三、、化学性质[实验]-------- ►①石蕊一酸性®Na2CO3(S) -CO2 t (回忆知识点备下用)归纳0IIV1、弱酸性比H2CO,强:CH3—c—o—H CH,COO +H+在极性H2O分了作用下,强极性断[生板]N a2CO3+2CH3COOH^ 2CH3COONa+H2O+CO2 tv[引]有无其它反应一看前面乙酸+乙醇的试管有无变化[实验]过程中一慢滴浓H2SO4 (防飞溅);小火加热(少挥发)乙醇78°C 乙酸117°C[引新点]——(上学生)饱和Na2CO3±层出现一难溶于水比水轻一一新油状物在导入方面联系了前面所学习的内容,注重了承前启后而且着重让学生参与复习在物理性质的讲解上应从以下方面入手:色、泽、嗅、味、态、密、溶、沸、熔、毒、硬、脆、延、传、导,这样可以让学生在学习物理性质的时候,明确、系统乙酸乙酯的制备实验在有机化学中是比较重要的实验,而且考点也比较多,所以在做实验的过程中,如:小火V集中加热蒸出新有机物[生闻] 1 ---------- 香味一酯2^酯化反应:0 OII A IICH3—C—0—H 十旦二~Q—CH2—CH3——> CH3—C—0—CH2—CH3 + HgO 加热以及导管的位置等等都要考虑到,在这方面做的比较好,但还应注意实验仪器的严谨性,要说明胶皮管的0 0II 18浓H2SO4 II 18CH3—c—O-H+H—18o—CH2-CH3CH3—c—18O - CH2 - CH3作用,而且在实验时让学生参与要注意保+ H2O证学生的安全[层层设问]一不用浓H2SO4? f浓H2SO4作用? f脱水方式如何f示踪18o或硫醇V以脱一OH醇脱一H定义:酯化反应:(短酸或无机含氧酸)酸与醇反应生成酯和水; [引]酯化反应都是可逆反应(上一一)r①无催无A—15年平衡(1:1)酯约66.7%;无催有△—几天:——陈酒香YC反应物过量一2:1一酯84%②如何增酯产量一平衡右移生成物移走一蒸出酯[引]蒸酯时,为何用未插入饱和Na2CO3溶液导管的装置?而不用插入饱和Na2CL溶液的装置?水为了出去乙醇②(前实验)饱和Na’C Q与乙酸反应一一除乙酸刺味小插入液面内--------- 可防倒吸酯化反应的历程是本节课的重点,所以在这里要充分挖掘,要充分调动学生的主观能动性,要学生积极配合,使学生参与反应历程的分析中,这样才会对这个反应的本质有较好的理解,所以在此,不应该由老师直接提出示踪原子而是要开发学生的思维,让他们去想,去做[投影1]小结结构一性质而官能团一COOH决定着乙酸主要性质另疮本、.。

乙酸乙酯化学位移大小判断
乙酸乙酯的化学位移大小主要取决于其所处的磁场强度和分子的电子云密度。
一般来说,当磁场强度较弱且分子电子云密度较高时,化学位移会偏小,反之化学位移会偏大。
具体来讲,乙酸乙酯中甲基(-CH3)的化学位移通常在1.2-
2.0 ppm之间,而乙酰基(-COOCH2CH3)的化学位移则在
3.7-
4.2 ppm之间。
若分子中存在其他基团或取代基,这些基
团的影响也会对化学位移大小造成一定的影响。
需要注意的是,由于不同的实验条件和仪器设置可能会对化学位移大小造成影响,因此在实际实验中需要进行准确的校准和标定,以获得可靠的数据。
此外,外界环境因素也会对乙酸乙酯化学位移大小产生一定的影响。
例如,温度、溶剂、pH值等都会对分子的结构和电子
密度产生影响,从而影响化学位移大小。
因此,对于同一分子,在不同环境条件下可能会表现出不同的化学位移大小。
最后,需要指出的是,在分析乙酸乙酯的化学位移大小时,还需要考虑具体的实验技术和仪器设置。
例如,核磁共振谱仪的型号、磁性场强度、探针等因素都可能影响化学位移的测定结果。
因此,在实验中需要根据具体情况进行相应的调整和优化,以获得准确的数据。


高二化学羧酸和酯人教实验版【本讲教育信息】一. 教学内容:羧酸和酯二. 重点、难点:1. 乙酸的结构特点和主要化学性质,乙酸乙酯的结构特点和主要化学性质是本节的重点。
2. 乙酸的酯化反应、乙酸乙酯水解反应的基本规律是本节的难点。
三. 具体内容:(一)乙酸1. 乙酸分子结构2. 乙酸物理性质3. 乙酸化学性质4. 工业制法(二)羧酸1. 概念2. 分类3. 饱和一元羧酸的物理性质4. 化学性质(三)酯1. 概念2. 分类3. 命名4. 物理性质5. 化学性质【典型例题】[例1] 用下列一种试剂就可鉴别出甲酸、乙酸、甲酸乙酯和乙酸甲酯, 该试剂是()A. 银氨溶液B. 新制Cu(OH)2悬浊液C. 硫酸钠溶液D. 氢氧化钠溶液答案:B解析:考察官能团性质的判断。
[例2] 0.1 mol阿斯匹林(结构式为)可跟足量的NaOH溶液反应,最多消耗NaOH的物质的量为()A. 0.1 molB. 0.2 molC. 0.3 molD. 0.4 mol答案:C解析:考察羧基和酯基的性质与量的关系。
[例3] 一定量的某一元羧酸完全跟乙醇反应生成分子式为C n+1H 2n+2O 2的酯74g ,等量的该羧酸与足量的NaHCO 3溶液反应可生成22.4L CO 2(标准状态下),该酸是( )A. CH 3COOHB. CH 3CH 2COOHC. CH 3CH 2CH 2COOHD. HCOOH 答案:D解析:考察甲酸在结构上的特殊性。
[例4] 一定质量的某有机物与足量钠反应,可生成气体V A L ;等质量的该有机物与足量的NaHCO 3溶液反应,可得到气体V B L 。
同温同压下V A =V B 。
则该有机物的结构简式可能是( )A. CH 3COOHB. HOOC —COOHC. HOCH 2CH 2OHD. HOCH 2COOH 答案:D解析:考察不同官能团反应的关系。
[例5] 某链烃A 有下列的转化关系:已知,D 的式量为60,它的水溶液能使石蕊试液变红,G 是高分子化合物。


乙酸乙酯化合物的结构简式1.引言1.1 概述乙酸乙酯是一种常见的有机化合物,化学式为C4H8O2,属于酯类化合物。
它是一种无色、挥发性液体,具有水果香味,常见于水果、香蕉和苹果中。
乙酸乙酯是一种重要的工业溶剂,广泛应用于涂料、胶水、油墨等领域。
乙酸乙酯的结构简式由两个乙基基团和一个乙酸基团组成。
其中,乙基基团是由两个碳原子和五个氢原子组成的基团,而乙酸基团则由一个碳原子、两个氧原子和三个氢原子组成的基团。
乙酸乙酯的结构简式可以表示为CH3COOCH2CH3。
乙酸乙酯具有许多独特的化学性质和应用。
它是一种极性溶剂,能够溶解许多有机物,因此常用于油墨和涂料中作为稀释剂和溶剂。
此外,乙酸乙酯还可以用作制药、香料和食品添加剂的中间体。
在本文中,我们将深入研究乙酸乙酯的定义、特性以及化学结构。
通过对其结构简式的解析,我们可以更好地理解乙酸乙酯在不同领域中的应用。
最后,我们将总结乙酸乙酯的结构简式,并展望其未来的应用前景。
文章结构部分的内容可以如下编写:1.2 文章结构本文将分为以下几个部分来讨论乙酸乙酯化合物的结构简式:2.1 乙酸乙酯的定义和特性在这一部分,我们将介绍乙酸乙酯的定义、化学式和命名,并讨论它的物理性质和化学性质。
我们将探讨乙酸乙酯在常温下的状态、溶解性以及其他相关特征,以便更好地了解这种化合物。
2.2 乙酸乙酯的化学结构在这一部分,我们将详细讨论乙酸乙酯的化学结构。
首先,我们将介绍它的分子式,并解释每个原子和它们之间的键结构。
我们还将探讨乙酸乙酯分子中的官能团和它们的作用。
通过深入了解乙酸乙酯的化学结构,我们可以更好地理解它的物化性质和反应特性。
3.结论在这一部分,我们将总结乙酸乙酯的结构简式,并强调它在化学和工业领域的应用。
我们还将展望乙酸乙酯在未来的发展前景,并探讨可能的研究方向和应用领域。
通过对乙酸乙酯的结构和应用进行综合性的总结,我们可以更好地认识到它在化学领域中的重要性和潜力。
通过以上结构,本文将全面而系统地介绍乙酸乙酯化合物的结构简式,帮助读者更好地理解和应用该化合物。
乙烯乙醇乙醛乙酸乙酸乙酯关系详解乙烯乙醇、乙醛、乙酸和乙酸乙酯都是有机化合物,它们在化学结构上有一定的相似性,同时也存在一定的关系。
本文将从化学结构、性质、合成方法和应用等方面对这些化合物进行详细解析。
1. 乙烯乙醇(Ethylene Glycol)乙烯乙醇,化学式为C2H6O2,是一种无色、无臭的液体。
它在常温常压下呈现为粘稠的液体,具有良好的溶解性,可溶于水和许多有机溶剂。
1.1 化学结构乙烯乙醇的化学结构中含有两个羟基(-OH),它们分别连接在乙烯基(-CH2CH2-)的两个碳原子上。
化学结构示意图:HO-CH2-CH2-OH1.2 性质乙烯乙醇具有以下性质:•密度较大,沸点高,熔点低;•可与水混溶,与许多有机溶剂(如醇类、醚类)都有良好的溶解性;•具有良好的降低冰点和抑制腐蚀的性质,常用作防冻剂和制冷剂;•在化工领域中,乙烯乙醇可用于合成聚酯、聚醚等高分子化合物。
1.3 合成方法乙烯乙醇的主要合成方法有以下两种:•从乙烯氧化制得:乙烯与空气在催化剂的作用下发生氧化反应,生成乙烯乙醇。
•从乙二醇脱水合成:乙二醇在催化剂的作用下发生脱水反应,生成乙烯乙醇。
1.4 应用乙烯乙醇在工业上有广泛的应用,主要包括以下几个方面:•制造聚酯纤维和塑料等合成材料;•作为溶剂用于油漆、涂料、油墨等工业领域;•用作制冷剂和防冻剂;•用于制备聚醚、聚氨酯等高分子材料。
2. 乙醛(Acetaldehyde)乙醛,化学式为C2H4O,是一种具有刺激性气味的无色液体。
它具有较快的挥发性,可溶于水和许多有机溶剂。
2.1 化学结构乙醛的化学结构中含有一个羰基(C=O),它连接在乙基(-CH3)的碳原子上。
化学结构示意图:CH3CHO2.2 性质乙醛具有以下性质:•密度较小,沸点较低,熔点较高;•与水和大多数有机溶剂都能混溶;•具有刺激性气味,对皮肤和黏膜有刺激作用;•可发生氧化反应,生成醋酸。
2.3 合成方法乙醛的主要合成方法有以下几种:•乙烯氧化制得:乙烯在催化剂的作用下与氧气发生反应,生成乙醛。
乙酸和乙醇反应的化学反应方程式乙酸和乙醇反应的化学反应方程式,指的是乙酸与乙醇通过酯化
反应生成乙酸乙酯的化学过程。
乙酸乙酯是有机化学中常见的一种酯
类化合物,具有香气和挥发性,广泛应用于香料、溶剂、胶水等领域。
酯化反应是一种酸催化的反应。
乙酸能够提供酸性催化剂,促进
乙醇和乙酸反应。
在反应中,乙醇中的羟基(-OH)与乙酸中的羧基
(-COOH)发生酯化反应,形成乙酸乙酯(CH3COOCH2CH3)和水
(H2O)。
化学反应方程式如下:
CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O
在这个反应中,化学式CH3COOH代表乙酸,化学式CH3CH2OH代表
乙醇,化学式CH3COOCH2CH3代表乙酸乙酯。
这个化学方程式描述了乙酸和乙醇酯化反应的整个过程。
在该过
程中,乙酸分子中的一个羧基与乙醇分子中的一个羟基反应,形成一
个酯键,同时释放一个水分子。
在该反应中,酸促进反应,使反应更快、更彻底。
酯化反应是有机化学中常见的反应,也被广泛应用于产生各种不同的酯分子。
此外,乙酸乙酯还可以通过加氢、酸解和酮化等方法转化为其他有机分子,因而具有重要的工业和科学意义。
总之,乙酸和乙醇反应的化学反应方程式是CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O。
这个方程式描述了酯化反应的整个过程,也是有机化学重要的反应类型之一。
高中化学乙酸乙酯教案【篇一:高中化学乙酸乙酯的制取实验设计】高中化学乙酸乙酯的制取实验设计乙酸乙酯的制取实验是有机化学中最重要的实验之一。
在各类试题中乙酸乙酯的制取实验经常被考查到,近几年的高考题中也出现了它的“身影”。
该实验很典型,它比较全面地、具体地体现了有机实验的各种特点。
因此,我们需要对乙酸乙酯的制取实验进行全面、具体地分析,总结出其中的特点,归纳该实验中的要点。
这样我们才能更加深刻地理解、掌握住该实验。
现将该实验的特点作如下总结(观察实验装置图):1、配制乙醇、浓h2so4、乙酸的混合液时,各试剂加入试管的次序是:先乙醇,再浓h2so4,最后加乙酸。
在将浓硫酸加入乙醇中的时候,为了防止混合时产生的热量导致液体迸溅,应当边加边振荡。
当乙醇和浓硫酸的混合液冷却后再加入乙酸,这是为了防止乙酸的挥发而造成浪费。
2、此反应(酯化反应)是可逆反应,应当使用“ ”。
酯化反应是指“酸和醇起反应,生成酯和水的反应”。
发生酯化反应的时候,一般是羧酸分子里的羟基和醇分子里的羟基氢原子一起脱去,结合形成水,其余部分结合形成了酯(酯化反应属于取代反应)。
3、由于此反应是可逆反应,为了提高乙酸乙酯的产率,需要适当增大廉价原料乙醇的用量使反应尽可能生成乙酸乙酯,同时也可以提高成本较高的乙酸的转化率。
故实验中需要使用过量的乙醇。
4、浓硫酸的作用是:催化剂、吸水剂。
注意:酯化反应需要用浓硫酸,而酯的水解反应需要用稀硫酸。
5、实验加热前应在反应的混合物中加入碎瓷片,以防止加热过程中发生暴沸。
6、试管b中盛装的饱和na2co3溶液的作用是:中和乙酸(混于乙酸乙酯中的乙酸和na2co3反应而被除去),溶解乙醇,降低乙酸乙酯的溶解度,有利于溶液分层,析出乙酸乙酯。
同时还可以冷却乙酸乙酯,减少乙酸乙酯的挥发。
注意:饱和na2co3溶液不能用naoh溶液代替,因为naoh溶液的碱性太强,会使乙酸乙酯发生水解反应而重新变成乙酸和乙醇。