一氧化碳的物理和化学性质
- 格式:ppt
- 大小:1.49 MB
- 文档页数:32

一氧化碳和二氧化碳的区分方法一氧化碳(CO)和二氧化碳(CO2)是两种常见的气体,在化学性质、物理性质和用途上有很大的不同。
下面将从不同角度来介绍一氧化碳和二氧化碳的区分方法。
一、化学性质1.反应性:一氧化碳是一种具有很高反应性的气体,容易与氧气、氯气和其他氧化剂发生反应。
二氧化碳比较稳定,不容易与其他物质发生反应。
2.反应产物:一氧化碳在氧气存在下燃烧时,生成二氧化碳;而二氧化碳不容易参与其他化学反应,主要以稳定的形式存在。
3.酸碱性:二氧化碳具有酸性,可溶于水形成碳酸(H2CO3),而一氧化碳无酸碱性。
4.毒性:一氧化碳是一种无色、无味、无刺激性的气体,具有很高的毒性,可与血红蛋白结合影响血液中氧气的运输和供应;二氧化碳的毒性相对较低,大量吸入可引起窒息。
二、物理性质1.密度:一氧化碳的密度比空气小,约为0.967 g/L,而二氧化碳的密度比空气大,约为1.977 g/L。
2.溶解度:一氧化碳在水中的溶解度较高,与水有很强的亲和力,可以溶解的比例达到0.02 mol/L;而二氧化碳的溶解度相对较低,与水的亲和力较弱,可以溶解的比例达到0.033 mol/L。
3.融点和沸点:一氧化碳的融点为-207 °C,沸点为-191.5 °C;二氧化碳的融点为-78.5 °C,沸点为-56.6 °C。
4.颜色:一氧化碳是无色气体;二氧化碳是无色气体,在高浓度下会显示为白色。
三、检测和测试方法1.使用可燃气体检测仪:可燃气体检测仪可以检测一氧化碳的浓度,一氧化碳浓度高于一定值时,可燃气体检测仪会发出警报。
2.使用红外线检测仪:红外线检测仪可以检测一氧化碳和二氧化碳的浓度,根据红外线的吸收特性来进行浓度检测。
3.使用pH试纸:将气体溶解在水中,水的pH值会发生变化,一氧化碳溶解后会生成一定量的酸,降低水的pH值。
4.使用化学试剂:一氧化碳在空气中可与氯水或碘钾溶液反应生成氯化物或碘化物沉淀,而二氧化碳不参与这些反应。

一氧化碳的相关知识一氧化碳的性质:一氧化碳的物理性质在通常状况下,一氧化碳是无色、无臭、无味、有毒的气体,熔点—199℃,沸点—191.5℃。
标准状况下气体密度为l.25g/L,和空气密度(标准状况下1.293g/L相差很小,这也是容易发生煤气中毒的因素之一。
它为中性气体一氧化碳的化学性质一氧化碳分子中碳元素的化合价是十2,能进一步被氧比成+4价,从而使一氧化碳具有可燃性和还原性,一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:2CO+O22CO2燃烧时发出蓝色的火焰,放出大量的热。
因此一氧化碳可以作为气体燃料。
一氧化碳作为还原剂,高温时能将许多金属氧化物还原成金属单质,因此常用于金属的冶炼。
如:将黑色的氧化铜还原成红色的金属铜,将氧化锌还原成金属锌:一氧化碳还有一个重要性质:在加热和加压的条件下,它能和一些金属单质发生反应,主成分子化合物。
如Ni(CO)4(四羰基镍)、Fe(CO)5(五羰基铁)等,这些物质都不稳定,加热时立即分解成相应的金属和一氧化碳,这是提纯金属和制得纯一氧化碳的方法之一。
一氧化碳的的用途:一氧化碳作为还原剂,高温时能将许多金属氧化物还原成金属单质,因此常用于金属的冶炼。
如:将黑色的氧化铜还原成红色的金属铜,将氧化锌还原成金属锌:一氧化碳(co)是一种对血液,与神经系统毒性很强的污染物.,空气中的一氧化碳(co),通过呼吸系统,进入人体血液内,与血液中的血红蛋白(hemoglobin,hb)。
肌肉中的肌红蛋白。
含二价铁的呼吸酶结合,形成可逆性的结合物。
一氧化碳与血红蛋白的结合,不仅降低血球携带氧的能力,而且还抑制,延缓氧血红蛋白(o2hb)的解析与释放,导致机体组织因缺氧而坏死,严重者则可能危及人的生命。
正常情况下,经过呼吸系统进入血液的氧,将与血红蛋白(hb)结合,形成氧血红蛋白(o2hb)被输送到机体的各个器官与组织,参与正常的新陈代谢活动。
比如果空气中的一氧化碳浓度过高,很多的一氧化碳将进入机体血液。



一氧化碳的理化性质及危险特性一氧化碳(CO)是一种无色无味的气体,具有一些重要的理化性质和危险特性。
本文将介绍一氧化碳的理化性质以及其对人类和环境的危害。
理化性质1. 溶解性一氧化碳是一个高度可溶于许多常见溶剂的气体。
它可以溶解在水中,并在一定温度和压力下形成一氧化碳溶液。
2. 熔点和沸点一氧化碳的熔点为-205.02摄氏度,沸点为-191.5摄氏度。
它在常温下是气态的,只有在极低的温度下才能转变为液态或固态。
3. 密度一氧化碳的密度比空气轻,约为空气的0.97倍。
这意味着一氧化碳可以在空气中向上升起,并形成容易扩散的气体。
4. 许可爆炸浓度一氧化碳的许可爆炸浓度范围广,通常在12%至75%之间。
在这个浓度范围内,一氧化碳可以与空气形成可燃混合物,当达到爆炸极限时,可能引发爆炸。
危险特性1. 毒性一氧化碳是一种强毒性气体。
当人体呼吸进入一氧化碳后,它会与血液中的血红蛋白结合,形成一氧化碳血红蛋白,导致血液中氧气供应不足。
这可能导致中毒症状,包括头晕、头痛、恶心、呕吐、昏迷甚至死亡。
2. 难以察觉一氧化碳无色无味,难以察觉。
人们在没有适当的监测设备的情况下,很难察觉到一氧化碳的存在,增加了中毒的风险。
3. 爆炸危险当一氧化碳与空气形成可燃混合物并达到爆炸极限时,可能引发爆炸。
这对于或封闭空间中积聚的一氧化碳特别危险。
4. 环境影响一氧化碳是一种温室气体,在大气中的存在对气候变化产生负面影响。
它还可以与其他化学物质反应,产生有害的气体,对环境造成污染。
结论一氧化碳是一种具有高毒性和危险特性的气体。
了解和认识一氧化碳的理化性质以及对人类和环境的危害,有助于我们采取必要的安全措施,预防和减少一氧化碳的相关风险。

一氧化碳的性质学前预热在日常生活中,每日吸烟一包,可使血液碳氧血红蛋白(COHb)浓度升至5%~6%。
在吸烟环境中生活8h,相当于吸5支香烟。
煤炉产生的气体中CO含量可高达6%~30%。
室内门窗紧闭,火炉无烟囱,或烟囱堵塞、漏气、倒风以及在通风不良的浴室内使用燃气加热器淋浴都可发生CO中毒。
失火现场空气中CO浓度可高达10%、也可发生中毒。
知识框架物理性质:难溶于水,密度比空气略小,无色无味一氧化碳的性质可燃性:22(点燃前要验纯)化学性质还原氧化铜还原性(注意操作顺序和尾气处理)还原氧化铁毒性:极易与血红蛋白结合,使人缺氧死亡用途:燃料,冶炼金属知识点一一氧化碳的性质1.一氧化碳的物理性质无色、无味的气体,密度比空气略小,难溶于水,常温时比较稳定。
2.一氧化碳的化学性质1.可燃性:2CO+O2点燃2CO2一氧化碳是煤气的主要成分,燃烧产生蓝色火焰,并放出热量,将一个内壁涂有澄清石灰水的烧杯罩在火焰上方,发现石灰水变浑浊,证明有二氧化碳生成,这是检验一氧化碳的方法。
点燃一氧化碳前也要验纯,否则容易爆炸。
2.还原性(可用来炼铁):CuO+CO△Cu+CO2;Fe2O3+3CO高温2Fe+3CO2【注意】加热前先通CO排空气,防止CO不纯时,加热发生爆炸。
实验完毕后先停止加热后停止通CO,防止得到的铜被氧化。
因CO有剧毒,上述两项操作中多余的CO Array3.(1)(2)(3)(4)象的是二氧化碳。
例题精讲【例1】(★)“吸烟有害健康”,我国政府规定:从2011年5月1日起,公共室内禁止吸烟.烟草燃烧释放的物质中,能与血红蛋白结合引起中毒的是()A、一氧化碳B、二氧化碳C、尼古丁D、焦油【考点】一氧化碳的用途【解析】其他均不能与血红蛋白结合。
【答案】A【例2】(★★)5月31日是世界卫生组织发起的“世界无烟日”,今年的宣传口号是“烟草吞噬生命”.据科学资料分析,烟草燃烧产生的烟雾中含有数十种严重有害的物质,如尼古丁(化学式为C10H14N2)、一氧化碳等.下列说法正确的是()A、一氧化碳能与血液中的血红蛋白结合,使人体缺氧B、尼古丁中碳、氢、氮元素的质量比为10:14:2C、吸烟只影响自己的健康,不影响他人的健康D、边吸烟边喝酒可以减少对健康的损害【考点】碳及其氧化物的性质【解析】B是原子个数比不是质量比;吸二手烟同样危害人的身体健康;D是错误的。

一氧化碳的性质
一氧化碳的物理性质:没有颜色、没有气味、通常状态下为气体,密度与空气接近。
化学性质:可以燃烧生成二氧化碳,有可燃性;可以与铁的氧化物反应,生成铁和二氧化碳,有还原性;有剧毒性。
扩展资料
一氧化碳理化性质
物理性质
在通常状况下,一氧化碳是无色、无臭、无味、难溶于水的中性气体,熔点-205.1℃,沸点-191.5℃。
标准状况下气体密度为1.25g/L,和空气密度(标准状况下1.293g/L)相差很小,这也是容易发生煤气中毒的`因素之一。
化学性质
化学性质有:可燃性、还原性、毒性、极弱的氧化性。
一氧化碳分子中碳元素的化合价是+2,能进一步被氧化成+4价,从而使一氧化碳具有可燃性和还原性,一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳。

一氧化碳的三条化学性质
一氧化碳的化学式是co。
化学式量为28.,标准状况下为无色、无臭、无刺激性的气体。
一氧化碳是一种易燃易爆气体。
与空气混合能形成爆炸性混合物,遇明火、高温能引
起燃烧爆炸。
一氧化碳是一种碳氧化合物。
一氧化碳分子为极性分子,但由于存在反馈π键,分
子的极性很弱。
分子形状为直线形。
碳的最外层有四个电子,氧的最外层有6个电子,这
样碳的两个单电子进入到氧的p轨道和氧的两个单电子配对成键,这样就形成两个键,然
后氧的孤电子对进入到碳的空的p轨道中形成一个配位键,这样氧和碳之间就形成了三个键。
在化学性质方面,一氧化碳的熔点为-.1℃,沸点为-.5℃,微溶水,难于液化和切割,在空气中冷却时为蓝色火焰,较低温度时水解产生二氧化碳和碳,在血液中极容易与血红
蛋白融合,构成碳氧血红蛋白,并使血红蛋白失去灌流的能力和促进作用,导致非政府窒
息而死,轻微时丧生。
一氧化碳是大气中分布最广和数量最多的污染物,也是燃烧过程中生成的重要污染物
之一。

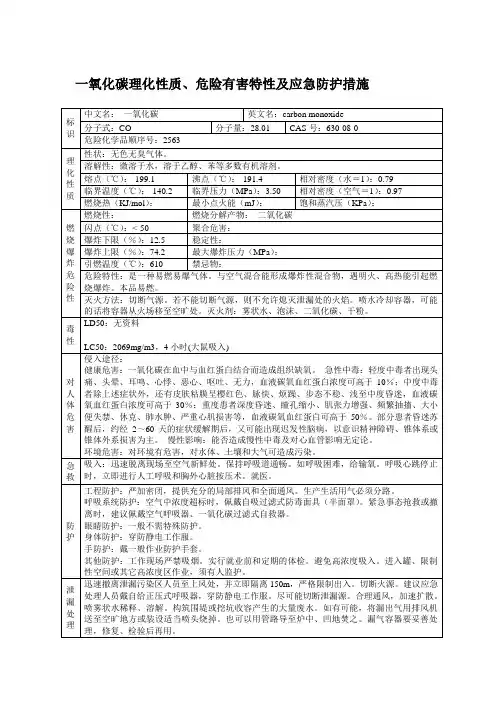
一氧化碳的理化性质及危险特性表
理化性质
- 化学式:CO
- 分子量:28.01 g/mol
- 外观和物理状态:无色无味的气体
- 熔点:-205 °C
- 沸点:-191.5 °C
- 密度:1.250 g/L
- 可溶性:低溶解性于水
危险特性
- 一氧化碳是一种无色无味的气体,它具有以下危险特性:
- 毒性:一氧化碳是一种强大的血液中毒物质,它与血红蛋白结合,阻止氧气的传递到身体的组织和器官中,导致缺氧和中毒症状。
- 易燃性:一氧化碳是易燃气体,与空气形成可燃混合物,可在遇到明火或高热源时发生爆炸。
- 爆炸性:一氧化碳与空气的爆炸限是12.5% - 74%。
在高浓度下,一氧化碳可以引发爆炸。
- 非可见性:一氧化碳无色无味,在环境中很难察觉。
安全措施
- 预防:为了避免一氧化碳的积聚和暴露,应采取以下预防措施:
- 定期检查和维护燃气设备,包括燃气炉、热水器和锅炉。
- 安装一氧化碳探测器,特别是在睡眠区域和燃气设备附近。
- 不在室内使用燃气或煤炭烧烤设备。
- 应急响应:如果发生一氧化碳泄露或中毒,应采取以下措施:- 立即离开泄露源,并通知相关部门。
- 寻求新鲜空气,并在急救人员到达前提供急救。
- 避免直接接触或呼吸一氧化碳。
- 后果管理:如若不慎暴露于一氧化碳,应咨询医生,因为一
氧化碳中毒可能导致严重的健康问题,甚至死亡。
以上信息仅供参考,具体数据请参阅可靠资源或咨询相关专业
人员。

初中化学一氧化碳和二氧化碳知识点总结知识点总结本节包括空气的组成及各成分的用途、空气中氧气百分含量测定实验、空气污染及其防治几个知识点。
知识的特点是容易理解,但需要记忆的东西较多,因此记住这些知识是学好本节的关键。
本节包括知识点较多,知识的容量大,但大都容易理解,学习这部分知识时要注意:基础知识的记忆、化学性质的理解、树立结构决定性质、性质决定用途的观念。
1、一氧化碳的物理性质:(1)通常状况下,一氧化碳是一种无色无味的气体。
(2)标准状况下,一氧化碳的密度比空气略小(注:不能用排空气法收集,因密度大小与空气的太接近)。
(3)一氧化碳难溶于水,可用排水法收集co。
2、一氧化碳的化学性质:3、一氧化碳的用途:(1)co具有可燃性可作气体燃料。
(2)co具有还原性,可用于冶金工业。
4、二氧化碳的物理性质:(1)通常状况下,二氧化碳是一种无色无味的气体。
(2)标准状况下,二氧化碳的密度为1.977g/l,比空气大。
(3)二氧化碳能溶于水,1体积水中能溶解1体积的二氧化碳气体。
(4)三态变化:固态co2又叫干冰。
5、二氧化碳的化学性质:(1)二氧化碳既不能燃烧,也不支持燃烧,因而它具有灭火功能(也与二氧化碳的密度大有关)。
实验室里常利用此性质来检验集气瓶里是否集满二氧化碳。
(2)co2与水反应生成碳酸。
碳酸能使紫色石蕊试液变成红色。
co2+h2o=h2co3(紫变红)但碳酸很不稳定,容易分解生成二氧化碳和水,所以实验室里不储备碳酸。
h2co3=h2o+co2↑(红变紫)6、二氧化碳的检验方法:co2与石灰水反应生成白色的碳酸钙沉淀。
常利用此性质,来检验二氧化碳气体。
co2+ca(oh)2=caco3↓+h2o(清变浊)7、二氧化碳的用途:(1)气体二氧化碳可用于灭火、制汽水、作气体肥料、化工产品的原料等。
(2)固态二氧化碳又叫干冰,可用作①制冷剂,②形成人工云雾(舞台上),③人工降雨8、温室效应的危害及二氧化碳的来源(1)温室效应形成的主要原因:随着工农业生产的发展和人类生活水平的提高,煤、石油、天然气等化石燃料的需求不断增大,它们燃烧后放出大量的二氧化碳等温室气体;而由于一些天灾和乱砍滥伐,能吸收二氧化碳的大片森林和草原绿地却在不断消失,从而导致碳氧循环不平衡,致使大气中二氧化碳等温室气体增多,地球表面温度上升。
一氧化碳(carbon monoxide, CO)纯品为无色、无臭、无刺激性的气体。
在水中的溶解度甚低,但易溶于氨水。
一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。
因此一氧化碳具有毒性。
常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
中文名:一氧化碳英文名:carbon monoxide化学式:CO CAS号:630-08-0RTECS:FG3500000 摩尔质量:28.01g·mol?1外观:无色无臭气体密度:相对密度(水=1)0.79熔点:-199.1℃沸点:-191.4℃溶解度(水):0.0026 g/100 mL (20 °C) 偶极矩:0.112 D (3.74×10?31 C·m)警示术语:R:12-23-33-48-61 安全术语:S:9-16-33-45-53主要危害:一氧化碳在血中与血红蛋白结合而造成组织缺氧。
闪点:-50℃一氧化碳- 物理性质一氧化碳分子模型外观与性状:无色、无嗅、无味的气体。
蒸气压(kPa):309kPa/-180℃溶解性:在水中的溶解度低,但易被氨水吸收。
禁配物:强氧化剂、碱类。
分解产物:400~700℃间分解为碳和二氧化碳。
危险特性:是一种易燃易爆气体。
与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸;与空气混物爆炸限12%~75%。
其他物理特性:自燃点608.89℃。
一氧化碳- 化学性质一氧化碳探测仪一氧化碳分子中碳元素的化合价是十2,能进一步被氧比成+4价,从而使一氧化碳具有可燃性和还原性,一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:2CO +O2=点燃=2CO2燃烧时发出蓝色的火焰,放出大量的热。
因此一氧化碳可以作为气体燃料。
一氧化碳作为还原剂,高温时能将许多金属氧化物还原成金属单质,因此常用于金属的冶炼。
一氧化碳结构简式一氧化碳(CO)是一种由碳和氧元素组成的化合物,是一种简单的二元化合物。
它由一个碳原子和一个氧原子组成,分子式为CO。
一氧化碳在自然界中非常常见,可以通过燃烧碳质物质、发动机排放、工业生产等途径产生。
在环境中,一氧化碳是一种有毒气体,对人类和动植物都具有危害。
一氧化碳分子的结构非常简单,它由一个碳原子和一个氧原子共价键结合而成。
碳原子与氧原子之间的共价键是由一个碳原子提供一个价电子,氧原子提供两个价电子,形成的共价键非常紧密。
一氧化碳的分子结构如此简单,但是其物理性质和化学性质却非常特殊,具有重要的应用价值和科学研究意义。
一氧化碳的分子结构决定了它一些特殊的物理性质。
一氧化碳是一种无色、无味、无臭的气体,非常难以察觉。
由于其分子结构紧凑,一氧化碳具有高度的不活化性,不易与其他物质发生化学反应,这使得一氧化碳在一些特殊的工业生产过程中具有特殊的用途。
与此一氧化碳的分子结构也使得它具有一定的挥发性,可以迅速散布到空气中。
在化学性质方面,一氧化碳的分子结构也决定了其具有一些特殊的特性。
一氧化碳对许多金属具有良好的络合性能,可以形成稳定的金属配合物,因此在金属冶炼、工业催化等方面具有重要应用。
一氧化碳还是许多重要化合物的合成原料,例如甲醛、甲烷等。
由于一氧化碳分子结构中碳原子和氧原子的特殊排列方式,使得一氧化碳在某些有机合成反应中具有独特的反应性和选择性。
一氧化碳的分子结构虽然非常简单,但是其物理性质和化学性质却非常特殊,具有广泛的应用价值和科学研究意义。
对于一氧化碳分子结构的深入研究,不仅可以揭示其特殊的性质,还可以为相关领域的应用开发提供重要的理论基础。
一氧化碳密度
一氧化碳密度在一个标准大气压下密度为1.25kg/m3,空气为
1.29kg/m3,所以一氧化碳密度略小于空气。
一氧化碳,一种碳氧化合物,化学式为CO,化学式量为28.0101,通常状况下为是无色、无臭、无味的气体。
物理性质上,一氧化碳的熔点为-205℃,沸点为-191.5℃,难溶于水(20℃时在水中的溶解度为0.002838g),不易液化和固化。
化学性质上,一氧化碳既有还原性,又有氧化性,能发生氧化反应(燃烧反应)、歧化反应等;同时具有毒性,较高浓度时能使人出现不同程度中毒症状,危害人体的脑、心、肝、肾、肺及其他组织,甚至电击样死亡,人吸入最低致死浓度为5000ppm(5分钟)。
工业上,一氧化碳是一碳化学的基础,可由焦炭氧气法等方法制得,主要用于生产甲醇和光气以及有机合成等。
1。