大学物理之热学公式篇
- 格式:doc
- 大小:342.50 KB
- 文档页数:4

大学物理中的热力学热能的转化与热力学定律热力学是物理学中研究热能转化与热力学定律的一个重要分支。
热力学研究了热能与其他形式能量之间的转化关系,从而揭示了物质中热现象的本质规律和特性。
在大学物理学习中,了解热力学的基本原理对于理解能量转化和自然界中的热现象非常重要。
一、能量与热力学能量是物质存在时的基本属性,包括热能、机械能、化学能等形式。
热能指的是物质内部由分子振动和相对运动带来的能量。
热力学研究如何将热能转化为其他形式的能量,以及如何实现能量守恒。
二、热力学系统与热力学定律热力学中的系统指的是由一定数量物质和能量组成的系统,可以是封闭的、开放的或孤立的。
热力学定律是通过观察和研究系统中能量的转化和物质的变化得出的。
其中最重要的三条热力学定律分别是热力学第一定律、第二定律和第三定律。
三、热力学第一定律——能量守恒定律热力学第一定律表明能量在一个系统中是守恒的,能量可以转化为其他形式,但总量不变。
这意味着系统所吸收的热量与所做的功等于内能的变化。
即,ΔU = Q - W其中,ΔU表示内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
四、热力学第二定律——熵增定律热力学第二定律是关于能量转化方向的定律。
它指出,孤立系统的熵增总是大于等于零,且在实际过程中熵增不会减小。
熵是描述能量分子混乱程度的物理量,熵增表示能量分子无序性的增加。
五、热力学第三定律——绝对零度定律热力学第三定律说明了在绝对零度下,系统的熵为零。
绝对零度是热力学温标的零点,相对于绝对零度,系统的热能全部被完全冻结,内能最小。
六、热力学中的热能转化在热力学中,热能可以通过热传导、热辐射和热对流等过程转化为其他形式的能量。
热传导是指通过物质内部的分子间碰撞,热能从高温区向低温区传递。
热辐射是指物质表面的热能通过辐射传递。
热对流是指通过液体或气体的传流而进行的热能转移过程。
七、热力学的应用热力学的研究在能源转换、工程设计、气候变化、环境保护等方面都有重要应用。

热 学 公 式1.理想气体温标定义:0273.16limTP p TPpT K p →=⋅(定体) 2.摄氏温度t 与热力学温度T 之间的关系:0//273.15t C T K =- 华氏温度F t 与摄氏温度t 之间的关系:9325F t t =+ 3.理想气体状态方程:pV RT ν=1mol 范德瓦耳斯气体状态方程:2()()m m ap V b RT V +-= 其中摩尔气体常量8.31/R J mol K =⋅或28.2110/R atm L mol K -=⨯⋅⋅4.微观量与宏观量的关系:p nkT =,23kt p n ε=,32kt kT ε= 5.标准状况下气体分子的数密度(洛施密特数)2530 2.6910/n m =⨯6.分子力的伦纳德-琼斯势:126()4[()()]p E r rrσσε=-,其中ε为势阱深度,σ=,特别适用于惰性气体,该分子力大致对应于昂内斯气体; 分子力的弱引力刚性球模型(苏则朗模型):06000, ()(), p r r E r r r r rφ+∞<⎧⎪=⎨-≥⎪⎩,其中0φ 为势阱深度,该分子力对应于范德瓦耳斯气体。
7.均匀重力场中等温大气分子的数密度(压强)按高度分布:00()mgz Mgz kTRTn z n en e --==,//00()mgz kTMgz RT p z p e p e --==, 大气标高:RTH Mg=。
8.麦克斯韦速率分布函数:23/222()4()2mv kTdN m f v e v Ndv kT ππ-==;其简便形式:22()u f u du e du -=,其中p v u v =。
9.三个分子速率的统计平均值:最概然速率:p v ==平均速率:v ==;方均根速率:rms v === 10.分子通量14nv Γ=:单位时间内,单位面积容器壁所受到的分子碰撞次数。
12.能量均分定理:在温度为T 的平衡态下,物质分子的每一个自由度都具有相同的平均动能,其大小都等于/2kT 。

第三章 热力学第二定律1. 卡诺定理卡诺热机效率hc h c h 11T T Q Q Q W−=+=−=η 卡诺定理:工作于高温热源T h 与低温热源T c 之间的热机,可逆热机效率最大。
卡诺定理推论:所有工作于高温热源T h 与低温热源T c 之间的可逆热机,其热机效率都相等,与热机的工作物质无关。
卡诺循环中,热温商之和等于零0cch h =+T Q T Q 任意可逆循环热温商之和也等于零,即0R=⎟⎟⎠⎞⎜⎜⎝⎛∑i iiT Q 或 0δR =⎟⎠⎞⎜⎝⎛∫T Q 2. 热力学第二定律的经典表述克劳休斯说法:不可能把热由低温物体传到高温物体, 而不引起其他变化。
开尔文说法:不可能从单一热源吸热使之完全转化为功, 而不发生其他变化。
热力学第二定律的各种说法的实质:断定一切实际过程都是不可逆的。
各种经典表述法是等价的。
3. 熵的定义TQ S revδd =或∫=ΔB ArevδTQ S熵是广度性质,其单位为。
系统状态变化时,要用可逆过程的热温商来衡量熵的变化值。
1K J −⋅4. 克劳修斯不等式T QS δd irrev ≥ 或 ∫≥ΔB A ir rev δT Q S 等号表示可逆,此时环境的温度T 等于系统的温度,为可逆过程中的热量;不等号表示不可逆,此时T 为环境的温度,为不可逆过程中的热量。
Q δQ δ5. 熵增原理0)d (irrev≥绝热S 或0)(irrev≥Δ绝热S 等号表示绝热可逆过程,不等号表示绝热不可逆过程。
在绝热条件下,不可能发生熵减少的过程。
0)d (irrev≥孤立S 或0)(irrev≥Δ孤立S 等号表示可逆过程或达到平衡态,不等号表示自发不可逆过程。
可以将与系统密切相关的环境部分包括在一起,作为一个隔离系统,则有:0irrev sur sys iso ≥Δ+Δ=ΔS S S6. 熵变计算的主要公式计算熵变的基本公式: ∫∫∫−=+=δ=−=Δ2 12 12 1rev12d d d d TpV H T V p UTQ S S S 上式适用于封闭系统,一切非体积功过程。

第四章 电 场一、常见带电体的场强、电势分布2)均匀带电球面(球面半径 )的电场:3)无限长均匀带电直线(电荷线密度为): E = ,方向:垂直于带电直线。
2r( rR ) 4)无限长均匀带电圆柱面(电荷线密度为):E =2r (rR )5)无限大均匀带电平面(电荷面密度为)的电场: E =/20 ,方向:垂直于平面。
二、静电场定理 1、高斯定理:e = ÑE v dS v = q 静电场是有源场。
Sq 指高斯面内所包含电量的代数和;E 指高斯面上各处的电场强度,由高斯面内外的全 部电荷产生; Ñ E vdS v 指通过高斯面的电通量,由高斯面内的电荷决定。
2、环路定理: Ñ E v dl v =0 静电场是保守场、电场力是保守力,可引入电势能三、求场强两种方法1、利用场强势叠加原理求场强 分离电荷系统: E v = E v i ;连续电荷系统: E v = dE v i =12、利用高斯定理求场强 四、求电势的两种方法n1、利用电势叠加原理求电势 分离电荷系统:U =U i ;连续电荷系统: U = dU i =1电势零点v v 2、利用电势的定义求电势 U =电势零点Edl五、应用vv b点电荷受力: F = qE电势差: U ab =U a -U b = b EdraE =1 qU =q4r 24r1)点电荷:E =0 (rR ) q2 (rR ) 4r 2U =q (r R ) 4r q (r R ) 4Ra 点电势能:W a = qU a由 a 到 b 电场力做功等于电势能增量的负值 A ab = -W = -(W b -W a )六、导体周围的电场1、静电平衡的充要条件: 1)、导体内的合场强为 0,导体是一个等势体。
2)、导体表面的场强处处垂直于导体表面。
E v ⊥表面。
导体表面是等势面。
2、静电平衡时导体上电荷分布: 1)实心导体: 净电荷都分布在导体外表面上。

大学热学物理知识点总结1.热力学基本定律热力学基本定律是热学物理的基础,它包括三个基本定律,分别是热力学第一定律、热力学第二定律和热力学第三定律。
(1)热力学第一定律热力学第一定律是能量守恒定律的热学表述,它规定了热力学系统能量的守恒性质。
简单地说,热力学第一定律表明了热力学系统能量的增减只与系统对外界做功和与外界热交换有关。
热力学第一定律的数学表达式为ΔU=Q-W,其中ΔU表示系统内能的增量,Q表示系统吸热的大小,W表示系统对外界所作的功。
由此可以看出,系统的内能变化量等于吸收热量减去做的功。
(2)热力学第二定律热力学第二定律是热力学系统不可逆性的表述,它规定了热力学系统内部的熵增原理,即系统的熵不会减小,而只会增加或保持不变。
简单地说,热力学第二定律表明了热力学系统内部的任何一种热力学过程都是不可逆的。
这意味着热力学系统永远无法使热量全部转化为功,总会有一部分热量被转化为无效热。
热力学第二定律还表明了热力学过程的方向性,即热量只能从高温物体传递到低温物体,而不能反向传递。
(3)热力学第三定律热力学第三定律规定了当温度趋于绝对零度时,任何物质的熵都将趋于一个有限值,这个有限值通常被定义为零。
简单地说,热力学第三定律表明了在绝对零度时,任何系统的熵都将趋于零。
热力学第三定律的提出对于热学物理的研究具有非常重要的意义,它为我们理解热学系统的性质提供了重要的基础。
2.热力学过程热力学过程是指热力学系统内部发生的一系列变化,包括各种状态参数的变化和热力学系统对外界的能量交换。
常见的热力学过程有等温过程、绝热过程、等容过程和等压过程等。
这些过程在日常生活以及工业生产中都有着广泛的应用。
(1)等温过程等温过程是指在恒定温度下进行的热力学过程。
在等温过程中,系统对外界做的功和吸收的热量之比是一个常数。
这意味着等温过程的压强和体积成反比,在P-V图上表现为一条双曲线。
常见的等温过程有等温膨胀和等温压缩等。
(2)绝热过程绝热过程是指在无热交换的情况下进行的热力学过程。



大学物理公式第一篇:力学力学是物理学的一个分支,主要研究物体运动的规律和受力情况。
下面是常见的力学公式。
1. 基本运动学公式:v = v₀ + at (速度的变化量)s = s₀ + v₀t + ½at²(位移的变化量)v²– v₀² = 2as (速度和位移的关系)2. 牛顿三定律:F = ma (物体受力与加速度成正比)作用力与反作用力大小相等、方向相反、作用在不同的物体上3. 动力学公式:F = ma (力的大小与加速度成正比)F = Gm₁m₂/r²(万有引力定律)K = ½mv²(动能公式)U = mgh (重力势能公式)E = K + U (机械能公式)4. 动量定理:FΔt = Δp (作用力与动量变化的关系)p = mv (动量公式)5. 碰撞公式:完全弹性碰撞:m₁v₁ + m₂v₂ = m₁v₁’ + m₂v₂’非完全弹性碰撞:m₁v₁ + m₂v₂ = (m₁ + m₂)V’第二篇:热学热学是物理学的一个分支,主要研究热和温度的现象和规律。
下面是常见的热学公式。
1. 温度计算公式:C = (F – 32) / 1.8 (华氏温度转摄氏温度)F = C × 1.8 + 32 (摄氏度转华氏温度)K = C + 273.15 (摄氏度转开氏温度)2. 热传递公式:Q = mcΔT (热量公式)Q = hAΔT (对流换热公式)Q = kAΔT/d (传导换热公式)3. 热力学公式:Q = ΔU + W (内能变化、热量传递和功的关系)ΔS = Q/T (熵变公式)4. 热力学循环公式:ΔU = W + Q (内能变化、功和热量的关系)η = W/Q₁ = (Q₁– Q₂)/Q₁(热机效率公式)第三篇:电学电学是物理学的一个分支,主要研究电荷和电场的现象和规律。
下面是常见的电学公式。
1. 基本电磁公式:F = kq₁q₂/r²(库仑定律)E = F/q (电场强度公式)U = kq₁q₂/r (电势能公式)V = U/q = kQ/r (电势公式)2. 电流公式:I = Q/t (电流的定义)I = ΔQ/Δt (电流的计算公式)V = IR (欧姆定律)3. 阻抗公式:R = ρl/A (电阻的定义)ρ = RA/l (电阻率公式)Z = R + jX (阻抗的定义)X = 2πfL –1/2πfC (电感和电容的关系)4. 磁场公式:B = μ₀I/2r (安培环形定理)B = μ₀I/4πr²(比奥萨伐尔定律)B = μ₀nI (磁场公式)F = qvBsinθ (洛仑兹力公式)。


物理公式大全——大学物理篇第一章 质点运动学和牛顿运动定律1.1平均速度 v =t△△r1.2 瞬时速度 v=lim 0△t →△t △r =dt dr1. 3速度v=dtds==→→lim lim△t 0△t △t△r 1.6 平均加速度a =△t△v1.7瞬时加速度(加速度)a=lim 0△t →△t △v =dt dv1.8瞬时加速度a=dt dv =22dt rd1.11匀速直线运动质点坐标x=x 0+vt 1.12变速运动速度 v=v 0+at 1.13变速运动质点坐标x=x 0+v 0t+21at 21.14速度随坐标变化公式:v 2-v 02=2a(x-x 0) 1.15自由落体运动 1.16竖直上抛运动⎪⎩⎪⎨⎧===gy v at y gtv 22122 ⎪⎪⎩⎪⎪⎨⎧-=-=-=gyv v gt t v y gt v v 221202200 1.17 抛体运动速度分量⎩⎨⎧-==gt a v v av v yx sin cos 001.18 抛体运动距离分量⎪⎩⎪⎨⎧-•=•=20021sin cos gt t a v y t a v x1.19射程 X=g av 2sin 21.20射高Y=gav 22sin 201.21飞行时间y=xtga —ggx 21.22轨迹方程y=xtga —av gx 2202cos 2 1.23向心加速度 a=Rv 21.24圆周运动加速度等于切向加速度与法向加速度矢量和a=a t +a n1.25 加速度数值 a=22n t a a +1.26 法向加速度和匀速圆周运动的向心加速度相同a n =Rv 21.27切向加速度只改变速度的大小a t =dtdv 1.28 ωΦR dtd R dt ds v ===1.29角速度 dtφωd =1.30角加速度 22dt dtd d φωα== 1.31角加速度a 与线加速度a n 、a t 间的关系a n =222)(ωωR R R R v == a t =αωR dtd R dt dv ==牛顿第一定律:任何物体都保持静止或匀速直线运动状态,除非它受到作用力而被迫改变这种状态。
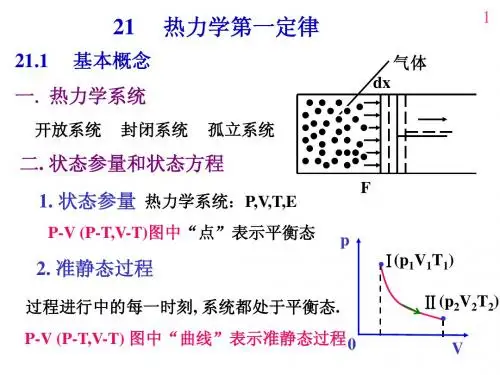
热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
第一章 质点运动学和牛顿运动定律1.1平均速度 v =t△△r 1.2 瞬时速度 v=lim 0△t →△t △r =dt dr 1.3速度v=dtds ==→→lim lim 0△t 0△t △t △r 1.6 平均加速度a =△t△v 1.7瞬时加速度(加速度)a=lim 0△t →△t △v =dtdv 1.8瞬时加速度a=dt dv =22dtr d 1.11匀速直线运动质点坐标x=x 0+vt1.12变速运动速度 v=v 0+at1.13变速运动质点坐标x=x 0+v 0t+21at 2 1.14速度随坐标变化公式:v 2-v 02=2a(x-x 0)1.15自由落体运动 1.16竖直上抛运动⎪⎩⎪⎨⎧===gy v at y gt v 22122 ⎪⎪⎩⎪⎪⎨⎧-=-=-=gy v v gt t v y gt v v 221202200 1.17 抛体运动速度分量⎩⎨⎧-==gt a v v a v v yx sin cos 00 1.18 抛体运动距离分量⎪⎩⎪⎨⎧-∙=∙=20021sin cos gt t a v y t a v x 1.19射程 X=ga v 2sin 20 1.20射高Y=ga v 22sin 20 1.21飞行时间y=xtga —ggx 21.22轨迹方程y=xtga —av gx 2202cos 2 1.23向心加速度 a=Rv 21.24圆周运动加速度等于切向加速度与法向加速度矢量和a=a t +a n1.25 加速度数值 a=22n t a a + 1.26 法向加速度和匀速圆周运动的向心加速度相同a n =Rv 21.27切向加速度只改变速度的大小a t =dtdv 1.28 ωΦR dtd R dt ds v ===1.29角速度 dt φωd = 1.30角加速度 22dt dtd d φωα== 1.31角加速度a 与线加速度a n 、a t 间的关系a n =222)(ωωR R R R v == a t =αωR dtd R dt dv ==牛顿第一定律:任何物体都保持静止或匀速直线运动状态,除非它受到作用力而被迫改变这种状态。
热 学 公 式
1.理想气体温标定义:0
273.16lim
TP p TP
p
T K p →=⋅(定体) 2.摄氏温度t 与热力学温度T 之间的关系:0
//273.15t C T K =- 华氏温度F t 与摄氏温度t 之间的关系:9325
F t t =+ 3.理想气体状态方程:pV RT ν=
1mol 范德瓦耳斯气体状态方程:2
()()m m a
p V b RT V +
-= 其中摩尔气体常量8.31/R J mol K =⋅或2
8.2110/R atm L mol K -=⨯⋅⋅
4.微观量与宏观量的关系:p nkT =,23kt p n ε=
,3
2kt kT ε= 5.标准状况下气体分子的数密度(洛施密特数)253
0 2.6910/n m =⨯
6.分子力的伦纳德-琼斯势:12
6
()4[()()]p E r r
r
σ
σ
ε=-,其中ε为势阱深度
,
σ=
,特别适用于惰性气体,该分子力大致对应于昂内斯气体; 分子力的弱引力刚性球模型(苏则朗模型):06
000, ()(), p r r E r r r r r
φ+∞<⎧⎪
=⎨-≥⎪⎩,其中0φ 为势阱深度,该分子力对应于范德瓦耳斯气体。
7.均匀重力场中等温大气分子的数密度(压强)按高度分布:
00()mgz
Mgz kT
RT
n z n e
n e --
==,//00()mgz kT
Mgz RT p z p e
p e --==, 大气标高:RT
H Mg
=。
8.麦克斯韦速率分布函数:2
3/2
22()4()2mv kT
dN m f v e v Ndv kT
ππ-
=
=;其简便形式
:2
2()u f u du e du -=,其中p v u v =。
9.三个分子速率的统计平均值:最概然速
率
:p v ==平均速率
:v ==;方均根速率
:rms v =
=
=10.分子通量1
4
nv Γ=:单位时间内,单位面积容器壁所受到的分子碰撞次数。
12.能量均分定理:在温度为T 的平衡态下,物质分子的每一个自由度都具有相同的
平均动能,其大小都等于/2kT 。
分子平均能量:1
(2)22
i kT t r v kT ε==++,
其中t 、r 、v 分别为平动、转动、振动自由度。
单原子分子:3i =;刚性双原子分子:5i =;刚性线型多原子分子:5i =;刚性非线型多原子分子:6i =;以上刚
性分子均不包含振动自由度v ;对于非刚性分子,振动自由度数v 一般不就是整数,须经量子力学计算。
13.热传导的傅里叶定律:热流密度dT
q dz
κ=-;⇒ 热传导的热欧姆定律:热流量1T
L A
φκ∆=
,其中κ为热导率。
14.关于自然对流的牛顿冷却定律:hA T φ=∆,其中h 为自然对流系数,T ∆就是固
体表面与流体主体间的温差。
15.黑体的总辐出度(辐射热流密度)4
()b R T T σ=,其中斯特藩-玻尔兹曼常量
8245.6710/W m K σ-=⨯⋅。
一般物体(可近似视为灰体)的总辐出度4
()R T T ασ=,其中α为灰体的吸收率或发射率(两者相等)。
16.黑体辐射的维恩位移定律:3
2.910m T m K λ-=⨯⋅
17.热力学第一定律:Q U W =∆+,其微分形式:đQ dU đW =+。
18.定体摩尔热容:,,()(
)V m
m
V m V dQ U C dT T
∂=
=∂,
对于常温附近的理想气体,()2m i U T RT =,,2
V m i
C R =。
19.定压摩尔热容:,,()()p m m p m p dQ H
C dT T
∂=
=∂, 对于常温附近的理想气体,()()(1)22
m m m i i
H T U T pV RT RT RT =+=+=+,
,(1)2
p m i
C R =+。
20.摩尔热容比,,p m
V m
C C γ=。
对于常温附近的理想气
体,2
i i
γ+=
,,1V m R C γ=-,,,p m V m C C R -=(迈尔公式)。
21.理想气体的基本过程
等体过程:0W =,,V m Q U C T ν=∆=∆;
等压过程:W p V R T ν=∆=∆,,V m U C T ν∆=∆,,p m Q C T ν=∆; 等温过程:0U ∆=,2
1
ln
V Q W RT V ν==;
绝热过程:0Q =,,V m W U C T ν=-∆=-∆,
绝热过程方程:pV γ
=常量,或1
TV
γ-=常量; 多方过程:n
pV =常量,或1
n TV
-=常量, ,n m Q C T ν=∆,其中多方摩尔热容,11
n m R R
C n γ=---, ,V m U C T ν∆=∆,
1122
11pV p V R
W Q U T n n ν-=-∆=-
∆=
--。
22.介质中纵波传播速度
:u =
=其中S κ为绝热压缩系数, 理想气体声速
:u =
23.热机效率的一般公式:12
2111
1Q Q Q W Q Q Q η-===-,其中1Q 为整个热机循环的所有吸热之与,2Q 为整个热机循环的所有放热之与。
可逆卡诺热机效率21
1T
T η=-卡。
24.制冷机的制冷系数一般公式:22
12
Q Q COP W Q Q ==-制冷,
可逆卡诺制冷机的制冷系数212
T COP T T =-卡诺制冷。
25.克劳修斯等式:0R đQ
T
=⎰,下标R 表示可逆循环。
熵变计算的一般式:f f i iR đQ
S S T
-=⎰,下标R 表示可逆过程。
26.理想气体熵变的一般表达式:,ln ln f f
V m i i
T V S C R T V νν∆=+;其中
等体过程:,()ln f V V m i T S C T ν∆=;等压过程:,()ln f
p p m i T S C T ν∆=;
等温过程:()ln f T i V S R V ν∆=;可逆多方过程:,()ln f
n n m i
T S C T ν∆=;
可逆绝热过程:()0S S ∆=。
27.固体与液体的熵变公式:ln f i
f
T f iR T i
T đQ
cmdT S cm T T T ∆===⎰⎰,其中c 为固体或液
体的比热容。
28.热源的熵变:()Q
S T ∆=热源热源热源
,其中Q 热源指热源吸收的热量。
说明:热源的
温度几乎不变,因此它的变化总就是准静态可逆过程。
29.熵增加原理:()0S ∆≥绝热(可逆取等号,不可逆取不等号)。
30.热力学第二定律的数学表达式:f
f i i
đQ
S S S T
∆=-≥
⎰
(可逆取等号,不可逆取不等号)。
31.克劳修斯不等式:
0đQ
T
≤⎰
(可逆循环取等号)。
注:29,30,31三不等式相互等价!彼此间可以相互推导。
32.p V T --系统的热力学基本(中心)方程:TdS dU pdV =+。
33.玻尔兹曼熵公式:ln S k W =,其中W 就是某宏观状态的微观状态数或称热力学概
率。
34.气体分子的平均碰撞频率Z vn =
;平均自由程
v Z λ=
=。
其中 2d σπ=为分子的碰撞截面。