14第十四章氮族元素
- 格式:ppt
- 大小:1.76 MB
- 文档页数:27

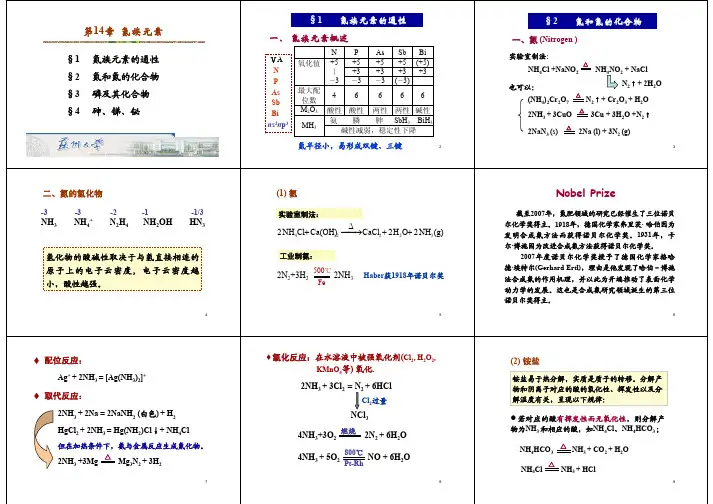





第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物3B: 杂化,与2也是一种拟卤离子。
反应类似于卤除浅黄色的一般易溶。
盐,生成沉淀物。
但以氧化性为主,N 不等性杂化,大键中电亚硝酸的分子结构阳离子离子电场较弱一个电子形成第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物: 由于动力学原因,这种歧化只有在碱中才能成为现实。
PH轨道相互成键,+2°氧化物的性质离子形成可溶性配合物所以分析中常用做为的掩蔽剂D)缩合性链聚多磷酸的通式B)、Array B) 歧化反应的鸡蛋清溶液,使蛋白溶按顺序X第十四章 氮族元素§本章摘要§ 1.氮和氮的化合物单质 氮的氢化物 氮的含氧化合物 2.磷和磷的化合物单质 磷的氢化物 磷的含氧化合物 磷的卤化物和硫化物3.砷、锑、铋单质 砷锑铋的氢化物 砷、锑、铋的氧化物及其水合物 砷、锑、铋的三卤化物 砷、锑、铋的硫化物可与F 2反应有五价化合物生成。
,在碱性介质中而在强酸中,即] =1时,可以氧化,在酸介质中却弱酸,碱性比,若用浓盐酸抑制水解,体系中会有存在,但用水解,溶液中也不会有。
则要在浓盐酸中通入只有在浓盐酸中才会有存在,通入H无.。


武汉大学版无机化学课后习题答案--14氮族元素第十四章 氮族元素1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少? 答:N 2 :2222222*222pp p s s KK σππσσ 键级3 NO :1*22222222*222pp p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P 高,但氮不如P 活泼,这是由俩者单质的结构不同决定的。
N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
特别白磷的P-P-P 键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g)ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。