高中化学竞赛第三讲主族元素4
- 格式:ppt
- 大小:354.50 KB
- 文档页数:20

高中化学竞赛 课程设计一、课程目标知识目标:1. 掌握高中化学竞赛的核心知识点,包括有机化学、无机化学、物理化学和结构化学等,能运用所学知识解决竞赛中的问题。
2. 熟悉并掌握化学实验的基本技能,能够独立完成竞赛所需的实验操作。
技能目标:1. 培养学生运用化学知识分析和解决问题的能力,提高逻辑思维和创新思维能力。
2. 提高学生化学实验操作的准确性和熟练度,培养实验观察能力和实验数据的处理能力。
情感态度价值观目标:1. 培养学生对化学学科的兴趣和热情,激发学生学习化学的内驱力。
2. 培养学生的团队合作意识,学会在竞赛中相互学习、共同进步。
3. 增强学生的科学素养,培养严谨、求实的科学态度,树立环保意识和可持续发展观念。
课程性质:本课程为高中化学竞赛辅导课程,旨在提高学生的化学学科素养,培养具备竞争力的化学人才。
学生特点:学生具备一定的化学基础,对化学学科有兴趣,具备一定的自主学习能力和探究精神。
教学要求:结合学生特点和课程性质,采用讲授、实验、讨论等多种教学方法,注重培养学生的实践能力和创新精神,提高学生在竞赛中的竞争力。
通过分解课程目标为具体学习成果,便于教学设计和评估。
二、教学内容根据课程目标,教学内容主要包括以下几部分:1. 有机化学:涵盖烃、卤代烃、醇、酚、醚、酮、羧酸、酯等有机化合物的结构与性质,反应机理,合成方法等。
2. 无机化学:包括主族元素、过渡元素、无机化合物、配位化合物等的性质、制备及反应。
3. 物理化学:侧重热力学、动力学、电化学、胶体化学等基本原理及其在化学中的应用。
4. 结构化学:介绍原子、分子、晶体结构的基本理论,包括量子力学基础、化学键理论、分子轨道理论等。
5. 化学实验:包括基本操作技能、实验方法、数据处理及实验设计。
详细教学大纲如下:第一周:有机化学基础及烃的性质第二周:卤代烃、醇、酚、醚、酮、羧酸、酯等有机化合物的性质第三周:有机反应机理及合成方法第四周:无机化学基础及主族元素性质第五周:过渡元素、无机化合物、配位化合物第六周:物理化学基本原理第七周:结构化学基本理论第八周:化学实验操作技能及实验方法第九周:实验数据处理及实验设计第十周:复习与竞赛模拟教学内容与课本紧密关联,按照教学大纲安排和进度进行授课,确保内容的科学性和系统性。




高中化学奥林匹克竞赛辅导元素周期表与元素周期律1.元素周期表的框架:2.元素周期表的分区:s区:包括第I、Ⅱ主族元素,价电子构型为ns1和ns2。
d区:包括第Ⅱ→Ⅱ副族和第Ⅱ族的元素,价电子构型一般为(n-1)d1~8ns2。
ds区:包括第I、Ⅱ副族元素,价电子构型为(n-1)d10ns1~2。
p区:包括第Ⅱ→Ⅱ主族和零族元素,价电子构型为ns2np1~6。
f区:包括镧系元素和锕系元素,价电子构型一般为(n-2)f1~14(n-1)d1~2ns2。
说明:(1)周期序数=原子的电子层数n。
第n周期含有元素的数目有以下规律:当n为偶数时,第n 周期含有元素的数目为(n+2)2/2;当n为奇数时,第n周期含有元素的数目为(n+1)2/2。
(2)主族元素的族序数=原子最外层电子数。
(3)对于d区元素,族序数=元素最高能级中的电子总数,如21Sc:[Ar]3d14s2是第Ⅱ B族,Mo:[Ar]3d64s2是第Ⅱ族。
26注意:如果元素最高能级组中的电子总数大于8,也属于第Ⅱ族,如Co、Ni等。
(4)对于ds区元素:族序数=原子最外层电子数,如29Cu:[Ar]3d104s1是第Ⅱ B族(5)d区和ds区元素均为副族元素,统称为过渡元素。
f区元素统称为内过渡元素。
3.元素周期律:原子半径、金属性、非金属性、电离能、电子亲合能、电负性。
4.原子半径:原子核的周围是电子云,它们是没有确定的边界的。
我们通常所说的原子半径是人为地规定的一种物理量。
原子半径可分为金属半径、共价半径、范德华半径三种。
共价半径是元素的两个原子以共价单键相连时,核间距离的一半。
稀有气体元素一般不能形成共价单键,所以用稀有气体分子晶体中两个原子距离的一半作为其半径,称为范德华半径。
范德华力不能像共价键一样将两个原子紧密结合,所以范德华半径大于共价半径,因此由于标准的不同,稀有气体的原子半径在同一周期的元素中半径是最大的。
金属单质的晶体中,相邻两金属原子核间距离的一半,称为该金属原子的金属半径。

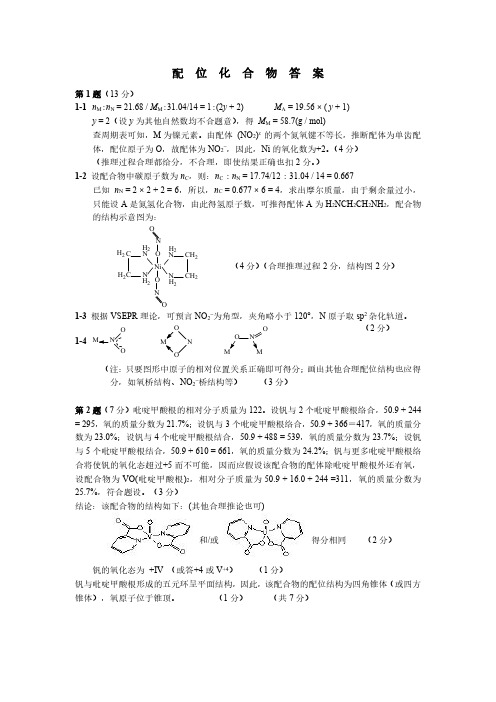
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。

〔一〕主族元素及其化合物一、氢和稀有气体〔一〕氢氢位于周期表的第一周期IA族,具有最简单的原子结构。
氢在化学反响中有以下几种成键情况:1、氢原子失去1个电子成为H+。
但是除了气态的质子外,H+总是与其它的原子或分子相结合。
2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中〔除Be外〕的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键。
〔二〕稀有气体1、稀有气体的存在、性质和制备〔1〕存在:稀有气体的价电子结构称为饱和电子层结构,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
〔2〕物性:稀有气体均为单原子分子,He是所有单质中沸点最低的气体。
〔3〕制备:①空气的液化②稀有气体的别离2、稀有气体化合物〔1〕氟化物①制备:氙和氟在密闭的镍反响器中加热就可得到氙氟化物F2 + Xe〔过量〕→ XeF2 F2 + Xe〔少量〕→ XeF4 F2 + Xe〔少量〕→ XeF6②性质:〔a〕强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。
一般情况被复原为单质。
NaBrO3 + XeF2 + H2O → NaBrO4 + 2HF + Xe二、区元素〔一〕通性1、它们的价电子构型为ns1~2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2、有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3、电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
〔二〕单质1、存在:由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
如盐〔X-、CO-23、SiO-23、SO-24等〕;氧化物〔Li2O、BeO等〕2、性质:〔1〕物性:单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。



高中化学奥林匹克竞赛辅导氧族元素一、氧族元素简介氧族元素包括氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五个元素,价层电子构型为n s2n p4。
氧族元素与电负性比它们大的元素化合时,氧化数可呈现+2、+4、+6(O的氧化数最高为+2,如OF2)。
氧族元素处于+6氧化态时只有氧化性,处于+4氧化态时既有氧化性又有还原性。
氧族元素的性质二、氧及其化合物1.氧的单质氧有两种常见的同素异形体,即O2和O3。
O3为V型结构,中心O原子为sp2杂化,含一个π34键。
它和SO2、NO2-等微粒互为等电子体。
O3分子具有弱极性,偶极矩μ=0.53D。
O2是无色气体,其液体和固体都是淡蓝色的,工业上用分馏液态空气来制备O2。
实验室可以用加热KMnO4、KClO3固体(MnO2作催化剂),或者MnO2催化H2O2分解得到。
O3因其特殊的鱼腥臭味而得名,具有比O2更强的氧化性,可使湿润的淀粉-KI试纸变蓝:O3+2KI+H2O=2KOH+I2+O2。
O3可以用作工业废水处理剂,效率高且无污染。
如,CN-+O3=OCN-+O2。
2.H2O:H2O是地球上分布最广泛的物质,是最重要的化合物之一,H2O的分子结构为V型,键角为104.5°,具有很强的极性。
H2O分子中存在氢键,其熔沸点高于同主族其它元素的氢化物。
H 2O 的式量为18.02,在沸点时测得其相对分子量是18.64,此时H 2O 分子一部分以二聚物[(H 2O)2] 存在。
H 2O 分子之间以氢键缔合。
在液态水中,存在是3个、4个……更多数目的H 2O 分子缔合而成的缔合分子。
水有很高的热稳定性,加热到2000K 时也只有0.6%的水分解。
3.H 2O 2:H 2O 2分子中两个O 原子以非极性共价键相连,-O-O-键称为过氧键,两个H 原子和两个O 原子不在同一个平面上,其立体结构如图所示:H 2O 2是无色的粘稠液体,分子间有氢键。
由于极性比水强,在固态和液态时,H 2O 2分子缔合的程度比水大,所以沸点比水高,达150℃。

物质结构---第一部分原子结构元素周期系1.原子结构核外电子的运动状态: 用s、p、d等表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能、电子亲合能、电负性。
2.元素周期律与元素周期系周期。
1~18族。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。
原子半径和离子半径。
s、p、d、ds、f区元素的基本化学性质和一原子的电子构型。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高氧化态与族序数的关系。
对角线规则。
金属与非金属在周期表中的位置。
半金属(类金属)。
主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及其主要形体。
铂系元素的概念。
第一节核外电子的运动一、原子核外电子的运动状态(一)核外电子的运动特点:;;。
(二)核外电子的运动表示电子云是描述电子在核外空间运动的一种图象,它从统计的概念出发对核外电子出现的几率密度作形象化的图示。
二、原于核外电子的排布(一)多电子原子的电子排布---1.依据:、。
2.图示(二)核外电子排布的原理1.能量最低原理:2.保里不相容原理:3.洪特(Hund)规则:电子将尽可能多分占不同的简并轨道,且自旋平行。
及Hund特例:简并轨道全充满,半充满,全空,能量相对较低,较稳定。
[例外] Nb、Ru、Rh、W、Pt(三)能级顺序——近似能级图1. 能级交错现象;2. 能级组:能量相近的能级划分为一组;3. 徐光宪先生 n+0.7规则:4. 近似能级图——电子填充顺序(四)核外电子排布的表示方法:有关概念:基态、激发态;原子、离子;“原子实”——希有气体结构;“价电子构型”1.轨道表示式:2.电子排布式:4.原子结构和元素在周期表中位置的关系。
①元素的周期数原子最外层的n数值即为该元素的所在周期数。
一个能级组相当于一个周期,周期有长短之分。
短周期(能级组内仅含有s、p能级)。

