第2章 能级与辐射b汇总
- 格式:ppt
- 大小:1.58 MB
- 文档页数:52


原子能级和辐射知识点总结一、原子能级1. 原子结构原子是由原子核和绕核运动的电子组成的,原子核由质子和中子组成,质子带正电荷,中子不带电。
电子是带负电的,围绕原子核轨道运动。
2. 能级原子的电子围绕原子核运动时,由于受到电子自旋磁矩和轨道磁矩的相互作用,会产生能级分裂,形成多个能级。
电子在这些能级上运动时,会处于不同的状态。
3. 能级跃迁当电子从一个能级跃迁到另一个能级时,会吸收或发射光子,这种光子的能量正好等于两个能级之间的能差。
这是光子的辐射。
4. 能级的确定能级取决于原子核的质量和电子的位置,不同的原子核和电子分布形式会导致不同的能级结构。
每个原子都有特定的能级,这些能级是由原子的物理特性所决定的。
5. 能级的作用原子的能级决定了原子的光谱特性,不同原子的能级结构不同,因此存在着不同的光谱线。
通过研究原子的能级结构,可以揭示原子内部的物理特性,从而为原子物理学和量子力学的研究提供重要的信息。
6. 能级分布原子的能级是离散的,即只能取一些特定的数值。
在研究光谱时,我们经常需要计算原子的能级分布,以便理解光谱线的产生机制。
二、辐射1. 辐射的概念辐射是指从一个物体发射出的能量或粒子,并向外传播的过程。
辐射可以是电磁波、光子、中子等形式,通常是由原子、分子或亚原子粒子发射出来的。
2. 辐射的分类辐射可以分为电磁辐射和粒子辐射两大类。
电磁辐射包括可见光、紫外线、X射线和γ射线等,而粒子辐射包括α射线、β射线和中子辐射等。
3. 电磁辐射电磁辐射是由电磁场振荡产生的,具有电磁波的性质。
根据频率不同,电磁辐射可以分为不同的波段,包括无线电波、微波、红外线、可见光、紫外线、X射线和γ射线等。
不同波长的电磁辐射具有不同的能量和穿透能力。
4. 粒子辐射粒子辐射是由高速粒子产生的,包括α粒子、β粒子和中子。
这些粒子具有质量和电荷,与物质相互作用时会产生不同的效应。
5. 吸收和发射物质对辐射的吸收和发射是辐射研究的重要课题。


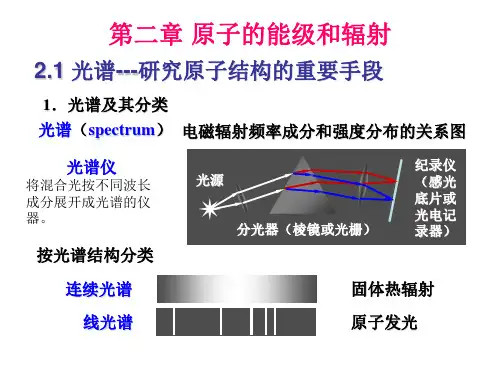




第二章 原子的能级和辐射一、学习要点:1.氢原子光谱:线状谱、五个线系(记住名称、顺序)、广义巴尔末公式)11(~22nm R -=ν、 光谱项()2nR n T =、并合原则:)()(~n T m T -=ν 2.玻尔氢原子理论:(1)玻尔三条基本假设的实验基础和内容(记熟) (2)圆轨道理论(会推导):氢原子中假设原子核静止,电子绕核作匀速率圆周运动02200202220A 529,04,Z Z 4≈===em a n a n e m r e e n πεπε;13714,Z Z 40202≈===c e n c n e c e n πεααπευ;()n hcT nhc R ne m E e n --=-=∞2222422Z 2Z )41(πε,n =1.2.3……(3)实验验证:(a )氢原子五个线系的形成)11(Z ~,)4(222232042nm R c h e m R e -==∞∞νπεπ (会推导)非量子化轨道跃迁)(212n E E mv h -+=∞ν(b )夫-赫实验:装置、.结果及分析;原子的电离电势、激发电势 3.类氢离子(+++Li,He ,正电子偶素.-μ原子等)(1) He +光谱:毕克林系的发现、波数公式、与氢原子巴耳末系的异同等 (2)理论处理(会推导):计及原子核的运动,电子和原子核绕共同质心作匀速率圆周运动ee m M m M +⋅=μ, 正负电荷中心之距Ze n rn22204μπε =.能量224222Z )41(n e E n μπε-=,里德伯常数变化Mm R R eA +=∞11重氢(氘)的发现 4.椭圆轨道理论索末菲量子化条件q qnh n pdq ,⎰=为整数an n b n em a ne m E n p e n ϕϕϕπεπε==-==,Z 4,2Z )41(,222022422,n n n ,,3,2,1;,3,2,1 ==ϕn 一定,n E 一定,长半轴一定,有n 个短半轴,有n 个椭圆轨道(状态),即n E 为n 度简并。


第二章 原子的能级和辐射2.1 试计算氢原子的第一玻尔轨道上电子绕核转动的频率、线速度和加速度。
解:电子在第一玻尔轨道上即n=1。
根据量子化条件,πφ2hnmvrp == 1010.52910r a m −==×可得:频率 21211222ma hma nh a v πππν===1516.5610s −=×速度:m/s 61110188.2/2×===ma h a v νπ加速度:221/8.9810w v a ==×2m /s 22.2 试由氢原子的里德伯常数计算基态氢原子的电离电势和第一激发电势。
解:电离能为,把氢原子的能级公式代入,得:1E E E i −=∞2/n Rhc E n −=Rhc hc R E H i =∞−=111(2=13.60eV。
电离电势:60.13==eE V ii V 第一激发能为将电子从n=1的能级激发到n=2的能级上所需要的能量:20.1060.134343)2111(22=×==−=Rhc hc R E H i eV 第一激发电势:20.1011==eE V V 2.3 用能量为12.5电子伏特的电子去激发基态氢原子,问受激发的氢原子向低能基跃迁时,会出现那些波长的光谱线?解:由氢原子能级公式:2/H E hcR n =−得:113.6E eV =−2 3.4E e =−3 1.51E e ,,V V −40.85E eV ,==−可见,具有12.5电子伏特能量的电子只能激发H 原子至3≤n 的能级。
跃迁时可能发出的光谱线的波长为:1221111(5/36656323H H R R A ολλ=−=⇒=222232231113()12151241118()1025.7139H H H H R R R R οAAολλλλ=−=⇒==−=⇒=2.4 试估算一次电离的氦离子、二次电离的锂离子的第一玻尔轨道半径、电离电势、第一激发电势和赖曼系第一条谱线波长分别与氢原子的上述物理量之比值。