化学反应速率反应平衡图像题解析
- 格式:docx
- 大小:152.82 KB
- 文档页数:6


专题42化学反应速率与平衡图像问题1.【2022年湖南卷】向体积均为1L 的两恒容容器中分别充入2mol X 和1mol Y 发生反应:2X(g)+Y(g)Z(g) ΔH ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
下列说法正确的是A .ΔH>0B .气体的总物质的量:a c n <nC .a 点平衡常数:K>12D .反应速率:a b v <v 正正【答案】BC 【解析】A .甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT 可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即H ∆<0,故A 错误;B .根据A 项分析可知,上述密闭溶液中的反应为放热反应,图中a 点和c 点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:n a <n c ,故B 正确;C .a 点为平衡点,此时容器的总压为p ,根据理想气体状态方程PV=nRT 可知,在恒容条件下进行,气体的物质的量之比等于P T整体之比,根据A 项分析可知,绝热条件下,反应到平衡状态放热,所以T a >T 始,压强:Pa=12P 始,则n a <12n 始,可设Y 转化的物质的量浓度为xmol∙L −1,则列出三段式如下:02X(g)+Y(g)Z(g)2102x xx 22x 1x x c cc ∆-- 平,则有[(22x)(1x)x]mol -+-+<13mol 2⨯,计算得到x >0.75,那么化学平衡常数K=2c(Z)c (X)c(Y)⋅>20.75120.50.25=⨯,故C 正确;D .根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即V a 正>V b 正,故D 错误。


化学反应速率、化学平衡图像问题近几年,高考题中所设计的化学平衡图像题目千变万化,其巧妙灵活的设计和新颖奇特的图像题常常考查学生灵活运用数学工具解决化学问题的能力。
解决此类问题需从以下二步入手。
一、解题必备知能1.捕捉图像最基本的信息(1)横坐标与纵坐标的含义横坐标通常是:t、T、p等(即时间、温度、压强等)。
纵坐标通常是:v、c、n、α、φ等(即速率、物质的量浓度、物质的量、转化率、体积分数等)。
(2)线的走向与斜率线的走向,即随着横坐标自变量的增大,纵坐标因变量是变大,变小,还是不变。
当纵坐标所表示的物理量,如:速率,物质的量浓度,物质的量,转化率,体积分数等不随横坐标的变化而变化时,图像中出现一条直线,那么该反应就到达了化学平衡状态。
斜率,是化学平衡图像曲线中,一个重要的参数。
斜率的应用,通常是对两条不同曲线的斜率进行比较,或者通过比较同一条曲线不同时刻的斜率变化来判断反应是改变了哪些外界条件。
(3)观察化学平衡图像中的“重点”所谓的“重点”,指的就是化学平衡图像中的起点、拐点、终点、交点、突变点等,这些点往往隐藏着许多重要的信息,借助这些“重点”中的有效信息,能够快速地找到解题的思路,突破图像题的难点。
(4)跟踪化学平衡图像中量的变化量的变化,指的是纵坐标表示的物理量所发生的变化是由什么外界条件改变而引起的。
要解决这个问题,我们经常要借助化学平衡移动理论。
2.灵活运用解题技巧议二个量,再讨论另外两个量的关系。
二、题型技法点拨类型(一)利用“断点”突破vt图像1.速率时间图像“断点”分析当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能使速率时间图像的曲线出现不连续的情况,即出现“断点”。
根据“断点”前后的速率大小,即可对外界条件的变化情况作出判断。
如图,t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)。
2.常见含“断点”的速率变化图像分析图像t1时刻所改变的条件温度升高降低升高降低适合正反应为放热的反应适合正反应为吸热的反应压强增大减小增大减小适合正反应为气体物质的量增大的反应适合正反应为气体物质的量减小的反应[典例1]对于反应2SO2(g)+O2(g)2SO3(g)ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)()[解析]分析时要注意改变条件瞬间v正、v逆的变化。


2020年高二化学专题复习——常考速率、平衡图像识图策略(知识梳理与训练)(选修4人教版)知识梳理一、常规图像分类突破典型图像和典型例题1.速率时间图像(1)当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能使速率—时间图像的曲线出现不连续的情况,根据出现“断点”前后的速率大小,即可对外界条件的变化情况作出判断。
如图:t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)。
(2)“渐变”类v-t图像t1时v′逆突然减小,v′正逐渐减小;v′正>v′逆,平衡向正反应方向移动t1时其他条件不变,减小生成物的浓度(3)利用图像“断点”判断影响速率的外因图像t1时刻所改变的条件温度升高降低升高降低正反应为放热的反应正反应为吸热的反应压强增大减小增大减小正反应为气体物质的量增大的反应正反应为气体物质的量减小的反应应用体验在一密闭容器中发生反应N2+3H22NH3ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:(1)处于平衡状态的时间段是________(填字母,下同)。
A.t0~t1B.t1~t2C.t2~t3D.t3~t4E.t4~t5F.t5~t6(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强B.减小压强C.升高温度D.降低温度E.加催化剂F.充入氮气t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1B.t2~t3C.t3~t4D.t5~t6(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
答案(1)ACDF(2)C E B(3)A(4)解析(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
![[全]高考化学-化学反应速率与平衡图像考点解析](https://uimg.taocdn.com/697509e10722192e4436f62c.webp)
高考化学-化学反应速率与平衡图像考点解析1.解题思路专题讲座(三)分类突破化学反应速率与平衡图像2.解题步骤类型1 速率—压强(或温度)图像曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
图中交点是平衡状态,压强增大,正反应速率增大得快,平衡正向移动。
[对点训练]1.下列各图是温度(或压强)对反应:2A(s)+2B(g)2C(g)+D(g)(正反应为吸热反应)的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是( )C [根据化学反应特点,升温平衡向正向移动,但v正、v逆均增大,加压,平衡向逆向移动,v逆>v正。
]类型2 转化率(或百分含量)—时间—温度(或压强)图像已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线,推断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。
[以A(g)+B(g)C(g)中反应物的转化率αA为例说明]解答这类图像题时应注意以下两点:(1)"先拐先平,数值大"原则分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。
①若为温度变化引起,温度较高时,反应达平衡所需时间短。
如甲中T2>T1。
②若为压强变化引起,压强较大时,反应达平衡所需时间短。
如乙中p1>p2。
③若为是否使用催化剂,使用适宜催化剂时,反应达平衡所需时间短。
如图丙中a使用催化剂。
(2)正确掌握图像中反应规律的判断方法①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为放热反应。
②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为气体体积缩小的反应。
③若纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
[对点训练]2.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )温度(T)的影响压强(p)的影响A.CO2(g)+2NH3(g)==CO(NH2)2(s)+H2O(g);ΔH<0B.CO2(g)+H2(g)=CO(g)+H2O(g);ΔH>0C.CH3CH2OH(g)=CH2===CH2(g)+H2O(g);ΔH>0D.2C6H5CH2CH3(g)+O2(g)=2C6H5CH===CH2(g)+2H2O(g);ΔH<0A [本题考查化学平衡知识,通过分析图像确定可能对应的反应。

2021-2022学年高一化学期末复习重点专题突破专题08 化学反应速率及平衡图像问题的分析方法探究一、化学平衡建立过程中反应速率变化图像根据图像可进行如下分析:二、化学平衡建立过程中物质的量变化图像根据图像可进行如下分析:1.分清反应物和生成物,物质的量减小的是反应物,物质的量增加的是生成物,生成物多数是以原点为起点。
2.根据相同时间内反应物和生成物的物质的量变化,可计算各物质的化学反应速率,再根据化学反应速率之比等于各自的化学计量数之比,可推出反应的化学方程式。
3.找出反应达到平衡的时间点,进而通过图中数据,可计算得到反应达到一定时间下,反应物的物质的量、生成物的物质的量以及反应物的转化率等。
三、有关化学反应速率和化学平衡的计算解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。
如:m A(g)+n B(g)p C(g)+q D(g)起始/mol a b0 0转化/mol mx nx px qx平衡/mol a−mx b−nx px qx(1)关于反应物转化率的计算A的转化率=AA的转化量的起始量×100%(计算式中A的量可以指反应物的物质的量、质量、浓度、体积等)(2)关于某气体组分的体积分数的计算气体A的体积分数=A体系中的物质的量体系中气体总的物质的量×100%四、解答化学反应速率及化学平衡图像题的方法技巧化学反应速率及化学平衡的图像,能直观描述反应进行的快慢、反应进行的程度等问题。
图像题是化学中常见的一种题目,做这类题既要读文字内容,又要读图。
解答化学反应速率图像题三步曲:“一看”、“二想”、“三判断”;“一看”——看图像①看坐标轴:弄清纵、横坐标表示的含义;②看线:弄清线的走向、趋势;③看点:弄清曲线上点的含义,特别是一些特殊点,如曲线的折点、交点、最高点与最低点等;④看量的变化:弄清是物质的量的变化、浓度的变化还是转化率的变化等。


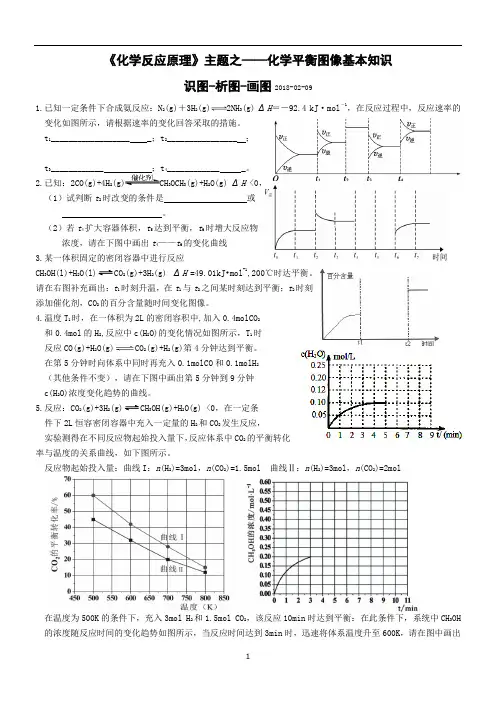
《化学反应原理》主题之——化学平衡图像基本知识识图-析图-画图2018-02-091.已知一定条件下合成氨反应:N 2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1__________________ _;t2________________ ;t3____________ ;t4____________ _。
2.已知:2CO(g)+4H 2(g)CH3OCH3(g)+H2O(g) ΔH <0,(1)试判断t2时改变的条件是或。
(2)若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在下图中画出t4——t6的变化曲线3.某一体积固定的密闭容器中进行反应CH3OH(l)+H2O(l)2(g)+3H2(g) ΔH=49.01kJ•mol-1,200℃时达平衡。
请在右图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。
4.温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g)CO2(g)+H2(g)第4分钟达到平衡。
在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在下图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
5.反应:CO2(g)+3H2(g)3OH(g)+H2O(g) <0,在一定条件下2L恒容密闭容器中充入一定量的H2和CO2发生反应,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。
反应物起始投入量:曲线I:n(H2)=3mol,n(CO2)=1.5mol 曲线Ⅱ:n(H2)=3mol,n(CO2)=2mol在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:在此条件下,系统中CH3OH 的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线。
化学反应速率反应平衡图像题解析一、图像拾零1.速率—时间图此类图像定性地揭示了正、逆反应速率随时间(含条件变化对速率的影响)而变化的规律,体现了平衡的“逆、等、动、定、变、同”的基本特征,以及平衡移动的方向等。
如N2(g)+3H2(g) 2NH3(g);△H<0反应,其速率—时间图如下图所示:(1)当速率改变时分别是什么条件改变?t1, t3,t5, t7(2)哪些时间段是平衡状态?(3)哪一段的N2的转化率最高?2.浓度—时间图此类图像能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。
此类图像要注意各物质曲线的折点(即达到平衡时)时间应该相同。
且各物质的浓度变化值应该满足方程式的计量系数之比。
此类图像可以用于推测反应方程式。
如图所示,800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是()A.A是反应物B.前2minA的分解速率是0.1mol(L min)C.若升高温度,A的转化率增大D.增大压强,A的转化率减小3.全程速率—时间图如锌和盐酸的反应,反应速率随时间的变化出现如图所示的变化。
不同时间段的反应速率的变化情况不同。
AB段反应速率逐渐增加是因为该反应是放热反应,温度升高,反应速率加快。
而BC段反应速率减小是因为随反应的进行,盐酸逐渐被消耗,浓度减小,反应速率减小。
故分析时要抓住各节段的主要矛盾,认真探究。
4.含量—时间—温度(压强)图此类图像要注意的是,折点对应的时间即是达平衡所需要的时间,时间越短表示反应速率越快。
而水平线的高低表示达到平衡时各物质的浓度,它表明的是平衡移动的方向。
常见的形式有以下几种:(b用催化剂,a不用)(T1>T2)(P1>P2)5.恒温(恒压线)该类图像的纵坐标一般是某物质的浓度或某物质的转化率,而横坐标是温度或压强。
主要考虑温度或压强对平衡的移动。
要特别注意,该类图像中一般有温度和压强两个条件同时在改变,要注意先固定其中一个条件不变判断另一个条件对平衡的影响,然后再判断另一个条件对平衡的影响。
不能遗漏。
常见类型有:6.速率—温度(压强)图这类图有两种情况,一是不隐含时间因素的速率—时间图,二是隐含时间变化的速率—时间图。
以2SO2(g) + O2(g) 2SO3(g);△H<0为例,v—t(P)图如图所示:v-T图v-P图第一类第二类第一类第二类7.其他如二、知识规律1.在相同的温度下,对有气体参加的反应,P越大,达到平衡所需的时间越短。
在相同的压强条件下,温度越高,达到平衡所需时间越短。
(也就是图象中由倾斜部分到水平部分的时间越短)2.平衡向正反应方向移动。
生成物的物质的量增加。
但生成物的浓度、百分含量以及反应物的转化率不一定增加。
3.我们只能判断一种条件改变对平衡的影响。
如果有两种条件改变,一定要先固定一种条件不变。
4.要判断吸热、放热,一定要判断温度改变对平衡的影响。
5.要判断温度的变化,可以判断反应速率随温度的改变情况以及温度改变对平衡的影响(向吸热反应方向还是放热反应方向进行)。
6.要判断压强的大小,可以判断反应速率随压强的变化情况。
或者判断压强改变时平衡是向分子数增加的方向还是减小的方向进行。
7.要判断气体的系数的大小,一定要判断压强的改变对平衡的影响。
8.解答化学平衡图象题的一般方法①看清各坐标轴所代表的量的意义,弄清曲线所代表的是哪些量的关系。
②弄清曲线上点的意义,特别是某些特殊点(如坐标轴的交点、几条曲线的交叉点、极值点、转折点等等)。
③弄清曲线“平”与“陡”的意义,即斜率大小的意义。
④弄清曲线函数的增减性。
三、例题加入0.1 mol 的MnO2粉末于50 毫升过氧化氢的溶液中(密度为 1.1 g/mL), 在标准状况下放出气体的体积和时间的关系如下图所示, 回答下列问题:(1)实验时放出气体的总体积为____________(2)放出一半气体所需要的时间为_______________(3)反应放出3/4 气体所需要的时间为___________(4)ABCD四点化学反应速率快慢的顺序为_________________(5)解释反应速率变化的原因______________________________________________(6)计算过氧化氢的初始物质的量的浓度为___________________(7) 求反应进行到2 分钟时过氧化氢的质量分数为_________________________ 在不同时间t 、温度( )A .T 1<T 2,P 1B .T 1> T 2,PC .T 2> T 1,PD .T 1> T 2,P 22NO NOA.B 和C发生反应:A 2(g 分数变化如图所示.A B .E 、F C .H 、I D .G 、H 、I四、跟踪演练1.化学反应X2(g)+Y2(g)2XY(g);△ H <0,达到平衡状态时,右图中各曲线符合平衡移动原理的是2.下图表示外界条件(温度、压强)的变化对下列反应的影响:L(s)+G(g) 2R(g) ;ΔH>0则图中Y 轴是指A .平衡混合气中R 的质量分数B .平衡混合气中G 的质量分数C .G 的转化率D .L 的转化率3.已知某可逆反应在密闭容器中进行:A (s )+2B (g)C (g)+D (g );△H<0,右图中曲线a 代表一定条件下该反应的过程。
若使a 曲线变为b 曲线,可采取的措施是A .增大A 的浓度 B.缩小容器的容积 C .加入催化剂D .升高温度4.密闭容器中进行下列反应:M(g) + N(g)R(g) + 2L ,此反应符合下面图像,下列叙述正确的是( )A .正反应吸热,L 是气体B .正反应吸热,L 是固体C .正反应放热,L 是气体D .正反应放热,L 是固体或液体 5.mA(s) + nB(g)pC(g) +Q 的可逆反应,在定温条件下有关B%与压强P 的关系如图,叙述正确的是( ) A .m + n < p B .n > pC .x 点时混和物的V 正>V 逆D .y 点比x 点混和物的反应速度快 6.有一化学平衡mA(g) + nB(g)pC(g) +qD(g),如图所示,A 的转化率与温度压强的关系图,分析图示可以得出的正确结论是( ) A .正反应是吸热反应,m + n > p + q B .正反应是吸热反应,m + n < p + q C .正反应是放热反应,m + n > p +q D .正反应是放热反应,m + n < p + q 7.反应x(g) + 3y(g)2 z(g) ;△H <0,在不同温,不同压强(P 1 > P 2)下达到平衡时,混气中z 的百分含量随温度变化的曲线应为( )8.在2NO + O 22NO 2 ;△H >0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强P 的关系图是( )9.今有反应X(g)+Y(g)2Z(g),△H <0若反应开始经t 1秒后达到平衡,又经t 2秒后,由于反应条件的改变使平衡破坏,则t 3时又时间达到平衡,如图表示,试分析,以t 2到t 3秒曲线变化的原因是( ) A .增大了X 和Y 的浓度 B .使用了催化剂 C .增加了反就体系的压强 D .升高了反应的温度10.对于达平衡的可逆反应X +YW +Z ,增大压强则正、逆反应速度(v )的变化如下图,分析可知X ,Y ,Z ,W 的聚集状态可能是( ) A .Z ,W 为气体,X ,Y 中之一为气体 B .Z ,W 中之一为气体,X ,Y 为非气体 C .X ,Y ,Z 皆为气体,W 为非气体 D .X ,Y 为气体,Z ,W 中之一为气体11.图中C %表示某反应物在体系中的百分含量,V 表示反应速率,P 表示压强,t 表示反应时间,图1为温度一定时压强与反应速率的关系曲线,图2为压强一定时,在不同时间C %与温度的关系曲线,同时符合以下两个图像的反应是( ) A .4NH 3(g) + 5O 2(g) 4NO(g) + 6H 2O(g);808.7H ∆=-kJ/molB .N 2O 3(g)NO 2(g) + NO(g);41.8H ∆=+kJ/molC .3NO 2(g) + H 2O(l) 2HNO 3(l) + NO(g);261.3H ∆=-kJ/mol D .CO 2(g) + C(s)2CO(g);171.4H ∆=+kJ/mol12.某温度时,在一个2L 的密闭容器中,X 、Y 、Z 三种物质的物质的量随时间的变化曲线如图所示。
根据图中数据,试填写下列空白:(1) 该反应的化学方程式为______________________________。
(2) 反应开始至2min ,气体Z 的平均反应速率为_______________。
(3) 若X 、Y 、Z 均为气体,反应达平衡时: ①此时体系的压强是开始的_______倍。
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为___________反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时_________(填“增大”、“减小”或“相等”)。
(4) 此反应达平衡后,若只加大体系压强,Z 的物质的量减少,若Y 是气体,则X 的聚集状态是___________________。
tVVP图1t图2Ct/minn/1234。