乙二胺四醋酸二钠滴定液配制与标定的标准操作程序
- 格式:doc
- 大小:26.00 KB
- 文档页数:2

药典附录:滴定液乙二胺四醋酸二钠滴定液(0.05mol/l)C10H14N2NA2O8.2H2O=372.24 18.61g→1000ml「配制」取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
来源:考试学习网「标定」取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(ph10.0)10ml,再加铬黑t指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液(0.05mol /l)相当于4.069mg的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
「贮藏」置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
来源:考试学习网乙醇制氢氧化钾滴定液(0.5mol/l)koh=56.1128.06g→1000ml「配制」取氢氧化钾35g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
「标定」精密量取盐酸滴定液(0.5mol/l)25ml,加水50ml稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
「贮藏」置橡皮塞的棕色玻瓶中,密闭保存。
四苯硼钠滴定液(0.02mol/l)(C6H5)4BNA=342.22 6.845g→1000ml「配制」取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25ml水中,在不断搅拌下缓缓滴加氢氧化钠试液至ph8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至ph8~9,再加水稀释至1000ml,摇匀。
「标定」精密量取本液10ml,加醋酸-醋酸钠缓冲液(ph3.7)10ml与溴酚蓝指示液0.5ml,用烃铵盐滴定液(0.01mol/l)滴定至蓝色,并将滴定的结果用空白试验校正。

标准溶液的配置乙二胺四醋酸二钠滴定液(0。
05mol/L)C10H14N2Na2O8·2H2O=372.2418。
61g→1000ml【配制】取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀.【标定】取于约800℃灼烧至恒重的基准氧化锌0。
12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0。
025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10。
0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触.乙醇制氢氧化钾滴定液(0。
5mol/L)KOH=56.1128.06g→1000ml【配制】取氢氧化钾35g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
【标定】精密量取盐酸滴定液(0.5mol/L)25ml,加水50ml稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度.【贮藏】置橡皮塞的棕色玻瓶中,密闭保存。
四苯硼钠滴定液(0。
02mol/L)(C6H5)4BNa=342。
226.845g→1000ml【配制】取四苯硼钠7。
0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1。
0g,溶于25ml水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000ml,摇匀。
【标定】精密量取本液10ml,加醋酸-醋酸钠缓冲液(pH3。
7)10ml与溴酚蓝指示液0.5ml,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。
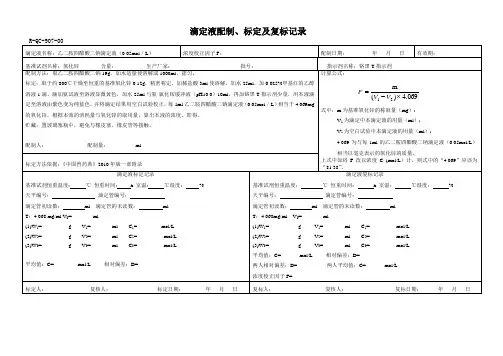
滴定液配制、标定及复标记录R-QC-907-00滴定液名称:乙二胺四醋酸二钠滴定液(0.05mol/L)浓度校正因子F:配制日期:年月日有效期:基准试剂名称:氧化锌含量:生产厂家:批号:指示剂名称:铬黑T指示剂配制方法:取乙二胺四醋酸二钠19g,加水适量使溶解成1000ml,摇匀。
标定:取于约800℃干燥至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定结果用空白试验校正,每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度。
即得。
贮藏:置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
配制人:配制量:ml 计算公式:069.4)(m21⨯-=VVF式中:m为基准氧化锌的称取量(mg);V1为滴定中本滴定液的用量(ml);V2为空白试验中本滴定液的用量(ml);4.069为与每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当以毫克表示的氧化锌的质量。
上式中如将F改以浓度C (mol/L)计,则式中的“4.069”应该为“81.38”。
标定方法依据:《中国兽药典》2010年版一部附录滴定液标定记录基准试剂恒重温度: ℃恒重时间: h 室温: ℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068 mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=滴定液复标记录基准试剂恒重温度:℃恒重时间:h 室温:℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=两人相对偏差:D= 两人平均值:C= mol/L浓度校正因子F=标定人:复核人:标定日期:年月日复标人:复核人:复标日期:年月日。

EDTA-2Na滴定液的配制及标定作业指导书1.目的正确配制/标定EDTA-2Na标准滴定液。
2.适用范围适用于公司实验室用EDTA-2Na滴定溶液的配制及标定操作指导。
3.职责3.1品控员负责试验室滴定溶液的配制。
3.2品控工程师负责对配制结果的审核。
3.3品控经理对本文件的有效性负责。
4.定义无5.程序5.1 原理ZnO+2HCl→ ZnCl2+ H2OZnCl2+Na2H2Y+2NH4OH→ Na2ZnY + 2NH4Cl +2H2OCaCO3+ 2HCl→ CaCl2+CO2+H2OCaCl2+ Na2H2Y +2NaOH→Na2CaY+2NaCl+2H2O式中Y=((COOCCH2)2NCH2CH2N(CH2COO)2)4-5.2 仪器分析天平(0.1mg)、 1000ml容量瓶、250ml容量瓶、1000 ml试剂瓶、250ml 锥形瓶、500ml锥形瓶、500ml烧杯、100ml烧杯。
5.3 试剂EDTA-2Na、铬黑T指示剂、工作基准试剂氧化锌(ZnO)、工作基准试剂碳酸钙(CaCO3)、甲基红指示剂、氨-氯化铵缓冲液(pH≈10)、氨水溶液(10%)、盐酸溶液(20%)、钙指示剂。
5.4配制5.4.1 0.05mol/L EDTA-2Na滴定液:称取20.0 g EDTA-2Na ,加1000 mL 水,加热溶解,冷却,摇匀。
5.4.2 0.02mol/L EDTA-2Na滴定液:称取 8.0 g EDTA-2Na ,加1000 mL 水,加热溶解,冷却,摇匀。
5.4.3 0.01 mol/L EDTA-2Na 滴定液: 在分析天平上称取 3.723±0.004 g EDTA-2Na 溶于500ml RO 水中,转移至1000 ml 容量瓶中,稀释至刻度,摇匀。
5.4.4 0.002 mol/L EDTA-2Na 滴定液: 吸取200 ml已标定准确浓度的0.01 mol/L EDTA-2Na滴定液至1000ml容量瓶中,稀释至刻度,摇匀。

edta标准溶液的配制与标定数据处理以EDTA标准溶液的配制与标定数据处理为主题,本文将介绍EDTA标准溶液的配制方法和标定数据处理过程。
一、EDTA标准溶液的配制EDTA(乙二胺四乙酸)是一种常用的配位试剂,可用于金属离子的定量分析。
EDTA标准溶液的配制需要以下试剂:1. EDTA二钠盐(Na2EDTA):粉末状,纯度≥99.0%。
2. 氢氧化钠(NaOH):固体或液体,纯度≥98.0%。
3. 硝酸银(AgNO3):固体,纯度≥99.0%。
4. 蒸馏水:纯度≥99.0%。
EDTA标准溶液的配制步骤如下:1. 称取约4g的Na2EDTA,加入1000mL容量瓶中。
2. 加入约500mL蒸馏水,摇匀溶解。
3. 加入10mL 1mol/L NaOH溶液,调节pH至8.0-8.2。
4. 加入约50mg AgNO3,用蒸馏水定容至1000mL。
5. 摇匀混合,即得到EDTA标准溶液。
二、EDTA标准溶液的标定数据处理EDTA标准溶液的标定需要使用标准铜离子溶液,标定步骤如下:1. 取一定量的标准铜离子溶液,加入适量的NH3-NH4Cl缓冲液,使pH约为9.5。
2. 加入适量的Eriochrome Black T指示剂,溶液变为蓝色。
3. 用EDTA标准溶液滴定至溶液变为红色,记录所用EDTA标准溶液的体积V1。
4. 重复上述步骤,至少进行三次滴定,计算平均值。
5. 根据反应方程式,计算出标准铜离子溶液的浓度C1。
Cu2+ + EDTA4- + 2H2O → CuEDTA•2H2O + 2H+6. 根据滴定结果和反应方程式,计算出EDTA标准溶液的浓度C2。
C1V1 = C2V2其中,V2为EDTA标准溶液的体积,单位为mL。
7. 计算出EDTA标准溶液的摩尔浓度C3。
C3 = C2 / M其中,M为EDTA二钠盐的摩尔质量,约为372.24g/mol。
8. 计算出EDTA标准溶液的质量浓度C4。
C4 = C3 × M其中,M为EDTA二钠盐的摩尔质量,单位为g/L。

乙二胺四醋酸二钠滴定液配制与标定记录1滴定液配制1.1仪器天平型号:编号:校准有效期至:20 年月日1.2试剂乙二胺四醋酸二钠厂家:批号:1.3配制方法取乙二胺四醋酸二钠19.0g,加适量的水使溶解成1000ml,摇匀。
配制人/日期:复核人/日期:2基准物准备2.1仪器天平型号:编号:校准有效期至:20 年月日高温电阻炉型号:编号:校准有效期至:20 年月日2.2试剂基准氧化锌厂家:批号:2.3操作取基准氧化锌适量于坩埚中,在约800℃灼烧至恒重。
炽灼至恒重后第一次称量M1:g,炽灼至恒重后第二次称量M2:g,已达恒重。
操作人/日期:复核人/日期:3标定3.1仪器天平型号:编号:校准有效期至:20 年月日3.2试剂基准氧化锌:取2.3中约800℃炽灼至恒重的试剂。
氨试液配制批号:氨-氯化铵缓冲液配制批号:稀盐酸配制批号:铬黑T指示剂配制批号:0.025%甲基红的乙醇溶液配制批号:3.3标定方法取约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少许,滴定至溶液由紫色变为纯蓝色,并将滴定的结果空白试验校正。
每1ml乙二胺四乙酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌,根据滴定液的消耗量与氧化锌的取用量,算出滴定液的浓度。
3.4记录实验室温度℃3.5结论该滴定液浓度为:mol/L,校正因子F为:,标定有效期至:20 年月日结论人/日期:复核人/日期:。

乙二胺四乙酸二钠(EDTA)标准溶液配制标定各浓度EDTA标准滴定溶液配制按表1所表示,称取乙二胺四乙酸二钠二水物(C10H14N2O8Na2· 2H2O)溶于足够量水中,稀释至1L,贮存在聚乙烯容器内。
表 1 称取EDTA质量氧化锌基准溶液按表2所表示,称取已于800℃灼烧1h基准氧化锌置于100mL烧杯中,用少许水湿润,滴加盐酸溶液(1+1)至氧化锌溶解,移入250mL量瓶中,稀释至刻度,混匀。
表 2标定所需氧化锌质量标定氨-氯化铵缓冲溶液(pH≈10)1、称取54g氯化铵溶于水,加350mL氨水,稀释至1L。
2、称取26.7g 氯化铵溶于水,加36mL 氨水,稀释至1L铬黑T 指示液(5g/L)称取0.50g 铬黑T 和4.5g 氯化羟胺,溶于乙醇中,用乙醇稀释至100mL ,贮存于棕色瓶中。
可保持数月不变质。
标定时,用单标线吸管吸收25mL 氧化锌基准溶液于250mL 锥形瓶中,加75mL 水,用氨水(1+1)中和至溶液pH7~8(溶液出现微混浊),加10mL 氨-氯化铵缓冲溶液,5滴铬黑T 指示液,用EDTA 溶液滴定至溶液由紫红色变成纯蓝色为终点。
计算乙二胺四乙酸二钠标准滴定溶液浓度按式(1)计算:c (EDTA)=m/0.08138×V (1)式中:c(EDTA)──乙二胺四乙酸二钠标准滴定溶液之物质量浓度,mol/L ;m──25.0mL 氧化锌基准溶液中所含氧化锌质量,g ; V──滴定用去乙二胺四乙酸二钠溶液实际体积,mL ; 0.08138──和1.00mL 乙二胺四乙酸二钠标准滴定溶液〔 c( EDTA) = 1.000mol/L 〕相当以克表示氧化锌质量。
精密度做五次平行测定,取平行测定算术平均值为测定结果。
五次平行测定极差,应小于表3要求许可差r。
表3EDTA 标准滴定溶液标定许可差稳定性乙二胺四乙酸二钠标准滴定溶液每个月重新标定一次。
来自:。

edta标准溶液的配制与标定EDTA标准溶液的配制与标定。
EDTA(乙二胺四乙酸)是一种重要的螯合剂,广泛应用于化学分析、生物化学和医药等领域。
在实验室中,常常需要配制和标定EDTA标准溶液,以确保实验数据的准确性和可靠性。
本文将介绍EDTA标准溶液的配制与标定方法,希望能对实验工作者有所帮助。
一、EDTA标准溶液的配制。
1. 原料准备。
配制EDTA标准溶液的原料包括EDTA二钠盐(分析纯)、双蒸水(或去离子水)等。
其中EDTA二钠盐需事先干燥,以确保称量时的准确性。
2. 配制步骤。
(1)取适量EDTA二钠盐,通过天平精确称量;(2)将称量好的EDTA二钠盐溶解于双蒸水(或去离子水)中,摇匀溶解;(3)将溶液转移至容量瓶中,并用双蒸水(或去离子水)定容至刻度线,摇匀。
二、EDTA标准溶液的标定。
1. 标定原理。
EDTA标准溶液的标定原理是利用EDTA与金属离子的螯合反应,通过滴定确定金属离子的含量。
常用于标定的金属离子包括镁离子、钙离子等。
2. 标定步骤。
(1)取一定量的待测金属离子溶液,加入pH缓冲液和指示剂;(2)用EDTA标准溶液滴定待测金属离子溶液,直至指示剂出现颜色变化;(3)根据滴定消耗的EDTA标准溶液体积,计算出待测金属离子的含量。
三、注意事项。
1. 配制和标定过程中,需严格控制溶剂的纯度和实验条件,以避免外界因素对实验结果的影响。
2. 在配制EDTA标准溶液时,应严格按照配制步骤操作,避免因操作不当导致溶液浓度偏差。
3. 在标定过程中,需注意滴定时的滴液速度和指示剂的选择,以确保滴定结果的准确性。
4. 定期检验EDTA标准溶液的稳定性和准确性,及时调整溶液浓度,保证实验数据的可靠性。
通过本文的介绍,相信大家对EDTA标准溶液的配制与标定有了更深入的了解。
在实验操作中,严格按照配制和标定步骤进行操作,确保实验数据的准确性和可靠性,是保证实验结果准确的重要保障。
希望本文对大家有所帮助,谢谢阅读!。

乙二胺四乙酸二钠标准滴定溶液的配制与标定方法
(C(1/2EDTA)= 0.1 mol/l
1.主题内容与适用范围
本标准编写了EDTA标准滴定溶液的量浓度为0.1 mol/l时的配制和标定方法。
本标准适用于EDTA标准滴定溶液的量浓度为0.1 mol/l时的配制和标定。
2.配制
2.1称取93 g乙二胺四乙酸二钠,溶于5000 ml离子交换水中。
2.21:1的盐酸溶液:10 ml浓盐酸注入10 ml离子交换水中。
2.3氨-氯化铵缓冲溶液的配制:称取20 g氯化铵,溶于500 ml水中,加100 ml
分析纯浓氨水稀释至1000 ml。
3.标定
3.1标定原理
M2+ + H2Y2- = MY2- +2H+
3.2标定方法
基准锌粒先用1:1盐酸洗涤,然后用离子交换水洗去盐酸,再用丙酮冲洗后,于110 o C下烘数分钟,冷却后精确称取3.2690 g锌粒于干燥的烧杯中,加20 ml 浓盐酸溶解后移入1000 ml容量瓶中,以离子交换水稀至刻度。
用移液管准确移取20 ml锌基准液于250 ml三角瓶中,加10 ml氨缓冲液(pH = 10)再加少许
固体铬黑T指示剂,摇匀,用乙二胺四乙酸二钠溶液滴定至溶液由紫色变纯蓝
色为终点。
3.3标定结果的计算
C(EDTA)= V×C V1
式中:
V为锌基准溶液的用量,ml;
V1为乙二胺四乙酸二钠溶液的用量,ml;
C为锌基准溶液的量浓度,mol/l。
4.注意事项
平行试验间的相对误差不得大于±0.3%。

乙二胺四醋酸二钠滴定液配制与标定标准操作规程目的:建立乙二胺四醋酸二钠滴定液的配制与标定标准操作规程范围:适用于乙二胺四醋酸二钠滴定液配制和标定操作职责:化验室滴定液配制人员及复核员执行标准:2020版《中国药典》通则8006规程:1 滴定液浓度:乙二胺四醋酸二钠滴定液(0.05mol/L)2 分子式和原子量:C10H14N2Na2O8·2H2O=372.243 配制:3.1.1试剂:乙二胺四醋酸二钠。
3.2仪器与用具:电子天平(1/100)、容量瓶(1000ml)3.3作步骤:取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
4标定:4.1试剂:基准氧化锌、稀盐酸、0.025%甲基红的乙醇溶液、氨试液、氨-氯化铵缓冲液(PH10.0)、铬黑T指示剂。
4.2仪器与用具:电热恒温干燥箱、电子天平、烧瓶。
4.3操作步骤:取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml 使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(PH10.0)再加铬黑T指示剂少量,用本液滴定溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
根据本液的消耗量与氧化锌的取样用量,算出本液的浓度,即得。
5复标:按《标定》项下重复检定。
6注意事项:6.1配制过程中,乙二胺四醋酸二钠不易即时完全溶解,可采用加热促使完全溶解,或在配制数日后再行标定。
6.2氧化锌在空气中能缓缓吸收二氧化碳,因此对标定中的基准氧化锌,要强调经800℃灼烧至恒重。
具体操作为:取基准氧化锌约1g ,用玛瑙研钵研细,置具盖磁坩埚中,于800℃灼烧至恒重;移置称量瓶中,密盖,贮于干燥器中备用。
6.3滴定时溶液的PH 值要较严格控制,因此在基准氧化锌约加稀盐酸3ml 与氨-氯化铵缓冲液(PH10.0)10ml ,才能控制溶液的PH 值为10左右。

乙二胺四醋酸二钠滴定液(0.05mol/L) C10H14N2Na2O8•2H2O=372.24 18.61g→1000ml 【配制】 取乙二胺四醋酸二钠19g ,加适量的水使溶解成1000ml ,摇匀。
【标定】 取于约800℃灼烧至恒重的基准氧化锌0.12g , 精密称定,加稀盐酸3ml 使溶解,加水25ml ,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml 与氨-氯化铵缓冲液(pH10.0)10ml , 再加铬黑T 指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml 乙二胺四醋酸二钠滴定液 (0.05mol/L) 相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】 置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
乙醇制氢氧化钾滴定液(0.5mol/L) KOH=56.11 28.06g→1000ml【配制】 取氢氧化钾35g ,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
【标定】 精密量取盐酸滴定液(0.5mol/L)25ml ,加水50ml 稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
【贮藏】 置橡皮塞的棕色玻瓶中,密闭保存。
2008-05-21 21:26 回复凌枫乱舞 54位粉丝 核心会员73楼四苯硼钠滴定液(0.02mo l/L) (C6H5)4BNa=342.22 6.845g→1000ml 【配制】 取四苯硼钠7.0g,加水50ml 振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g ,溶于25ml 水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250ml,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000ml ,摇匀。
理化分析中常用滴定液的配制、标定和贮藏方法汇总!乙二胺四乙酸二钠滴定液(0.05mol/L) C10H14N2Na2O82H2O=372.24 18.61g1000mL 【配制】取乙二胺四乙酸二钠19g,加适量的水使溶解成1000mL,摇匀。
【标定】取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3mL使溶解,加水25mL,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25mL与氨-氯化铵缓冲液(pH10.0)10mL,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1mL乙二胺四乙酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
依据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】置玻璃塞瓶中,避开与橡皮塞、橡皮管等接触。
四苯硼钠滴定液(0.02mol/L) (C6H5)4BNa=342.22 6.845g1000mL 【配制】取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25mL水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250mL,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000mL,摇匀。
【标定】精密量取本液10mL,加醋酸-醋酸钠缓冲液(pH3.7)10mL与溴酚蓝指示液0.5mL,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。
依据烃铵盐滴定液(0.01mol/L)的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
如需用四苯硼钠滴定液(0.01mol/L)时,可取四苯硼钠滴定液(0.02mol/L)在临用前加水稀释制成。
必要时标定浓度。
【贮藏】置棕色玻瓶中,密闭保存。
亚硝酸钠滴定液(0.1mol/L) NaNO2=69.00 6.900g1000mL【配制】取亚硝酸钠7.2g,加无水碳酸钠(Na2CO3) 0.10g,加水适量使溶解成1000mL,摇匀。
乙二胺四乙酸二钠标准溶液的配制和标定方法=0.01mol/L][CEDTA1、适用范围:本标准适用于EDTA标准滴定溶液的量浓度为0.01mol/L的配制和标定。
2、试剂:2.1 乙二胺四乙酸二钠盐:分析纯2.2 氧化锌:基准物2.3 浓盐酸:分析纯2.5 氯化铵:分析纯2.6 浓氨水:分析纯2.5 酸性铬蓝K:称取0.5g酸性铬蓝K与4.5g盐酸羟胺,加入10ml氨性缓冲溶液和40ml蒸馏水,溶解后,用无水乙醇溶液定容至100ml.2.6 10%氨水:移取44ml 25%的浓氨水,加水稀释并定容至100ml。
2.7 氨性缓冲溶液的配制:称取10g氯化铵,溶于250ml水中,加50ml分析纯浓氨水稀释至500ml。
2.8 20%HCl:移取50ml浓盐酸,加入少量蒸馏水并定容至100ml.3、仪器:3.1 容量瓶:1000ml 1个;100ml 3个;500ml 1个3.2 试剂瓶:1L 1个;500ml 1个3.3 烧杯:100ml 1个3.4 移液管:10ml,20ml各1个3.5 三角烧瓶:250ml 6个3.6 碱式滴定管:50ml3.7 量筒4、配制:称取4克乙二胺四乙酸二钠盐溶解1000ml温热蒸馏水中,摇匀,冷却。
5、标定:5.1 方法提要Y2—→ MY2—+2H+M2++H25.2 标定方法:称取0.5g于800℃灼烧至恒重的基准氧化锌,称准至0.0001g,用少量水湿润,加少量(约5~10ml )20%盐酸溶液使样品溶解,移入500ml 容量瓶中,用水稀释至刻度,摇匀,储存于棕色试剂瓶中。
(ZnO 的质量浓度0.5g/500ml)吸取25.00ml 上述溶液,用10%氨水调pH 至7~8之间,加入10ml 氨性缓冲溶液及5滴酸性铬蓝K 指示剂,用配制好的EDTA 溶液标定至溶液由紫色变为纯蓝色。
同时作空白试验。
5.3 标定结果的计算:式中:W —氧化锌的质量,g ;V —ZnO 溶液的用量,mlV 1—乙二胺四乙酸二钠溶液的用量,ml ;V 0—空白试验所耗乙二胺四乙酸二钠溶液的用量,ml 。
乙二胺四醋酸二钠滴定液(0.05mol/L)配制与标定操作规程目的:建立乙二胺四醋酸二钠滴定液配制与标定的操作规程。
范围:本法规定了乙二胺四醋酸二钠滴定液(0.05mol/L)配制标定的方法和操作要求;适用于本公司实验用乙二胺四醋酸二钠滴定液(0.05mol/L)的配制、标定与复标。
职责:质检员、QC经理、质量总监对本规程实施负责。
依据:中国药典2015年版四部误差要求:规程:1 试剂、指示剂:1.1 乙二胺四醋酸二钠(AR)1.2 稀盐酸:取盐酸234ml,加水稀释至1000ml,即得。
1.3 0.025%甲基红的乙醇溶液:取甲基红0.025g,加乙醇适量使溶解成100ml,摇匀,即得。
1.4 氨试液:取浓氨溶液400ml,加水使成1000ml,即得。
1.5 氨—氯化铵缓冲液(PH10.0):取氯化铵5.4g,加水20ml溶解后,加浓氨溶液35ml,再加水稀释至100ml,即得。
1.6 铬黑T指示剂:取铬黑T0.1g,加氯化钠10g,研磨均匀,即得。
2基准试剂:2.1 基准氧化锌3仪器与用具3.1 三角烧瓶(200ml)3.2 滴定管(50ml)4 操作步骤:4.1 C10H14N2Na2O8·2H2O=372.24 18.61g→1000ml4.2 配制取乙二胺四乙酸二钠19g,加适量的水使溶解成1000ml,摇匀。
4.3 标定取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色。
加水25ml 与氨—氯化铵缓冲液(PH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
根椐本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
4.4 计算公式:MF= ×0.05(Vi-Vo) × 4.069式中: M:基准氧化锌的称取量(mg);Vi:滴定所耗胺四乙酸二钠滴定液的体积(ml);Vo:空白试验所耗乙二胺四乙酸二钠滴定液的体积(ml)。
edta标准溶液的配制与标定EDTA标准溶液的配制与标定。
EDTA(乙二胺四乙酸)是一种常用的螯合剂,广泛应用于化学分析和实验室研究中。
配制和标定EDTA标准溶液是实验室常规操作,本文将介绍EDTA标准溶液的配制方法和标定步骤。
一、配制EDTA标准溶液。
1. 基本原理。
EDTA标准溶液的配制是通过称取一定质量的EDTA固体,溶解并定容至一定体积的溶剂中,制备出一定浓度的EDTA标准溶液。
通常情况下,EDTA标准溶液的浓度为0.01mol/L。
2. 配制步骤。
(1)准备所需试剂和仪器,EDTA固体、蒸馏水、容量瓶、电子天平等。
(2)称取一定质量的EDTA固体,根据所需配制的体积和浓度,计算出所需的EDTA固体质量,并用电子天平准确称取。
(3)溶解EDTA固体,将称取的EDTA固体加入一定量的蒸馏水中,用磁力搅拌器搅拌至完全溶解。
(4)定容至标定体积,将溶解好的EDTA溶液转移至容量瓶中,用蒸馏水定容至刻度线,摇匀混合即可。
二、EDTA标准溶液的标定。
1. 基本原理。
EDTA标准溶液的标定是通过滴定法,用标准的金属离子溶液(如标准锌离子溶液)与EDTA标准溶液进行反应,根据化学计量的原理,计算出EDTA标准溶液的准确浓度。
2. 标定步骤。
(1)准备所需试剂和仪器,EDTA标准溶液、标准金属离子溶液(如锌离子溶液)、指示剂(如二甲基黄溴酚磺酸钠)、滴定管、容量瓶等。
(2)取适量标准金属离子溶液,用容量瓶准确取适量标准金属离子溶液。
(3)加入指示剂,在标准金属离子溶液中加入少量指示剂,使其呈现特定颜色。
(4)滴定,用EDTA标准溶液从滴定管中滴定至标准金属离子溶液中,直至指示剂颜色发生明显变化,记录消耗的EDTA标准溶液体积。
(5)计算浓度,根据滴定结果和标准金属离子溶液的浓度,利用滴定反应的化学计量关系,计算出EDTA标准溶液的准确浓度。
通过以上配制和标定步骤,可以准确制备和确认EDTA标准溶液的浓度,保证实验数据的准确性和可靠性。
乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定1 试剂乙二胺四乙酸二钠(EDTA)氧化锌(基准试剂)。
盐酸溶液(1+1)。
10%氨水。
氨-氯化铵缓冲溶液:配制方法见“SS-14-1-84”。
%铬黑T指示剂(乙醇溶液):配制方法见“SS-14-1-84”。
2 操作步骤0.05M、0.02M EDTA标准溶液的配制与标定:2.1.1 EDTA标准溶液的配制:1) 0.05M EDTA溶液:称取20g乙二胺四乙酸二钠溶于1 L蒸馏水中,摇匀。
2) 0.02M标准溶液:称取8g乙二胺四乙酸二钠溶于1 L高纯水中,摇匀。
2.1.2 EDTA标准溶液的标定:1)标准溶液的标定:称取于800℃灼烧至恒重的基准氧化锌1g(称准至),用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.05M EDTA溶液滴定至溶液由紫色变为纯兰色。
2)0.02M EDTA标准溶液的标定:称取0.4g(称准至)于800℃灼烧至恒重的基准氧化锌用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml 容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.02M EDTA溶液滴定至溶液由紫色变为纯兰色。
EDTA标准溶液的摩尔浓度(M)按下式计算:G 20 0.08G⊿V = —————×———— = —————V× 250 V×式中 G——氧化锌之重,g;V——滴定时消耗EDTA溶液的体积,ml;——250ml中取20ml滴定,相当于G的倍;——每毫摩尔氧化锌(ZnO)的重量,g。
0.001M EDTA 标准溶液饿配制和标定:2.2.1 配制:取0.05M EDTA 标准溶液,准确地稀释至50倍制得。
edta标准溶液的配制与标定EDTA(乙二胺四乙酸)是一种常用的金属离子螯合剂,可以与金属离子形成稳定的络合物。
在化学分析中,常常需要使用EDTA标准溶液来进行配制和标定。
本文将介绍EDTA标准溶液的配制方法和标定步骤。
一、EDTA标准溶液的配制1. 配制EDTA溶液的原料:(1)乙二胺四乙酸二钠(Na2H2Y·2H2O):纯度要求较高,可购买实验室常用试剂。
(2)蒸馏水:用于配制溶液的稀释。
2. 配制EDTA溶液的步骤:(1)称取适量的乙二胺四乙酸二钠(Na2H2Y·2H2O),计量精确,一般取0.5克。
(2)将称取的乙二胺四乙酸二钠溶解于1000毫升蒸馏水中,并用玻璃棒搅拌均匀。
3. 调整EDTA溶液的浓度:(1)取适量EDTA溶液,使用容量瓶定容至1000毫升,得到初始浓度为C1的EDTA溶液。
(2)取适量C1的EDTA溶液,使用容量瓶定容至1000毫升,得到所需浓度为C2的EDTA溶液。
二、EDTA标准溶液的标定1. 标定前的准备工作:(1)准备好所需标定的金属离子溶液,例如钙离子溶液。
(2)根据实验要求,调整溶液的pH值,一般使用酸或碱进行调节。
2. EDTA标定的步骤:(1)取一定体积的金属离子溶液,转移至滴定瓶中。
(2)加入适量pH缓冲剂和指示剂,例如甲基橙指示剂。
(3)用EDTA溶液滴定至指示剂变色终点,记录所需的滴定体积V1。
(4)重复上述步骤3次,计算平均滴定体积V。
3. 计算标定结果:根据反应方程式和化学计量关系,计算出金属离子的摩尔浓度,并与实际浓度进行比较。
三、注意事项:1. 在配制和标定EDTA溶液时,应注意实验室操作规范,避免误差产生。
2. 在标定过程中,应注意滴定时机和滴定速度,避免过量或不足。
3. 标定结果应与其他方法进行比较验证,确保准确性和可靠性。
通过以上步骤,我们可以成功配制和标定EDTA标准溶液。
在实际应用中,可以根据需要调整EDTA溶液的浓度和标定不同金属离子。
乙二胺四醋酸二钠滴定液配制与标定的标准操作程序
一、目 的:建立乙二胺四醋酸二钠滴定液(0.05mol/L )配制与标定的标准操作程序。
二、依据:《中华人民共和国药典》2010 年版一部。
三、适用范围:适用于本公司乙二胺四醋酸二钠滴定液(0.05mol/L )的配制、标定与复标工作。
四、职 责:质量检验主任、滴定液配制人、复标人、检验员对本标准的实施负责。
五、操作程序:
1、试剂:
①基准氧化锌 ② 0.025%的甲基红的乙醇溶液 ③ 氨-氯化铵缓冲液(pH10.0)④稀盐酸 ⑤氨试液 ⑥铬黑T 指示剂 ⑦乙二胺四醋酸二钠
2、仪器和用具:
①烧杯250ml ②量筒 5ml 25ml ③移液管10ml ④碱式滴定管50ml ⑤天平 ⑥称量瓶 ⑦容量瓶1000mL ⑧铁架台
3、分子式和分子量:
C10H14N2Na2O8·2H2O 372.24
4、配制: 18.61g →1000ml
取乙二胺四醋酸二钠19g ,加适量的水使溶解成1000ml ,摇匀。
5、标定:
取于约800℃灼烧至恒重的基准氧化锌0.12g ,精密称定,加稀盐酸3ml 使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml 与氨-氯化铵缓冲液(pH10.0)10ml ,再加铬黑T 指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml 乙二胺四醋酸二钠滴定液(0.05mol/L )相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
6、计算: C (mol/L )=
式中 M 为基准氧化锌的称取量(mg );
V1 为滴定中本滴定液的用量(ml );
V2 为空白实验中本滴定液的用量(ml );
4.069 为与每1ml 的乙二胺四乙酸二钠滴定液(0.05mol/L )相当以毫克表示的氧
M (V1-V2)×81.38
化锌的质量。
7、注意事项:
7.1 贮藏置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
7.2 乙二胺四醋酸二钠与金属离子络合的内络合物的稳定度与介质中的氢离子浓度有密切的关系,pH值愈高,络合物愈稳定,但滴定时pH 值也不能太高,以免金属离子形成氢氧化物沉淀,溶解氧化锌时加有稀盐酸,因此在滴定前,要加0.025%甲基红的乙醇溶液为指示剂以氨试液中和后,再加氨-氯化铵缓冲液,以调整溶液的pH值在10左右,以便在此pH范围内适合于铬黑T(pH7~10)的颜色变化。
氨-氯化铵缓冲液含有NH3,因此也起到辅助络合剂的作用,以防止Zn2+的水解沉淀。
7.3 氧化锌易吸收二氧化碳形成碳酸锌,800℃灼烧时使碳酸锌分解,全部变成氧化锌。