第12章 电位分析及离子选择性电极分析法(S)
- 格式:ppt
- 大小:1.27 MB
- 文档页数:85



电位分析法1 前言从热力学角度讲,电化学是研究化学能于电能之间相互转变及其所遵循基本规律或规则的一门学科;从动力学角度而言,电化学是研究电解质离子在溶液中运动及电解质溶液与电极表面发生反应所遵循的基本规律。
而电分析化学则是利用物质(电解质)的物理性质及电化学性质来测定物质组成和含量的一种分析方法。
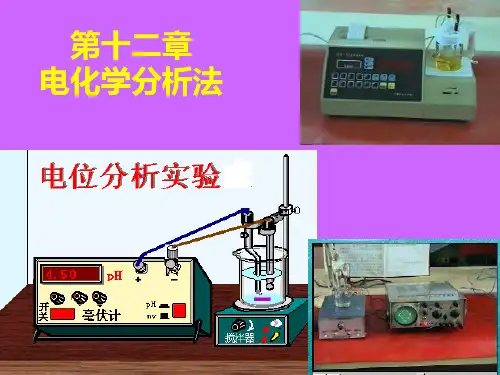
电位分析是利用电极电位和溶液中某种离子的活度(或浓度)之间的关系来测定被测物质的活度(或浓度)的一种电化学分析法,它是以测量电池电动势为基础。
其化学电池的组成是以待测试液为电解质溶液,并于其中插入两支电极,一支是电极电位与被测试液的活度(或浓度)有定量关系的指示电极;另一支是电位稳定不变的参比电极。
通过测量电池的电动势来确定被测物含量。
电位分析法根据其原理的不同可分为直接电位法和电位滴定法两大类。
直接电位法是通过测量电池电动势来确定指示电极的电位,然后根据Nernst方程,由所测得的电极电位值计算出被测物质的含量。
电位滴定法是通过测量滴定过程中指示电极的电位变化来确定滴定终点,再按滴定所消耗的标准溶液的体积和浓度来计算待测物质含量。
该法实际上是一种容量分析法。
20世纪60年代末由于膜电极技术的出现,相继成功研制了多种具有良好选择性的指示电极,即离子选择性电极(ISEs)。
离子选择性电极的出现和应用,促进了电位分析法的发展,并使其应用有了新的突破。
电位分析法具有如下特点:选择性高,在多数情况下,存在离子干扰很小,对组成复杂性的试样往往不需要经过分离处理可直接测定,且灵敏度高。
直接电位法的相对检出限量一般为10-5~10-8mol/dm3,特别适用于微量成分的测定;而电位滴定法则适用于常量分析,仪器设备简单、操作方便,易于实现分析的自动化,试液用量小,并可做无损分析和原位测量。
因此,电位分析法的应用范围很广,尤其是离子选择性电极,现已广泛应用于环保、医药、食品、卫生、地质探矿、冶金、海洋探测等各个领域,并已成为重要的测试手段。







现代仪器分析习题解答 2009年春第12章电位分析及离子选择性电极分析法 P2161.什么是电位分析法?什么是离子选择性电极分析法?答:利用电极电位和溶液中某种离子的活度或浓度之间的关系来测定待测物质活度或浓度的电化学分析法称为电位分析法。
以离子选择性电极做指示电极的电位分析,称为离子选择性电极分析法。
2.何谓电位分析中的指示电极和参比电极?金属基电极和膜电极有何区别?答:电化学中把电位随溶液中待测离子活度或浓度变化而变化,并能反映出待测离子活度或浓度的电极称为指示电极。
电极电位恒定,不受溶液组成或电流流动方向变化影响的电极称为参比电极。
金属基电极的敏感膜是由离子交换型的刚性基质玻璃熔融烧制而成的。
膜电极的敏感膜一般是由在水中溶解度很小,且能导电的金属难溶盐经加压或拉制而成的单晶、多晶或混晶活性膜。
4. 何谓TISAB溶液?它有哪些作用?答:在测定溶液中加入大量的、对测定离子不干扰的惰性电解质及适量的pH缓冲剂和一定的掩蔽剂,构成总离子强度调节缓冲液(TISAB)。
其作用有:恒定离子强度、控制溶液pH、消除干扰离子影响、稳定液接电位。
5. 25℃时,用pH=4.00的标准缓冲溶液测得电池:“玻璃电极|H+(a=X mol?L-1)║饱和甘汞电极”的电动势为0.814V,那么在c(HAc)=1.00×10-3 mol?L-1的醋酸溶液中,此电池的电动势为多少?(KHAc=1.8×10-5,设aH+=[H+])解:∵E1=φ(+)--φ(-)=φ(+)-(K-0.0592pH1)E2=φ(+)--φ(-)=φ(+)-(K-0.0592pH2)∴E2- E1= E2-0.814=0.0592(pH2- pH1)∴E2=0.814+0.0592(-lg√Kc-4.00)=0.806(V)6.25℃时,用pH=5.21的标准缓冲溶液测得电池:“玻璃电极|H+(a=X mol?L-1)║饱和甘汞电极”的电动势为0.209V,若用四种试液分别代替标准缓冲溶液,测得电动势分别为①0.064V;②0.329V;③0.510V;④0.677V,试求各试液的pH和H+活度解:(1)ΔE1=0.064-0.209=0.0592(pH1-pHs)∵pHs=5.21∴pH1=2.76 aH+=1.74×10-3 mol?L-1(2)ΔE2=0.329-0.209=0.0592(pH2-pHs)∵pHs=5.21∴pH2=7.24 aH+=5.75×10-8 mol?L-1(3)ΔE3=0.510-0.209=0.0592(pH3-pHs)∵pHs=5.21∴pH3=10.29 aH+=5.10×10-11 mol?L-1(4)ΔE4=0.677-0.209=0.0592(pH4-pHs)∵pHs=5.21∴pH4=13.12 aH+=7.60×10-14 mol?L-17.25℃时,电池:“镁离子电极|Mg2+(a=1.8×10-3mol?L-1)║饱和甘汞电极”的电动势为0.411V,用含Mg2+试液代替已知溶液,测得电动势为0.439V,试求试液中的pMg值。