研究性学习一例-铝与稀盐酸和稀硫酸反应的差异探究
- 格式:doc
- 大小:42.50 KB
- 文档页数:3
铝与酸反应的再探究摘要铝很难和稀硫酸等酸反应的真正原因是什么?本文通过在稀硫酸中引入卤素离子的实验、铝等常见金属与有机酸反应的实验,并引用科学可靠的文献,从实验和理论的角度来进行深入的探究。
笔者的结论是铝表面的氧化膜十分致密、牢固,SO42-和有机酸根离子无法穿透这层氧化膜,也无法与Al3+形成配离子,所以在常温下铝与稀硫酸及有机酸几乎不发生反应。
关键词铝与酸反应氧化膜穿透作用配位作用Al是一种比较活泼的金属,但Al与稀硫酸等酸混合后却出现了很难反应的“异常现象”。
对于这种特殊性,笔者在《化学教学》2009年第1期上看到了这样一段描述:“我们认为,Al跟稀硫酸反应的这种特殊性,正是Al这种金属的个性使然,而不是什么铝表面的氧化膜(钝化)所致”。
笔者认为,把Al与稀硫酸等酸反应的特殊性归结为Al的个性使然,这种说法是不能令人信服的,有值得商榷的地方。
为了弄清楚其中的正确原因,我们进行了如下的探究实验。
实验1 取四支相同试管,分别放入两根刚用砂纸仔细打磨过的2 cm左右的铝丝,加入体积比为1:5的稀硫酸4 mL,几乎观察不到明显的现象。
再用相同大小的滴管分别吸取物质的量浓度都同为0.1 mol/L的NaF、NaCl、NaBr、KI 四种溶液,滴入上述反应混合物中,边加边振荡,等均匀混合后静置,记录当产生可观察的气泡时所需要的四种溶液的滴数。
实验数据如下表1:实验分析:笔者初步认定,Al和稀硫酸的反应与引入的卤素离子有关系,可能是卤素离子破坏了铝表面的氧化膜所致。
实验2 为了再次证明氧化膜对铝有保护作用,我们想到用物理方法来破坏氧化膜,于是我们又做了如下的实验。
把光亮的铝箔浸入稀硫酸中,几乎没有任何明显现象。
然后,让铝箔继续浸没在稀硫酸中,我们用尖锐的玻璃片在铝箔上用力来回锉动,会观察到铝箔表面产生了一些非常细小的气泡,这些气泡分散到溶液中,形成淡淡的白雾状。
但停止锉动后,这一现象很快就终止了,反应趋于停止。

铝和稀盐酸稀硫酸反应方程式【摘要】铝和稀盐酸、稀硫酸的反应方程式是化学实验中常见的反应,具有重要的实验价值。
本文首先介绍了铝和稀盐酸的反应条件和过程,然后分别列出了铝和稀盐酸、稀硫酸的反应方程式。
在反应中,生成气体是一个关键的观察现象,需要对其进行实验观察。
在指出了该反应方程式的应用以及实验过程中需要注意的事项,同时展望了未来可能的研究方向。
该实验能够帮助学生加深对化学反应的理解,同时培养实验技巧和数据分析能力。
通过深入研究铝和稀盐酸、稀硫酸的反应方程式,不仅可以加深对化学反应的认识,也为其在工业生产中的应用提供了有益的参考。
【关键词】铝、稀盐酸、稀硫酸、反应条件、反应过程、反应方程式、气体、应用、注意事项、结论、展望。
1. 引言1.1 铝和稀盐酸稀硫酸反应方程式的重要性铝和稀盐酸、稀硫酸反应是化学中常见的反应之一。
这个反应在实验室和工业生产中都有着重要的应用。
铝和稀盐酸、稀硫酸反应方程式的研究有利于我们深入了解金属与强酸的反应规律,从而促进相关领域的发展。
该反应方程式的探究不仅可以拓展我们对金属和酸的认识,还有助于探索新的应用领域。
通过研究铝和稀盐酸、稀硫酸反应的方程式,我们可以更好地理解金属在酸性环境中的化学性质,加深对金属与酸之间的反应机制的认识。
这对于我们在生产和实验中选择合适的金属材料和酸性溶液具有重要指导作用。
研究铝和稀盐酸、稀硫酸反应方程式也可以为相关工业生产提供参考,帮助优化生产工艺,提高生产效率。
铝和稀盐酸、稀硫酸反应方程式的研究具有重要的科学意义和应用价值,对于化学领域的发展和相关行业的进步都具有积极的促进作用。
我们应该继续深入探究这个反应,不断拓展其应用范围,为科学研究和工程实践提供更多可能性。
2. 正文2.1 铝和稀盐酸的反应条件1. 温度:反应需要在适当的温度下进行。
一般来说,温度越高,反应速率越快,但不能太高以致引起不必要的热量损失或危险。
2. 浓度:稀盐酸的浓度对反应速率有影响。

金属与稀盐酸和稀硫酸的反应规律一、引言金属与稀盐酸和稀硫酸的反应一直是化学实验中常见的实验内容。
通过观察金属与稀盐酸和稀硫酸的反应,可以深入了解金属与酸反应的规律,为进一步学习金属与酸的化学性质奠定基础。
本文将系统介绍金属与稀盐酸和稀硫酸的反应规律,以便读者对此类反应有更深入的了解。
二、金属与稀盐酸的反应规律1. 钠与稀盐酸的反应规律钠是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化钠,并伴有剧烈的放热现象。
化学方程式为:2Na + 2HCl → 2NaCl + H2↑。
2. 镁与稀盐酸的反应规律镁是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化镁。
镁与盐酸的反应速度较快,但放热不如钠。
化学方程式为:Mg + 2HCl → MgCl2 + H2↑。
3. 铝与稀盐酸的反应规律铝是一种较活泼的金属,但铝表面的氧化膜会限制其与酸反应速度。
在稀盐酸中,铝表面的氧化膜会溶解,继而与盐酸发生反应,产生氢气和氯化铝。
化学方程式为:2Al + 6HCl → 2AlCl3 + 3H2↑。
4. 锌与稀盐酸的反应规律锌是一种活泼的金属,与稀盐酸会产生氢气和氯化锌。
锌与盐酸的反应速率较快,但放热不及钠。
化学方程式为:Zn + 2HCl → ZnCl2 +H2↑。
5. 铁与稀盐酸的反应规律铁是一种较活泼的金属,与稀盐酸会产生氢气和氯化铁。
铁与盐酸的反应速率较慢,但放热较大。
化学方程式为:Fe + 2HCl → FeCl2 +H2↑。
三、金属与稀硫酸的反应规律1. 钠与稀硫酸的反应规律钠与稀硫酸反应会产生硫化氢气和亚硫酸钠,并伴有放热现象。
化学方程式为:2Na + H2SO4 → Na2SO3 + H2S↑。
2. 镁与稀硫酸的反应规律镁与稀硫酸反应会产生硫化氢气、硫酸镁和水。
镁与硫酸反应速率较慢,但放热较大。
化学方程式为:Mg + H2SO4 → MgSO4 + H2S↑。
3. 铝与稀硫酸的反应规律铝与稀硫酸反应会产生硫化氢气、亚硫酸铝和水。

課題《居家化學實驗探究》由澳門科學技術發展基金資助鋁和稀鹽酸,稀硫酸的反應指導老師:康玉專小組組員: 楊海晴(15號)鄭書玉(20號)鄧嘉怡(21號)戴詠雅(22號)2016年5月目錄壹、課題研究動機 (3)貳、課題研究方向 (3)參、研究試劑和器材 (3)肆、研究過程(研究步驟、結果與討論) (4)一、氫離子濃度對反應的影響 (4)二、去膜的鋁與鹽酸、硫酸反應 (5)三、C l-對反應的影響……………………………5-6四、S O42-對反應的影響…………………………6-7 伍、結論…………………………………………………………….7-8鋁和稀鹽酸、稀硫酸的反應小組成員:楊海晴(15)、鄭書玉(20)、鄧嘉怡(21)、戴詠雅(22)壹、課題研究動機高一的化學課程───鋁及其化合物,是最吸引我們的一環,更令我們感興趣的是鋁的化學實驗。
其中我們最好奇的是鋁和稀鹽酸以及和稀硫酸的反應。
平常讓人感到難以接觸到的,在化學課堂上較少能夠深究的,我們都很難親身去嘗試到的實驗課程,終於可借此體驗一番,真是令人興奮不已。
課餘閒聊之時,突然靈機一觸:為什麼老師再演示實驗過程時會特別強調所用酸的不同濃度。
如果做實驗的時候,參與實驗的化學品換作是另一濃度的酸,那麼實驗結果是否會有所變化呢?我們做出來效果是否與老師所演示的差不多呢?於是我們決定以此作為專題報告,開始我們的鋁的實驗大變身──鋁和稀鹽酸,稀硫酸的實驗。
貳、課題研究方向一、氫離子濃度對反應的影響二、去膜的鋁與鹽酸、硫酸反應三、Cl-對反應的影響四、SO42-對反應的影響參、研究試劑和器材一、藥品:鋁片、硫酸、鹽酸、氯化鈉、硫酸鈉二、器材:試管、燒杯、砂紙、膠頭滴管、鑷子、酒精燈肆、研究過程(研究步驟、結果與討論)一、氫離子濃度對反應的影響(一)、實驗步驟:(二)、討論:比較①②或③④可以得出,氫離子濃度相等的鹽酸、硫酸與鋁反應的速率有差異。
鋁與稀硫酸反應的現象並不明顯,而鋁與稀鹽酸反應現象很明顯。

铝和稀盐酸的化学现象全文共四篇示例,供读者参考第一篇示例:铝和稀盐酸的化学反应是一种常见且具有重要意义的化学现象。
在这个反应中,铝与稀盐酸发生置换反应,生成氢气和相应的盐。
在这篇文章中,我们将详细探讨铝和稀盐酸之间的化学现象,并解释其背后的原理。
让我们简要介绍一下反应过程。
当固态铝与稀盐酸(即氯化氢溶液)发生反应时,铝原子会与氯离子结合,生成氯化铝并放出氢气。
反应的化学方程式如下所示:2Al + 6HCl → 2AlCl3 + 3H2在这个方程式中,可以看到铝和稀盐酸之间发生了置换反应,同时产生了氯化铝和氢气。
氢气在该反应中以气体的形式释放出来,通常会产生气泡,并且可以通过点火测试来证实其存在。
那么,这一反应背后的原理是什么呢?铝和稀盐酸之间的反应其实是一种氧化还原反应。
在这个反应中,铝原子被氯离子氧化,同时氢离子被还原。
铝原子失去电子变成铝离子,而氢离子获得电子变成氢气。
这种电子转移过程导致了反应的发生,形成了氯化铝和氢气。
除了氧化还原反应外,铝和稀盐酸的反应还涉及到酸碱中和反应。
在这个反应中,氯化铝属于盐类,它是由金属离子和非金属离子结合而成。
氢气则是酸碱中和反应的产物,它来自于酸性物质氯化氢溶液。
铝和稀盐酸的化学反应是一种重要的化学现象,它展示了金属与酸之间的化学相互作用。
这一反应不仅有助于我们理解氧化还原和酸碱中和的原理,也在实际应用中具有广泛的意义。
通过深入研究这一反应,我们可以更好地理解金属与酸的反应机理,为进一步的实验和应用奠定基础。
希望这篇文章能够帮助读者更好地理解铝和稀盐酸之间的化学现象,进一步拓展化学知识。
【未完】第二篇示例:铝和稀盐酸的化学反应是一种常见的实验现象,也是学习化学的基础实验之一。
铝是一种常见的金属材料,而稀盐酸则是一种常用的强酸。
当这两种物质发生反应时,会产生一系列有趣的化学变化。
本文将详细介绍铝和稀盐酸的化学现象及其相关知识。
一、铝和稀盐酸的基本概念1. 铝:铝是一种常见的金属材料,具有良好的导电性和导热性,广泛用于工业生产和日常生活中。



铝在酸溶液中的点腐蚀过程摘要:文章在梳理了已有的关于铝与盐酸、硫酸反应的研究的基础上,尝试从动力学的角度分析了铝在盐酸中的点腐蚀过程。
关键词:铝与酸反应点腐蚀腐蚀机理1.已有研究的概述中学化学中,铝与HCl、H2SO4的反应是两个常见而且重要的化学反应,从离子角度分析,二者的反应实质相同,可表示为:2Al + 6H+=Al3++3H2↑。
由浓度对反应速率的影响可知,在其它条件相同的情况下,等物质的量浓度的HCl、H2SO4分别与铝反应时,由于H2SO4溶液中的H+浓度比HCl中的大,则后者的反应速率应该比前者大。
但实验表明,铝与HCl反应非常剧烈,而与H2SO4几乎观察不到有气体放出。
这种实验现象与理论推断的矛盾,给中学化学中关于“铝及其化合物”的教学造成了极大的困惑,面对学生的质疑,教师无法给出合理的解释。
基于此,近年来不断有教师在探究铝与酸反应的机理,试图找出导致铝与HCl、H2SO4的反应现象差异的根本原因。
梳理已有的关于HCl、H2SO4的反应的研究,发现主要集中在如下两个方面:一是铝与HCl、H2SO4的反应快慢的实验研究,二是关于铝与HCl、H2SO4反应快慢的原因的分析。
1.1关于铝与酸反应快慢的研究已有实验表明,除去氧化膜的铝片,分别加入到相同物质的量浓度的HCl、H2SO4的溶液中,发现铝与HCl能够剧烈反应,而铝在与H2SO4溶液中,开始时有极少量气泡产生,但很快便会中止[1]。
对比实验表明,在铝与H2SO4反应的试管中,加入少量固体NaCl粉末则能够加快反应速率。
说明Cl-参与了铝与H+的反应过程,使反应速率加快[2]。
1.2 铝与酸反应快慢的原因分析关于氯离子影响铝与酸反应速率的原因,已有的解释主要有如下两种观点。
一种观点认为,由于Cl-半径小,穿透能力强,故容易穿透氧化膜内极小的孔隙,到达金属表面,使金属发生腐蚀。
另一种观点则认为,Cl-破坏氧化膜的根本原因是由于Cl-极易被金属吸附,优先被吸附在铝的氧化膜上,并把表面氧化膜中的氧原子排除掉 [3]。
![2024年秋高一化学校本课程 第11、12课时 [实验问题专题研究] 《铝的两性探秘》课题](https://uimg.taocdn.com/790c3ba94793daef5ef7ba0d4a7302768f996f50.webp)
●第11、12课时●[实验问题专题研究] 《铝的两性探秘》课题1.在实验中捕捉疑点(问题)在化学实验中我们经常碰到与教材或参考书中描述不尽相同的实验现象,平时只要注意观察和记录,就会发现和捕捉到许多实验疑点问题。
如铝是两性金属,跟稀酸和强碱都发生反应,这是许多书中共同的一个观点。
但是在实际应用中发现,铝跟硫酸在常温下不能反应,而铝跟氨水在常温下也能反应。
疑点之一:铝跟盐酸能发生激烈反应放出氢气,而铝跟硫酸难发生激烈反应,只是缓慢地发生反应,在不加热或加热停止后往往不易观察到气泡发生,为什么会有如此大的差异呢?硫酸浓度对铝跟硫酸反应速度的影响有多大?疑点之二:铝能跟强碱溶液发生激烈反应生成氢气和偏铝酸盐;一次学生实验中,学生尝试实验发现铝跟氨水也能缓慢地发生反应,在加热条件下反应剧烈;查找各类资料,均未能找到有关铝跟氨水(弱碱)反应的的报导;是有意回避?还是另有原因?2.查阅资料(背景考察)如:①中国大百科全书化学Ⅱ711页对铝化学性质有关描述:铝是两性的,既易溶于强碱形成铝酸盐和氢:2Al+2OH-+6H2O→2Al(OH)4-+3H2也能溶于稀酸,生成相应的铝盐和氢:2Al+6H3O+→2Al(H2O)63++3H2但铝的纯度越高,与酸的反应越慢,99.95%以上的纯铝只溶于王水,在冷的浓硫酸和浓硝酸中铝表面被钝化。
②中国大百科全书化学Ⅰ553页金属钝化有关描述:铝的钝化膜为无孔的γ-Al2O3,上面再覆盖以多孔的β-Al2O3。
③中学化学实验参考书《由实验学化学》[日]绵拔邦彦等编:金属铝的表面被氧化,生成一层硬氧化膜,保护内部的金属,这叫耐酸铝。
铝饭盒的表面的这种处理,是大家很熟悉的。
铝跟氧化性的酸反应,表面生成这种氧化膜,就不能再反应。
(49页)铝跟H2SO4(3M)难发生激烈反应,只是慢慢地发生下列反应,生成硫酸铝。
(52页)④高中化学下册教学参考书:铝跟酸的反应使学生通过铝跟稀盐酸、稀硫酸的反应来认识铝的活动性,……所用盐酸、稀硫酸的浓度不应低于4摩尔/升。
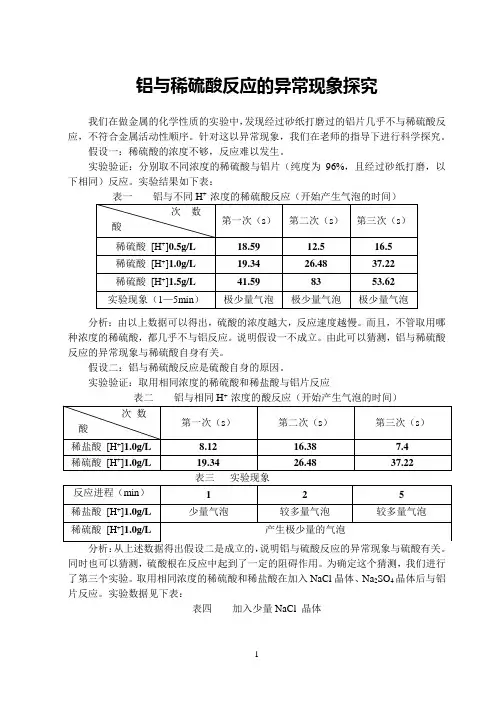
铝与稀硫酸反应的异常现象探究我们在做金属的化学性质的实验中,发现经过砂纸打磨过的铝片几乎不与稀硫酸反应,不符合金属活动性顺序。
针对这以异常现象,我们在老师的指导下进行科学探究。
假设一:稀硫酸的浓度不够,反应难以发生。
实验验证:分别取不同浓度的稀硫酸与铝片(纯度为96%,且经过砂纸打磨,以下相同)反应。
实验结果如下表:表一铝与不同H+ 浓度的稀硫酸反应(开始产生气泡的时间)分析:由以上数据可以得出,硫酸的浓度越大,反应速度越慢。
而且,不管取用哪种浓度的稀硫酸,都几乎不与铝反应。
说明假设一不成立。
由此可以猜测,铝与稀硫酸反应的异常现象与稀硫酸自身有关。
假设二:铝与稀硫酸反应是硫酸自身的原因。
实验验证:取用相同浓度的稀硫酸和稀盐酸与铝片反应+分析:从上述数据得出假设二是成立的,说明铝与硫酸反应的异常现象与硫酸有关。
同时也可以猜测,硫酸根在反应中起到了一定的阻碍作用。
为确定这个猜测,我们进行了第三个实验。
取用相同浓度的稀硫酸和稀盐酸在加入NaCl晶体、Na2SO4晶体后与铝片反应。
实验数据见下表:表四加入少量NaCl 晶体分析:通过这组实验,并与表二、表三进行比较,发现加入NaCl 晶体后反应速度都增快,而加入Na2SO4 晶体后基本无变化。
说明硫酸根和氯离子在酸与铝的反应中发生了不同的作用,从而使反应现象出现较大差异。
到底是什么原因造成了如此大的差异呢?我们只有通过查阅资料来解决这个问题。
在资料中我们找到原因。
结论:由于铝的化学性质非常活泼,很容易跟空气中的氧气发生反应形成一种致密的氧化膜——氧化铝。
在用砂纸打磨时,铝片在接触空气的瞬间又重新生成了致密氧化铝膜,所以砂纸几乎无法除去铝片表面的氧化膜。
氧化铝和铝的晶体结构同属于立方面心紧密堆积,二者结构的这种相似性决定了它们的结合紧密牢固,铝越纯,常温下越难与酸反应,同时也不与水反应。
因此要使铝与酸反应,必须先破坏表面的氧化铝薄膜。
而铝表面氧化膜的破坏既与氢离子有关,又受酸液中阴离子的影响,不同的阴离子对氧化膜的破坏能力不同,其中Cl-对氧化铝薄膜的破坏能力最大,这是因为Cl-既可以穿过氧化铝薄膜的缝隙,使氧化铝薄膜破裂而变成不连续的碎块,又可以移向铝表面把密集阵中的水分子替换出来,阻止了氧化铝薄膜的进一步形成。

铝与稀硫酸反应的探究本案例介绍的是我校课外活动兴趣小组的同学开展铝与稀硫酸反应的实验探究活动。
在这次活动中,我和学生经历了发现并提出问题,建立假设,设计实验检验假设,并最终得出科学结论的过程,其中,有过困难的遭遇和对困难的焦虑,有着成功的喜悦,获得了科学探究的切身体验。
【过程】1、提出问题我在上“酸的通性”知识时,做了“铝、铜与稀硫酸的反应”的实验。
我把铝片和铜片分别投入盛有等量、溶质质量分数相同的稀硫酸的试管中,结果并没有看到铝与稀硫酸反应的现象。
铝在金属活动顺序表中介于镁和锌之间,镁、锌与稀硫酸反应现象非常明显,为什么铝与稀硫酸反应的现象并不明显呢?接着我把铝片投入稀盐酸中,想看看结果会不会也是这样,出乎我预料的是,铝与稀盐酸反应很剧烈,并产生大量的气泡。
这说明铝能置换出酸中的氢,但为什么铝与稀硫酸几乎不反应,而铝与稀盐酸反应却非常明显呢?2、建立假设我要求学生以小组为单位进行讨论,对上述问题提出种种假设。
学生提出的假设有:⑴可能是硫酸溶液中氢离子的浓度小于盐酸中氢离子的浓度;⑵可能是铝表面的致密氧化膜有保护作用;⑶可能是Cl-能促进铝跟氢离子的反应;⑷可能是SO42-阻碍了铝跟氢离子的反应。
3、设计实验,验证假设对于氢离子的浓度对反应的影响,我们想:是否是硫酸的浓度太低,影响了铝与稀硫酸的反应?于是控制溶液中氢离子的浓度相同,并用不同浓度的硫酸和盐酸作为比较。
我们设计了如下表所示的几个实验。
比较①②或③④可以得出,氢离子浓度相等的盐酸、硫酸与铝反应的速率有差异。
铝与稀硫酸反应的现象并不明显,而铝与稀盐酸反应现象很明显。
比较①③可以得出,当氢离子浓度不相等时,反应的速率也不一样。
氢离子浓度越大,反应的速率越快。
比较②④可以得出,浓度并不是影响铝与稀硫酸反应的主要原因。
对于假设(2),铝表面有一层致密的氧化膜,是否是氧化膜阻止了铝与稀硫酸的反应?于是设计了以下一组实验:(注:去膜即用砂纸打磨铝片或先在小烧杯中用NaOH溶液将铝片的氧化膜除去。
20年杭州市中小学教师教学能力水平考核初中自然科学试卷应考教师须知:1.本卷分三个部分,满分100分,(高级教师满分110分)考试时间120分钟。
2.答题前,请在密封区内填写市县名、校名、姓名、准考证号和所申报的职称。
3.答题要做到字迹清楚,行款整齐,卷面整洁。
4.初中科学教师在作答本卷时,第一部分、第二部分试题各专业教师都需要回答,第三部分的试题,只需回答本专业的试题即可。
第二部分题中加*号的题,申报高级职称者必做。
申报中级职称者不做。
第一部分(30分)1、(15分)全面提高每一个学生的科学素养是科学课程的核心理念。
(1) 请指出科学素养包含哪几个方面。
2、(15分)立足于学生的发展是《科学》课程的基本理念之一。
请简述在《科学》课程的教育中应如何体现“立足于学生发展”的基本理念。
第二部分(30分)1、请选择下列的一个..教学内容进行教学设计(应包括教学目标、教学过程、教学内容和教学方法,一节课的内容)。
(20分)(3)《科学》第四册第二章第二节《氧气和氧化》(4)《科学》第四册第三章第五节《叶的蒸腾作用和结构》(5)《科学》第四册第一章地三节中《原子结构的模型》(6)《科学》第五册中第三章第二节《能量转化的量度》(7)《科学》第六册中第二章第二节《生态系统》2、请根据本节教学内容,编制两道符合大多数学生水平的课后习题,并简要说明题目的立意。
(10分)*3、请联系本人的教学实际,简谈在《科学》学科的教学中如何减轻学生学习水平两极分化的方法(申报高级职称的教师做该题,申报中级教师职称的教师不做该题。
)(10分)第三部分(40分)一、化学内容1.(10分)如右图示,把试管放入盛有25℃时澄清的饱和石灰水的烧杯中,试管中开始放入一些镁带,再用滴管滴入5稀盐酸于试管中。
试回答下列问题:⑴实验中观察到的现象:。
⑵产生上述现象的原因是。
⑶由实验推知,2溶液和H2的总能量(填大于、小于或等于)镁带和盐酸的总能量。
《影响铝与盐酸、稀硫酸反应的因素》探究活动说课案石家庄市第四十二中学王淑卿一、说教学目标知识与技能:通过探究知道铝与酸的反应受酸的浓度、酸的种类、铝的形状、是否除去铝表面氧化膜、温度等因素的影响;通过实验锻炼学生动手操作的能力和规范性。
过程与方法:让学生在探究中了解通过控制变量获得结论的方法。
情感态度与价值观:培养学生善于发现问题、并积极解决问题以及团结合作的能力,并通过反思培养严谨的科学态度。
二、说重点与难点训练学生规范的实验操作能力。
在探究中掌握控制变量获得结论的方法。
培养学生发现问题解决问题的能力和严谨的科学态度。
三、说教学过程探究起因:在学习第八单元《金属的化学性质》时,学生分组探究“金属与稀盐酸、稀硫酸的反应”过程中,发现了这样一个问题:镁、锌、铁和稀酸反应产生气泡,而铝却几乎看不到气泡产生,铝和酸反应为什么现象不明显?为了解决这个问题,我们班的化学兴趣小组和我一起到实验室进行了一次探究活动。
我们的“探究之旅”主要分六个环节:发现问题、做出猜想、设计实验、进行实验、表达交流、获得结论。
[发现问题]影响铝和盐酸、稀硫酸反应的因素有哪些?[做出猜想]查阅有关铝的性质资料→猜想并且进行设计→请实验老师准备所需的药品及仪器(由兴趣小组成员课前准备)有关资料:反应物浓度越大,反应越快;氯离子会破坏铝的致密氧化膜结构;接触面积越大反应速率越快;铝表面能够形成一层致密的氧化膜;金属氧化物可以和酸反应;加热能加快反应速率……实验用品:10﹪、30﹪的盐酸和稀硫酸、相同大小的铝片(分打磨过、用酸浸泡过和未打磨)、铝粉、试管、培养皿、试管夹、酒精灯、镊子、药匙、砂纸……通过互相讨论,对比每个设计方案,强调如何控制变量,小组交流猜想可能影响的因素:[设计实验]根据实验用品,对你感兴趣的猜想设计出合理的实验方案,并填写设计单(见附表)。
讨论后与其它各小组发言交流,使所设计的方案更准确,合理。
对比合理设计找出不合理之处,最后师生共识:用控制变量法设计实验,必须只有一个变量,不能出现第二个变量。
研究性学习一例
——铝与稀盐酸和稀硫酸反应的差异探究
一、问题
在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫酸却几乎不反应。
这和教材上的内容“铝能跟稀盐酸或稀硫酸起反应生成氢气”(人教版高中化学第二册P.22)不一致?是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,学生在教师指导下重新用分析纯浓盐酸和浓硫酸配制了一定浓度的溶液,然后加入0.1×10×25mm、纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如表1。
无论是1.5mol/L还是3mol/L的稀硫酸,均无明显反应现象。
其结论还是与教材的叙述不相符合。
二、分析
稀盐酸和稀硫酸都是非氧化性酸,在水溶液里都完全电离出H+。
铝和非氧化性酸反应的实质是与H+的反应,在H+都等于3mol/L的两种酸中,就中学知识可推得反应速率应该相等。
但即使把硫酸中的H+提高到6mol/L,铝和硫酸还是无明显的反应现象。
这其中的原因是什么呢?既然两溶液中阳离子都只有H+,且浓度也相同,那么存在的差异就可能跟H+所处的环境不同有关(如阴离子的不同)。
于是,学生作出如下假设。
三、假设
假设一:Cl-能促进金属铝与H+的反应。
假设二:SO
4
2-对H+与金属铝的反应起阻碍作用。
假设三:铝表面的致密氧化膜有保护作用,使H+与铝不易接触。
为了验证上述假设,经学生充分讨论,设计了如下实验方案进行验证。
四、验证
实验一:分别取5mL3mol/LHCl,H
2SO
4
,加入纯度为99.5%的铝片各
一小片,然后添加NaCl,Na
2SO
4
晶体,实验现象如表2。
表2实验现象
实验分析:
(1)a组硫酸中加入NaCl,铝与硫酸就明显反应,放出氢气。
而b组
硫酸中加入Na
2SO
4
无明显现象。
这两种盐中都含Na+说明这种差别并非由
所加入的盐中Na+引起,而是由阴离了引起,即Cl-促进了金属铝与H+的反应。
(2)c组实验在HCl中加入Na
2SO
4
后反应与d组盐酸中不加Na
2
SO
4
现象相同,说明SO2-
4
对H+与Al的反应并无阻碍作用。
那么Cl-为什么能影响H+与金属铝的反应呢?这种影响是否与铝片表面的致密氧化铝保护膜有关呢?为了验证这一猜测和假设,学生又设计了在不同情况下的铝片与3mol/L的稀硫酸反应的实验。
实验二:不同情况下的铝片分别加入3mol/L稀硫酸中,实验现象如表3。
表3实验现象
(1)c组和e组实验中,铝分别与Hg和Cu形成了原电池,但c组能反应,e组却无明显现象,说明c组能反应的主要原因并非是由形成原电池而引起的。
(2)c,b两组实验中铝与稀硫酸都明显反应,但c组是铝置换出汞后铝表面形成铝汞齐,破坏了铝片表面的致密氧化膜;且铝汞齐的存在使铝片不易再形成致密氧化膜。
而b组实验铝片表面虽存在致密氧化膜,但硫酸溶液中多了Cl-,即Cl-的作用等同于破坏了铝片表面的致密氧化膜。
(3)d组虽用砂纸暂时除去了铝表面的致密氧化膜,但由于铝片在接触空气的瞬间又重新生成了致密氧化铝膜,所以反应现象不如c组明显。
五、结论
综合上述实验及分析,学生最终得出结论:铝表面的致密氧化膜除了使其在空气中具有耐腐蚀的性能外,在酸中也具有一定的耐腐蚀性能,但这种耐腐
蚀性与酸中的H+所处的环境关系很大;某些阴离子(如Cl-)能促进H+破坏这种致密的氧化膜,使H+直接与铝原子接触迅速反应生成氢气。
铝与稀盐酸、稀硫酸反应现象之所以不同,是由于盐酸中的Cl-能破坏铝片表面的致密氧化
2-离子却没有这种能力。
教材中的铝与稀硫酸反应生成氢膜,而硫酸中的SO
4
气指的是表面无致密氧化膜的铝。
六、评析
虽然学生得出的结论不一定完全正确,实验方案也不一定合理,但却体现了学生不唯书本、不唯教材,敢于批判的创新精神。
这些分析、假设和结论使学生直接体验了科学研究的过程和方法,掌握了一定的科研技巧,而这正是研究性学习的目的所在。