中考化学专题复习第三单元 物质构成的奥秘
- 格式:pptx
- 大小:684.52 KB
- 文档页数:52


专题03 物质构成的奥秘1.物质是由微观粒子构成的,下列物质由原子直接构成的是()A.金刚石B.水蒸气C.氯化钠D.碳酸钠【答案】A【解析】A、金刚石是由碳原子直接构成,符合题意。
B、水蒸气是由水分子直接构成,不符合题意。
C、氯化钠是由氯离子和钠离子构成,不符合题意。
D、碳酸钠是由钠离子和碳酸根离子构成的,不符合题意。
故选A。
2.(2022上海交大附中一模)关于水分子的说法正确的是A.水分子是由氢原子和氧原子构成的B.水变成冰后,水分子是静止的C.水变成水蒸气后,水分子的体积变大了D.水分子可以保持水的物理性质【答案】A【解析】A、水分子是由氢原子和氧原子构成的,此选项表述正确;B、水变成冰后,水分子也在不断运动,只是运动速度慢了,此选项表述不正确;C、水变成水蒸气后,水分子的体积没变,水分子之间的间隔变大了,此选项表述不正确;D、水分子能保持水的化学性质,但不能保持水的物理性质,此选项表述不正确。
故选A。
3.(2022海南海南模拟)下列物质由离子构成的是A.氯化氢B.硝酸钾C.二氧化碳D.氦气【答案】B【解析】A、氯化氢是由非金属元素组成的化合物,是由氯化氢分子构成的,故选项错误;B、硝酸钾是含有金属元素和非金属元素的化合物,硝酸钾是由钾离子和硝酸根离子构成的,故选项正确;C、二氧化碳是由非金属元素组成的化合物,是由二氧化碳分子构成的,故选项错误;D、氦气属于稀有气体单质,是由氦原子直接构成的,故选项错误。
故选B。
4.(2022青海西宁模拟)从微观的角度解释下列现象,其中错误的是A.十里桂花飘香——分子在不停地运动B.金刚石和石墨的物理性质不同——分子构成不同C.水蒸发为水蒸气,所占体积变大——分子间隔变大D.1滴水中约含1.67×1021个水分子——分子的质量和体积都很小【答案】B【解析】A、十里桂花飘香,说明分子在不停地运动,故A不符合题意;B、金刚石和石墨都是由碳原子构成的,因此他们性质不同是因为碳原子的排列方式不同,故B符合题意;C、水蒸发为水蒸气,所占体积变大,是因为分子的间隔变大,故C不符合题意;D、1滴水中约含1.67×1021个水分子,说明分子的质量和体积很小,故D不符合题意;故选B。



中考必背重点知识(三)物质构成的奥秘三分子和原子知识点一:物质由微观粒子构成1.构成物质的粒子物质是由微观粒子构成的,构成物质的粒子有:、和。
2.微粒的性质(以分子为例)①小:分子的质量和体积都很小1个水分子的质量约是3×10—26kg,一滴水(20滴为1mL)中大约有1.67×1023个水分子。
如果10亿人来数一滴水里的水分子每人每分钟数100个数,昼夜不停的数,需要3万年才能数完。
①分子在不断运动(温度越高,分子运动速率越快)①分子间是有间隔的①同种分子性质相同,不同分子性质不同其中①①①是分子、原子、离子的共同性质。
知识点二:分子和原子的关系1.分子——保持由分子构成的物质的化学性质的最小粒子原子——化学变化中的最小粒子二者关系:①在化学变化中,分子分成原子,原子重新组合成新的分子;①在化学变化中,分子可分,原子不可分。
2.用微粒的观点解释(1)物理变化和化学变化物理变化:微粒本身不改变,只是微粒的间隔发生了变化。
化学变化:微粒本身发生了改变,即微粒的构成发生了改变。
(2)纯净物与混合物纯净物:由 微粒构成。
混合物:由 微粒构成。
3.由原子构成的物质:①金属单质 如:铁、铜、汞等①固态非金属 如:碳、磷、硫等①稀有气体单质 如:氦、氖、氩等4.分子和原子比较(1)相同点分子和原子都是组成世界的稳定 ,它们的 和 都很小,它们都在不断的 ,它们之间都有可以变化的 。
(2)不同点(用分子、原子填空)① 相互结合形成②在化学变化中, 发生了破裂,分成了更小的粒子—— , 又重新组合成新的 。
是化学变化中的最小粒子, 是保持物质化学性质的最小粒子。
在化学变化中可分, 在化学变化中不可分。
原子的结构知识点一:原子的构成()()()⎪⎩⎪⎨⎧-⎩⎨⎧++个负电荷:一个电子带核外电子中子:不带电个质子带一个正电荷:质子原子核原子11说明: ①原子核位于原子中心,电子围绕原子核做高速运动。

第三单元物质构成的奥秘1.分子(1)概念:分子是保持物质化学性质的最小粒子。
分子只能保持物质的化学性质,不能保持物理性质。
如冰、水、水蒸气的构成粒子都是H2O分子,它们的物理性质不同,但化学性质相同。
(2)性质:①分子很小(质量小、体积小);②分子在不停地运动(温度越高,分子能量越大,分子运动越快);③分子间有间隔[其他条件相同时,温度越高分子间隔越大(热胀冷缩的原因);压强越大分子间隔越小]。
物质挥发、扩散、溶解等现象说明分子在不停地运动。
酒精与水混合后的总体积比两者体积之和略小、气体易被压缩等现象说明分子间有间隔。
(3)构成:分子是由原子构成的(描述具体分子的构成时原子要具体化。
如果指明一个(或每个)分子,则后面原子也要根据化学式说明相应原子的个数)。
如水(H2O)可以描述为:“水分子是由氢原子和氧原子构成的”或“一个水分子是由两个氢原子和一个氧原子构成的”。
过氧化氢(H2O2)可以描述为:“过氧化氢分子是由氢原子和氧原子构成的”或“每个过氧化氢分子是由2个氢原子和2个氧原子构成的”。
(4)应用:由同种分子构成的物质是纯净物(如冰水共存物都是由H2O分子构成的,是纯净物);由不同种分子构成的物质是混合物(如空气是由氮分子、氧分子、二氧化碳分子等构成的,是混合物)。
2.原子(1)概念:原子是化学变化中的最小粒子。
(2)化学变化(即化学反应)的本质是原子的重新组合。
在化学反应前后,原子的种类和数目都不变,元素的种类也不变(即元素守恒),但分子的种类一定发生改变(生成新物质)。
分子在化学反应中发生变化的过程为:分子(3)结构:①原子由原子核与核外电子构成,原子核由质子和中子构成(有一种氢原子没有中子)。
1个质子带1个单位正电荷,1个电子带1个单位负电荷,中子不带电。
核电荷数=质子数=原子的核外电子数=原子序数②相对原子质量:以1个碳12原子质量的1/12为标准,其他原子的质量与它相比较所得到的比,单位为1。


学习资料中考化学专题训练第三单元物质构成的奥秘(含解析)班级:科目:第三单元物质构成的奥秘一、单选题1。
日常生活中见到的“加碘食盐”“高钙牛奶”中“碘、钙”应理解为()A.分子B.原子C.离子D.元素2。
下列有关微观粒子的说法中正确的是()A.分子由原子构成,原子不显电性,则分子也不显电性B.分子是保持物质化学性质的唯一粒子C.原子中的粒子都不带电D.原子核不显电性3。
王安石的《梅花》诗:“墙角数枝梅,凌寒独自开。
遥知不是雪,为有暗香来。
"诗人在远处就能闻到淡淡的梅花香味的原因是()A.分子很小B.分子在不断地运动C.分子之间有间隙D.分子是可以分的4。
学习知识要真正做到融会贯通,疏而不漏,学习了原子的构成知识后,请你判断下列叙述错误的是( )A.分子、原子都能直接构成物质B.原子中原子核与核外电子的电量相等,电性相反,因而原子不显电性C.决定原子质量大小的主要是质子和电子D.在化学变化中,原子是不可再分的5。
下列对分子、原子、离子的认识,正确的是()A.原子是最小的粒子,不可再分B.相同原子可能构成不同的分子C.离子不能直接构成物质D.固体难压缩,说明固体分子间无间隔6。
关于氧分子和氧原子的说法,错误的是( )A.在化学变化中,氧分子能再分,氧原子不能B.氧分子大,氧原子小C.氧气的化学性质由氧分子保持D.氧气由氧分子构成,也由氧原子构成7.C—12和C-14是碳元素的两种不同的原子,二者的不同点有()①原子中的电子数;②原子核内的中子数;③原子核内的质子数;④原子的质量A.①②B.③④C.①③D.②④8.下列是一些微观粒子结构示意图,有关叙述正确的是()A.②⑤为同一周期元素的原子B.①②的元素在周期表的同一族C.①③④⑤是具有相对稳定结构的原子D.②③属于同种元素的同种粒子9。
下列结构示意图中,属于阳离子的是()A.B.C.D.10。
下列粒子中不能直接构成物质的是( )A.原子B.分子C.离子D.电子11.水结成冰是由于( )A.水分子的运动停止了B.水分子的化学性质发生了改变C.水分子变小了D.水分子间的间隔发生了变化12。

中考化学一轮复习第3章物质构成的奥秘考点1 微粒(分子、原子、离子)1.构成物质的微粒特点:微粒是的;微粒是的,温度升高,运动加快;微粒之间存在。
在固体、液体物质中,微粒之间的距离,在气体物质中,微粒之间的距离。
所以,气体通常比较容易被,固体和液体。
2.科学家长期研究证实,构成物质的微粒有、和。
有的物质是由构成,如金刚石是由构成的;有的物质是由构成,如食盐是由构成的;还有的物质由构成,,如干冰是由构成的。
3.分子是保持的一种微粒。
保持二氧化碳化学性质的一种微粒是。
氧气和液氧都有助燃性是因为他们都是由构成;氧气、氢气、水的性质是因为他们是由构成的。
4.原子是中最小的微粒。
5.分子是由构成的,原子通过可形成离子。
6.观察水分子分解的示意图:并回答问题:通电结合分解水分子氢原子氧原子氢分子氧分子从图中你可以得到哪些信息?请从物质的组成、构成及变化的角度各说一种:组成:;构成:;变化:。
7.分子、原子、离子的相互关系极其转化:相同点:都很;都在;微粒间都有;相同的微粒具有的性质。
区别:。
阳离子 原子 离子 8. 用微粒的观点解释常见现象:物理变化 :。
化学变化:。
9.科学家们研究发现,原子是由带________电荷的_________和带________电荷的____________构成。
两者所带的电量_________,电性__________,因而原子呈_________性。
原子核在原子中所占的体积极_______。
但是原子核几乎集中了原子的 _________。
原子核由_________和__________构成,其中__________不带电荷。
原子中:_____________=_____________=______________。
相对原子质量≈_______________+__________________。
10.相对原子质量:以 为标准, 与这一基准的比,称为这种原子的相对原子质量。
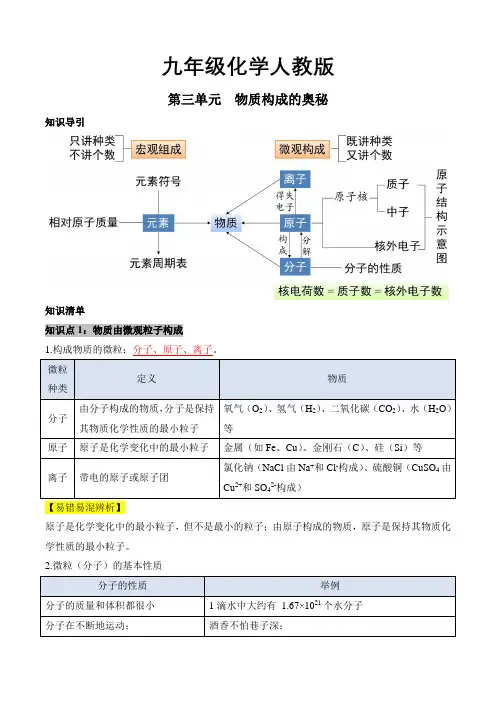
九年级化学人教版第三单元物质构成的奥秘知识导引知识清单知识点1:物质由微观粒子构成1.构成物质的微粒:分子、原子、离子。
【易错易混辨析】原子是化学变化中的最小粒子,但不是最小的粒子;由原子构成的物质,原子是保持其物质化学性质的最小粒子。
2.微粒(分子)的基本性质【易错易混辨析】热胀冷缩是分子间的间隔随温度改变而改变,注意不是分子的大小改变,分子的大小本身的改变是很细微的;分子间的间隔是微观概念,不能与宏观的间隔混淆,如1L 红豆和1L 黄豆混合小于2L 是红豆和黄豆之间存在间隔,这是宏观的间隔,不是分子之间的间隔。
3.分子运动现象的探究实验3中A 烧杯变红原因:浓氨水具有挥发性,挥发出的氨气分子运动到B 烧杯中溶于水,形成氨水使酚酞变红。
实验3中B 烧杯不变色原因:不同分子的运动速率不同。
知识点2:分子可以分为原子 1.分子与原子的区别和联系2.用微粒的观点解释物理变化和化学变化(以分子构成的物质为例)化学变化的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
3.用微粒的观点解释混合物和纯净物(以分子构成的物质为例)知识点3:原子1.原子的构成【易错易混辨析】(1)原子核中不一定有中子,如氢原子的原子核中只有一个质子,没有中子;(2)同一原子中质子数和中子数不一定相等,如氢原子中,质子数为1,中子数为0。
2.原子结构示意图描述原子结构的模型(以钠原子结构示意图为例)3.原子核外电子排布(1)核外电子是分层排布的,离核最近的为第一层,依次为第二层、第三层…。
(2)能量低的电子优先排在离核最近的电子层中,能量高的在离核远的区域运动。
(3)每个电子层所排布的电子数是不同的,第一层最多为2个,第二层最多为8个,最外层最多为8个(只有一层的,电子不超过2个)。
4.原子结构和元素的化学性质关系总结:元素的化学性质与相应原子的最外层电子数密切相关,一般情况下,最外层电子数相等的原子化学性质相似。
第三章物质构成的奥妙--核心知识点总结1、微粒的基本性质(1)微粒很小,肉眼看不到(2)微粒是在不停地运动的(3)微粒之间有空隙2、构成物质的微粒有原子、分子、离子。
3、不同的物质具有不同的性质,这是由于构成的微粒不同。
构成微粒相同,则物质的性质相同;构成微粒不同,则物质的性质不同。
4、分子概念:分子是构成物质的一种微粒,,大多数物质是由分子构成的。
由分子构成的物 质,分子是保持其化学性质的最小微粒。
5、分子的性质:①分子很小,肉眼看不到 ②分子是在不停地运动的 ③分子之间有空隙④同种物质的分子化学性质相同,不同种物质的分子化学性质不同6、原子概念:原子是化学变化中的最小微粒7、原子的性质:①原子的质量和体积都很小 ②原子是在不停地运动的 ③原子之间有空隙 8、原子的构成(1)原子结构示意图的认识核内质子数正原子核+122 8 2最外层上有 2 个电子原子原子核(带电)第一电子层电子(带 负电)(2)在原子中核电荷数=质子数=核外电子数(3)原子的质量主要集中在原子核上(4)相对原子质量≈质子数+中子数决定元素种类质子数(核电荷数)(5)三决定最外层电子数决定原子的质量原子核说明:最外层电子数相同其化学性质不一定都相同(Mg,He 最外层电子数为 2)最外层电子数不同其化学性质有可能相似(He,Ne 均为稳定结构)9、相对原子质量1(1)概念:以一种碳原子(原子核中含有6 个质子和6 个中子)质量的12它原子的质量与这一基准的比,称为这种原子的相对原子质量。
作为基准,其(2)公式:某种原子的相对原子质量=一个该原子的实际质量(Kg)一个碳-12原子的实际质量(Kg)*112(3)单位:相对原子质量是一个比值,单位为“1”,一般不写出。
(4)相对原子质量≈质子数+中子数10、离子:原子或原子团得失电子后形成的带电荷的微粒叫做离子。
(带电的原子或原子团)11、(1)离子表示方法及意义:如Fe3+ :一个铁离子带3 个单位正电荷(2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图*原子数≠电子数为离子结构示意图质子数>电子数:则为阳离子,如Al3+质子数<电子数:则为阴离子,O2--12、离子与原子的区别与联系离子粒子的种类原子阳离子阴离子粒子结构质子数=电子数质子数>电子数质子数<电子数区粒子电性不显电性显正电性显负电性别符号用元素符号表示用阳离子符号表示用阴离子符号表示13、元素(1)定义:具有相同核电荷数(质子数)的同一类原子的总称(2)表示方法——元素符号——拉丁文名称的第一个字母大写,第二个小写a、书写方法:b、意义注意:如O:氧元素一个氧原子*有些元素符号还可表示一种单质如Fe、He 、C 、Si*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3 个氧原子c、有关元素周期表*发现:门捷列夫*7 横行(718 纵行(16 族*注:原子序数=质子数d金属元素:如Mg、Al,最外层电子数特点:<4非金属元素:如N、C,最外层电子数特点:≥4稀有气体元素:如He、Ne。