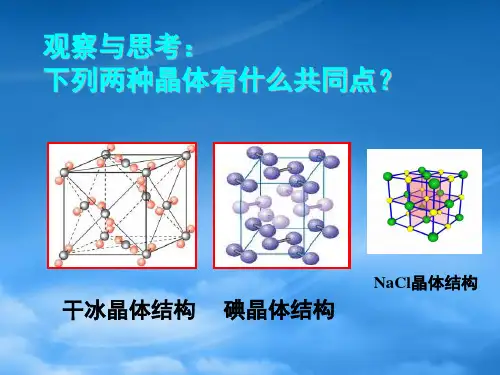
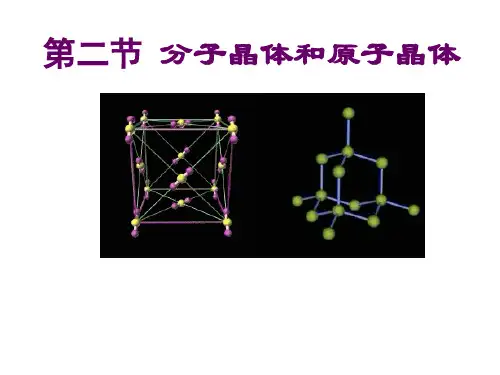
2.典型的分子晶体
• (1)所有非金属氢化物:H2O,H2S,NH3,CH4,HX • (2)部分非金属单质: X2,O2,H2, S8,P4, C60 • (3)部分非金属氧化物:CO2, SO2, NO2,P4O6,P4O10 • (4)几乎所有的酸: H2SO4,HNO3,H3PO4 • (5)绝大多数有机物: 乙醇,冰醋酸,蔗糖
(4)石墨层状结构中,平均每个正六边形占有
2
个碳原子。
部分溶于水
固体和熔化状态都不导 电,部分溶于水导电
练习 1、下列各组物质的晶体中,化学键的类型相 同,晶体的类型也相同的是( B ) A、SO2和SiO2 B、CO2和H2O C、BN和HCl D、CCl4和KCl 2、下列物质的晶体直接由原子构成的一组是 ( C) ①CO2 ②SiO2 ③晶体Si ④白磷 ⑤氨基乙酸 ⑥NaCl ⑦Na2O ⑧固 态He A、①②③④⑤⑥⑦⑧ B、②③④⑥⑧ C、②③⑧ D、①②⑤⑦⑧
3.原子晶体的物理特性
在原子晶体中,由于原子间以较强的 共价键相结合,而且形成空间立体网状结构, 所以原子晶体的 (1)熔点和沸点很高 (2)硬度很大 (3)一般不导电(Si和Ge半导体) (4)难溶于一些常见的溶剂
原子晶体熔沸点高低的影响因素: 共价键键长越短,键能越大,熔沸点越高。
109º 28´
3、C60、金刚石和石墨的结构模型如下图所示(石墨 仅表示出其中的一层)
B ; (1)C60、金刚石和石墨三者互为 A、同分异构体 B、同素异形体 C、同系物 D、同位素 (2)固态时,C60属于 分子 (填“离子”、“原子” 或“分子”); (3)硅晶体的结构跟金刚石相似,1mol硅晶体中含有硅硅单 个 键的数目约是 2 NA 。硅、氧原子形成的最小环上氧原子的数 目是 6 ;