化学热力学基本
- 格式:doc
- 大小:268.50 KB
- 文档页数:14



化学中的化学热力学知识点化学热力学是研究化学反应中能量的转化与变化的学科,它对我们理解化学现象和反应行为起着重要的作用。
本文将介绍化学热力学的一些基本知识点,包括热力学第一定律、热力学第二定律、焓、熵和自由能等。
1. 热力学第一定律热力学第一定律是能量守恒定律在化学反应中的应用。
热力学第一定律表明,系统的内能变化等于系统吸收的热量与对外做功之和。
这可以表示为以下公式:ΔU = q + w其中,ΔU表示系统的内能变化,q表示系统吸收的热量,w表示系统对外做的功。
2. 热力学第二定律热力学第二定律是热现象的方向性规律。
它表明自发过程在整个宇宙中是朝熵增加的方向进行的。
热力学第二定律可以通过熵的概念来描述,熵是衡量系统无序程度的物理量。
根据热力学第二定律,一个孤立系统的熵在自发过程中不断增加,直到达到最大值。
3. 焓焓是一个物质在常压条件下的热力学函数,通常用H表示。
在常压下,焓的变化可以表示为下式:ΔH = q焓变表示物质的热量变化,正值表示系统吸热,负值表示系统放热。
4. 熵熵是衡量系统无序程度的物理量,通常用S表示。
根据热力学第二定律,一个孤立系统的熵在自发过程中不断增加。
熵的变化可以表示为下式:ΔS = q/T其中,ΔS表示系统的熵变,q表示系统吸收的热量,T表示系统的温度。
5. 自由能自由能是描述系统在恒温、恒压条件下能量转化的热力学函数,通常用G表示。
自由能包括内能和对外做功两个方面的能量,可以表示为以下公式:G = H - TS其中,H表示焓,T表示温度,S表示熵。
当系统的自由能变化ΔG为负值时,表示该过程是自发进行的。
总结:化学热力学是研究化学反应中能量转化与变化的学科,主要涉及热力学第一定律、热力学第二定律、焓、熵和自由能等知识点。
热力学第一定律描述了能量守恒定律在化学反应中的应用,热力学第二定律说明了自发过程进行的方向性规律。
焓是在常压下物质的热力学函数,熵是衡量系统无序程度的物理量,自由能描述了系统在恒温、恒压条件下的能量转化情况。

化学热力学的基本定律化学热力学是研究化学反应中能量变化和热力学性质的科学。
它是化学的一个重要分支,通过研究物质在不同条件下的能量变化,揭示了化学反应的本质和规律。
在化学热力学中,有一些基本定律被广泛应用于实际问题的解决和理论模型的建立。
一、热力学第一定律热力学第一定律,也称为能量守恒定律,是热力学中最基本的定律之一。
它表明在一个封闭系统中,能量既不能被创造也不能被消灭,只能从一种形式转化为另一种形式。
换句话说,系统的内能变化等于系统所吸收或放出的热量与做功之和。
数学表达式为:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统吸收或放出的热量,W表示系统所做的功。
二、热力学第二定律热力学第二定律是描述自然界中不可逆过程方向性的定律。
它指出自然界中热量只能从高温物体传递到低温物体,而不能反向传递。
这个定律还提出了一个重要的概念——熵。
熵是描述系统无序程度的物理量,它随着时间的推移而增加。
数学表达式为:ΔS ≥ 0其中,ΔS表示系统熵的变化。
三、热力学第三定律热力学第三定律是描述物质在绝对零度时的性质的定律。
它指出当温度趋近于绝对零度时,物质的熵趋近于零。
也就是说,在绝对零度下,物质的无序程度最小。
这个定律对于研究低温物理和凝聚态物理非常重要,它揭示了物质在极低温下的行为和性质。
四、吉布斯自由能定律吉布斯自由能是描述系统在恒温恒压条件下可用能量的一种函数。
它是判断化学反应是否可逆进行的重要指标。
根据吉布斯自由能定律,当系统的吉布斯自由能减小时,化学反应是可逆的;当系统的吉布斯自由能增大时,化学反应是不可逆的。
数学表达式为:ΔG = ΔH - TΔS其中,ΔG表示系统的吉布斯自由能变化,ΔH表示系统的焓变,T表示温度,ΔS表示系统的熵变。
五、平衡常数定律平衡常数是描述化学反应平衡程度的物理量。
根据平衡常数定律,对于一个化学反应:aA + bB ⇌ cC + dD其平衡常数K可以通过以下公式计算:K = [C]c[D]d / [A]a[B]b其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的浓度。


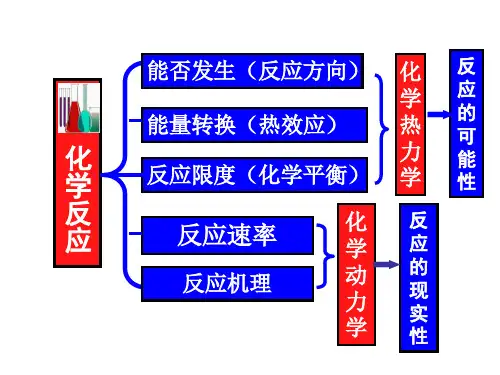



普通化学第二章化学热力学基础⏹§1.1 热力学基本概念⏹§1.2 热力学第一定律⏹§1.3 焓热力学⏹§1.4 自发过程和熵⏹§1.5 吉布斯自由能与化学反应的方向⏹总结化学热力学研究与解决的主要问题?热力学-------研究各种形式的能量相互转变过程中所遵循规律的科学。
热力学的基础:热力学第一定律和热力学第二定律化学热力学-------将热力学的原理应用于化学变化过程,就称为化学热力学。
化学热力学研究与解决的主要问题:一是在指定的条件下,某一化学反应进行时,与外界交换多少能量?即计算化学反应热。
二是在指定的条件下,某一化学反应能否自发进行,即判断化学反应进行的方向。
三若可能自发进行,反应进行的温度如何?热力学方法的特点:大量质点组成的宏观体系1、热、功、状态函数△U、△H、△G和△S2、热力学第一、二、三定律3、盖斯定律4、自发过程的判定5、吉布斯—亥姆霍兹公式1、功、热、内能、焓、自由能、熵的计算2、自发过程判定AgNO 3与NaCl 的水溶液:如果只研究在水溶液中所进行的反应,则含有这两种物质的水溶液就是体系。
溶液以外的烧杯、溶液上方的空气都是环境。
如果还要研究反应时的能量变化,则水溶液和烧杯为体系,空气为环境。
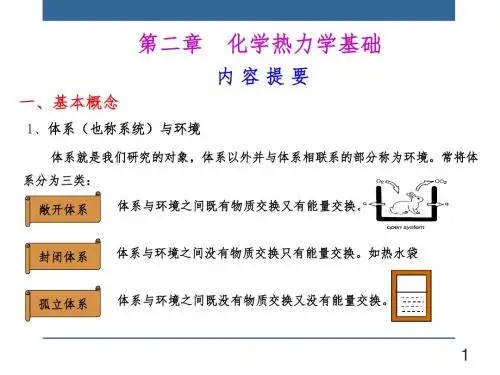
例如:NaCl+AgNO 3溶液-体系分类敞开体系:体系与环境之间既有能量交换,又有物质交换。
封闭体系:体系与环境之间只有能量交换,没有物质交换。
孤立体系:体系与环境之间既没有能量交换,也没有物质交换。
敞开体系封闭体系绝热箱孤立体系NaOH+H2ONaOH+H2ONaOH+H2O热物质热二、体系的性质1、体系的性质:确定体系状态的各种宏观物理量。
如温度、压力、体积、质量、密度、浓度等2、体系的性质分为广度性质和强度性质两类:广度性质:在数值上与体系中物质的量成正比,即具有加和性。
如体积、质量、内能、焓、熵等。
强度性质:在数值上与体系中物质的量无关,即不具有加和性。
化学热力学基础热力学是研究物质能量转化与传递规律的学科,它在化学中起着重要的作用。
化学热力学是热力学在化学中的应用,它研究化学反应中的能量变化、熵变以及自由能的变化。
本文将介绍化学热力学的基础知识,包括能量、熵和自由能的概念,以及它们在化学反应中的应用。
一、能量能量是物质存在和运动的基本属性,也是化学反应中的核心概念。
在化学热力学中,常用的能量单位是焦耳(J),它表示物质发生转换时释放或吸收的能量。
能量可以按照不同的形式进行分类,包括动能、势能和内能等。
动能是物体由于运动而具有的能量,它与物体的质量和速度有关。
势能是物体由于位置而具有的能量,如重力势能、电位能等。
内能是物质分子或原子内部的能量,包括分子的振动、转动和电子的能级等。
在化学反应中,能量可以从一个物质转移到另一个物质,或由一个形式转化为另一个形式。
根据能量守恒定律,能量在转移和转化过程中总量保持不变。
二、熵熵是描述物质混乱程度的物理量,也是化学热力学中的重要概念。
熵的单位是焦耳/开尔文(J/K)。
熵的增加代表物质的混乱程度增加,而熵的减少代表物质的有序程度增加。
根据熵的定义,封闭系统内熵的增加是不可逆的,即系统的熵在不受外界干扰情况下只能增加或保持不变,而不会减少。
化学反应中的熵变是反应前后熵的差值。
当化学反应导致物质的混合或混乱程度增加时,反应的熵变为正值;当化学反应导致物质的有序程度增加时,反应的熵变为负值。
三、自由能自由能是热力学中一个基本概念,它表示系统进行非体积功(P-V 功)时可利用的能量。
自由能的单位与能量相同,为焦耳(J)。
在化学反应中,可以根据自由能的变化来判断反应的进行方向和可逆性。
当自由能变化为负值时,反应是可逆的,可自发进行;而当自由能变化为正值时,反应是不可逆的,需要外界输入能量才能进行。
化学反应的自由能变化可以用自由能变化(ΔG)来表示。
ΔG与反应的熵变(ΔS)和焓变(ΔH)之间存在着关系:ΔG = ΔH - TΔS,其中T为温度(单位为开尔文)。
第五章化学热力学基础5-1从手册查出常用试剂浓盐酸﹑浓硫酸﹑浓硝酸﹑浓氨水的密度和质量分数,计算它们的(体积)物质的量浓度(c)和质量摩尔浓度(m)。
5-2从手册查出常温下的饱和水蒸气压,计算当相对湿度为40%时,水蒸气压多大。
5-3化学实验事中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗后烧杯内残留“水”为1ml,试计算,用30ml蒸馏水洗一次和洗两次,烧杯中残留的“自来水的浓度”分别多大?5-4计算 15℃,97kPa下15g氯气的体积。
5-5 20 ℃,97kPa下0.842g 某气体的体积为0.400 L ,求该气体的摩尔质量。
5-6测得 2.96g 氯化汞在 407℃的 1L 容积的真空系统里完全蒸发达到的压力为60 kPa ,求氯化汞蒸汽的摩尔质量和化学式。
5-7 在1000℃和 97kPa 下测得硫蒸汽的密度为0.5977 g.L-1,求硫蒸气的摩尔质量和化学式。
5-8 在25℃时将相同压力的5.0 L 氮气和15 L 氧气压缩到一个10.0 L 的真空容器中,测得混合气体的总压为150 kPa ,(1)求两种气体的初始压力;(2)求混合气体中氮和氧的分压;(3)将温度上升到 210 ℃,容器的总压。
5-9在25 ℃, 1.47MPa 下把氨气通入容积为1.00 L 刚性壁容器中,在350℃下催化剂使部分氨分解为氮气和氢气,测得总压为 5MPa ,求氨的解离度和各组分的摩尔分数和分压。
5-10 某乙烯和足量的氢气的混合气体的总压为 6930Pa ,在铂催化剂催化下发生如下反应:C2H4(g) +H2(g) === C2H6(g)反应结束时温度降至原温度后测得总压为4530Pa 。
求原混合气体中乙烯的摩尔分数。
5-11以下哪些关系式是正确的( p、V、n 无下标时表示混合气体的总压、总体积和总的物质的量)?说明理由。
pV B = n B RT p B V = n B RT p B V B = nRT pV = nRT5-12以下系统内各有几个相?(1)水溶性蛋白质的水溶液;(2)氢氧混合气体;(3)盐酸与铁块发生反应的系统(4)超临界状态的水。
5-13 10g水在 373K 和100kPa 下汽化,所做的功多大?(设水蒸气为理想气体)5-14反应CaC2(s) + 2H2O(l) ====Ca(OH)2(s) + C2H2(g)在 298K 下的标准摩尔热力学能变化量为-128 kJ.mol-1。
求该反应的标准摩尔焓变。
5-15 人类登月使用的阿波罗火箭的第一级火箭使用了550 吨煤油在2.5min内与氧气发生燃烧产生巨大推力。
以C12H26(l)为煤油的平均分子式的燃烧热为-7513 kJ.mol-1,试计算这个燃烧发应的功率。
5-16已知Al2O3(s) 和MnO2 的标准摩尔生成焓为-1676 kJ.mol-1和 -521 kJ.mol-1,计算1g铝与足量MnO2反应(铝热法)产生的热量。
5-17已知Cl-(aq)的标准摩尔生成焓为-167.5 kJ.mol-1,计算1 mol HCl(g) 溶于足量的水释放多少热?[注]计算得到的值为氯化氢的熔解热;HCl(g)的标准摩尔生成焓可从本书附表中查获。
假设水量的多少与水合反应的程度无关(事实上是有关的,因此的数值通常设定为无限稀释。
)5-18用标准摩尔生成焓的数据计算SiF4(g) 与足量H2O(l) 反应生成 SiO2(s) 和HF(g) 的摩尔反应焓。
5-19利用本书附表与下列数据计算石灰岩[以 CaCO3 (方解石)计]被 CO2(g) 溶解发育成喀斯特地形的如下反应的标准摩尔生成焓:CaCO3(s) + CO2(g)+ H2O(l)===Ca2+ (aq) +2HCO3-(aq)△f H mθ/ kJ.mol-1: Ca2+ (aq) -543.0 HCO3-(aq) -691.15-20火柴头中的P4S3(s)的标准摩尔燃烧热为-3677 kJ.mol-1 [注:燃烧产物为P4O10(s)和SO2 ],利用本书附表的数据计算P4S3(s)的标准摩尔生成焓。
5-21诺贝尔(Alfred Nobel 1833-1896)发明的炸药爆炸可使产生的气体因热膨胀体积增大1200倍,其化学原理是硝酸甘油发生如下分解反应:4C3H5(NO3)3(l) ===6N2(g) + 10H20(g) + 12CO2(g) +O2(g)已知C3H5(NO3)3(l)的标准摩尔生成焓为-355 kJ.mol-1,计算爆炸反应的标准摩尔反应焓。
5-22生石灰的水化反应放出的热足以将纸张着火或鸡蛋煮熟。
试利用本书附表的数据计算500g(1市斤)生石灰(s)与足量的水生成熟石灰(s)放出的热(注:可忽略溶解反应)。
5-23生命体的热源通常以摄入的供热物质折合成葡萄糖燃烧释放的热量,已知葡萄糖[C6H12O6(s)]的标准摩尔生成焓为-1272 kJ.mol-1,利用本书附表的数据计算它的燃烧热。
5-24经测定,葡萄糖完全氧化反应:C6H12O6(s)+6 O2(g) ====6CO2(g) +H2O(l)的标准摩尔反应自由能为-2840 kJ.mol-1,试查出产物的标准生成自由能,计算葡萄糖的标准摩尔生成自由能。
将所得数据与上题的生成焓数据做比较。
5-25已知N2、NO 和O2的解离焓分别为 941.7 kJ.mol-1、631.8 kJ.mol-1和493.7 kJ.mol-1,仅利用这些数据判断NO 在常温常压下能不能自发分解。
5-26 预计下列反应是熵增反应还是熵减反应?不能预计的通过标准熵进行计算。
(1)葡萄糖燃烧;(2)乙炔燃烧;(3)碳酸氢钠分解;(4)铁丝燃烧;(5)甲烷与水蒸气反应生成水煤气(steam gas---CO与H2的混合气);(6)甲烷和氧气反应生成合成气(syngas---CO 和H2的混合气体)。
5-27查阅热力学数据表,试回答,若在常温下将碳(石墨)氧化为一氧化碳的反应做成燃烧电池,这个电池可以提供的最大电能多大?在电池放电时,吸热还是放热?这个电池的焓变多大?是正值还是负值?由此题你对焓的概念有什么新的认识?5-28碘钨灯因在灯内发生如下可逆反应:W(s) + I2(g) ====WI2(g)碘蒸气与扩散到玻璃内壁的钨会反应生成碘化钨气体,后者扩散到钨丝附近会因钨丝的高温而分解出钨重新沉积到钨丝上去,从而延长灯丝的使用寿命。
已知在298 K时: W(s) WI2(g) I2(g)△f G mθ/ kJ.mol-1 0 -8.37 19.327S mθ / J.mol-1 .K-1 33.5 251 260.69(a)设玻璃内壁的温度为623K ,计算上式反应的△f G mθ(623K) 。
(b)估计WI2(g)在钨丝上分解所需的最低温度。
5-30查出生成焓和标准熵,计算汽车尾气中的一氧化氮和一氧化碳在催化剂表面上反应生成氮气和二氧化碳在什么温度范围内是自发的。
这一反应能否实际发生?5-31石灰窑的碳酸钙需加热到多少度才能分解(这时,二氧化碳的分压达到标准压力)?若在一个用真空泵不断抽真空的系统内,系统内的气体压力保持10Pa ,加热到多少度,碳酸钙就能分解?5-32以下反应,哪些在常温的热力学标态下能自发向右进行?哪些不能?298K △r H mθ/ kJ.mol-1△r S mθ/ J.mol-1.K-1(1)2CO2(g)===2CO (g)+O2(g) 566.1 174(2)2N2O(g)===N2(g) +O2(g) -163 22.6(3)NO2(g) ====2N2(g) + O2(g) 113 145(4)2NO2(g) === 2NO(g) +O2(g) -67.8 120(5)CaCO3 (l)===CaO(l) +CO2(g) 178.0 161(6)C(s) + O2(g) === CO2(g) -393.5 3.1(7)CaF2(s) +aq ===CaF2(aq) 6.3 -1525-40分辨如下概念的物理意义:(1)封闭系统和孤立系统。
(2)环境压力和标准压力。
(3)热力学标准态和理想气体标准状态。
(4)气体的分压和分体积。
(5)功﹑热和能。
(6)等压膨胀和可逆膨胀功。
(7)膨胀功和有用功。
(8)热力学能和焓。
(9)等压热效应和等容热效应。
(10)生成焓﹑燃烧焓和反应焓。
(11)过程和状态。
(12)状态函数和非状态函数。
(13)过程的自发性和可逆性。
(14)理想气体和非理想气体。
(15)标准自由能和非标准自由能。
(16)吸热化合物和放热化合物。
(17)标准熵和反应熵。
(18)熵增大原理的适用系统。
(19)热力学分解温度与实际分解温度。
(20)热力学和动力学。
5-41判断以下说法的正确与错误,尽量用一句话给出你作出判断的根据。
(1)温度高的物体比温度低的物体有更多的热。
(2)氢氧爆鸣气反应产生的热使气体体积急剧膨胀引起爆炸。
(3)加热向碳酸钙提供了能量导致了碳酸钙分解。
(4)醋酸溶于水自发电离产生氢离子和醋酸根离子,这是由于醋酸电离反应的标准摩尔自由能的数符是负值。
(5)碳酸钙的生产焓等于CaO(s) + CO2(g) ===CaCO3 (s) 的反应焓。
(6)高锰酸钾不稳定,加热分解放出氧气,是由于高锰酸钾是吸热化合物。
(7)高锰酸钾在常温下能够稳定存在是由于它在常温下的标准生成自由能大于零。