化学热力学基础
- 格式:ppt
- 大小:137.00 KB
- 文档页数:1







化学热力学基础热力学是研究能量变化和转化的科学,而化学热力学则专注于研究化学反应中的能量变化和转化。
在化学反应中,物质的能量发生了变化,这种变化可以通过热力学原理和方程来描述和计算。
本文将介绍化学热力学的基本概念、方程和应用。
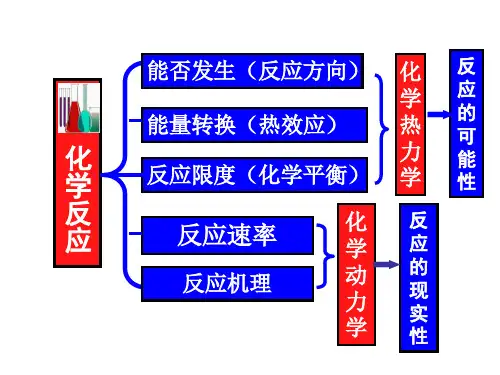
一、热力学基本概念1. 系统和周围:热力学研究的对象称为系统,而系统以外的一切称为周围。
系统和周围可以通过物质和能量的交换而发生相互作用。
2. 状态函数:热力学的基本量不依赖于路径,只与初始状态和终态有关,被称为状态函数。
例如温度、压力、体积、内能等都是状态函数。
3. 第一法则:能量守恒定律,即能量既不能创造也不能消失,只能从一种形式转化为另一种形式。
对于化学反应,能量的变化可以表示为热量和功的转化。
4. 第二法则:熵增原理,即自然界趋向于无序与熵增加的状态。
化学反应中,反应通常会使系统的熵增加。
5. 第三法则:绝对零度,即温度低于绝对零度(0K)时,系统的熵趋于零。
这个法则揭示了温度对于熵的影响。
二、熵变与自由能1. 熵变:熵变(ΔS)是描述系统熵增或减的度量,根据熵变可以判断反应的方向性和自发性。
当ΔS大于零时,反应向有序的方向进行,反之向无序的方向进行。
2. 熵变的计算:对于化学反应,熵变可以根据摩尔熵变的差值计算得到。
摩尔熵变可以通过标准摩尔熵的差异计算得到。
3. 自由能:自由能(G)是描述系统可用能量的函数,用于预测反应的可能性。
自由能与熵变和焓变有关,可以通过关联熵变、焓变和温度的方程计算得到。
三、焓变与反应热量1. 焓变:焓变(ΔH)是化学反应中吸热或放热的度量,可以用于判断反应的放热性质和温度变化。
当ΔH小于零时,反应放热;当ΔH 大于零时,反应吸热。
2. 焓变的计算:焓变可以通过化学反应的热化学方程式和反应热量的测定来计算得到。
3. 反应热量:反应热量是化学反应中产生或吸收的热量,可以通过实验测量得到。
反应热量可以用于判断反应的热效应及其在工业和实验室中的应用。


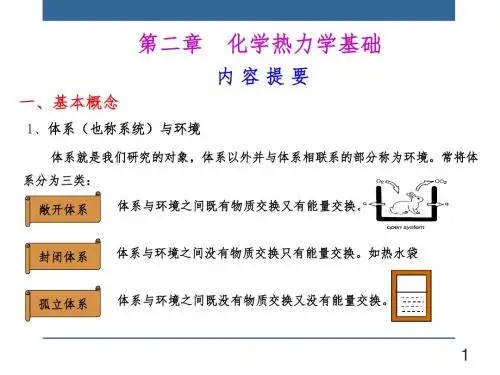
第一章化学热力学基础第一节热力学第一定律一、基本概念和常用术语1、体系和环境体系:被选作研究对象的部分。
环境:体系之外并与体系密切相关的部分。
敞开体系:与环境有物质交换、有能量交换。
封闭体系:与环境无物质交换、有能量交换。
孤立体系:与环境无物质交换、无能量交换。
2、状态和状态函数状态:体系的宏观性质的综合表现。
状态函数:确定体系状态的物理量。
(p, V, T, U, H, S, G)状态函数特征:状态函数的改变量只与体系的始态、终态有关,而与变化途径无关。
分类:广度性质(具有加和性)强度性质(不具有加和性T, p )3、过程和途径过程:当体系的状态发生变化时,发生变化的经过。
途径:完成状态变化过程的具体步骤。
等容过程等温过程等压过程绝热过程二、热力学第一定律1、热和功(体系与环境能量交换的两种形式)规定:体系吸热:Q >0体系放热:Q <0环境对体系做功:W >0体系对环境做功:W <0特 点: 热和功不是状态函数其数值与具体途径有关2、热力学能U特 点: 是状态函数,广度性质,其绝对值未知。
3、热力学第一定律该定律的实质是能量守恒与转化定律。
第二节 化学反应的热效应一、反应热在封闭体系、非体积功=0的前提下,当反应物和生成物温度相同时,化学反应过程中吸收或放出的热量。
1. 恒容反应热(QV)W =0+(- p e x V )=0U= QV + W= QVQV 全部用于改变系统的热力学能2.恒压反应热 U Q V ∆=Vp Q U p ∆-=∆ex()12ex 12V V p Q U U p --=- 定义焓: ()111222)(V p U V p U Q p +-+=状态函数,广度性质焓变:Qp = H pV U H +=3. 反应进度ξ(读作“克赛”)a A + d D = g G + h H0= – a A – d D + g G + h H写成通式式中符号B 表示反应中的物质,而νB 为数字或简分数,称为物质B 的化学计量数。