九年级化学单元网络第十一单元
- 格式:docx
- 大小:13.86 KB
- 文档页数:1

第十一单元盐化肥教材知识梳理知识点一:常见的盐及其用途1.日常生活中所说的盐,通常指食盐(主要成分是);而化学中的盐是指一类组成里含有和的化合物。
2. 是重要的调味品。
它还有很多的用途,例如医疗上的,农业上用它来,还可以作为化工原料,还可以腌制食品延长保存时间。
公路上的积雪也可以用来消除等。
3. 是一种工业用盐,有毒、有咸味,外形与食盐相似,人若误食会引起。
4.碳酸钠俗称或。
在工业上,碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
我国制碱工业的先驱— 发明了侯氏制碱法,这里的碱是指纯碱— (写化学式)。
5.天然存在的或的主要成分就是碳酸钙,它们都是重要的。
碳酸钙还可用作。
6.碳酸氢钠俗称。
碳酸氢钠是焙制糕点所用的的主要成分之一。
在医疗上,它是治疗的一种药剂。
碳酸氢钠跟碳酸钠一样能跟酸反应产生二氧化碳和水。
但碳酸氢钠又不同于碳酸钠的性质是:能产生碳酸钠、二氧化碳和水。
知识点二:复分解反应及其发生的条件7.两种互相交换成分,生成另外两种化合物的反应叫做反应。
只有当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生。
8.常见沉淀:(写出其化学式)(1)蓝色沉淀:;(2)红褐色沉淀:;(3)既不溶于水也不溶于酸的白色沉淀:、;(4)溶于酸且能与酸反应产生气体的白色沉淀:、;(5)溶于酸且能治疗胃酸过多的白色沉淀:、。
9. 分析下列三个化学反应,回答问题①BaCO3+2HCl=BaCl2+H2O+CO2↑②K2CO3+2HNO3=2KNO3 + H2O+CO2↑③Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(1)BaCO3、K2CO3、Na2CO3三种不同物质中,都含有的离子是,我们把这类盐叫做碳酸盐;(2)总结规律:碳酸盐能与酸反应生成气体;此外碳酸氢盐也能与酸发生反应生成该气体,例如蒸馒头揉面时需加入适量的,因为面团经过发酵后会产生乳酸等有机酸,与其反应生成二氧化碳气体,不但能除去面团中的酸味,还会使蒸出的馒头松软多孔。

九年级化学第十一单元知识点总结Unit 11: Salt and FertilizerI。
n of Salt: XXX metal ions (or NH4+) and acid radical ions.1.Sodium ChlorideCommonly known as table salt。
it is a white powder that hasa XXX uses include: (1) as a seasoning。
(2) as a preservative。
(3) XXX point。
(4) in agriculture。
XXX。
and (5) to make XXX (0.9% XXX)。
Na+ maintains the n of water inside and outside the cell。
promoting the exchange of substances inside and outside the cell。
while Cl- promotes the n of hydrochloric acid。
helps n。
and increases appetite。
It is also used in the glass。
paper。
XXX。
detergent。
and food industries.2.Sodium CarbonateAlso known as soda ash。
it is a white powder that has XXX in water。
It is used in XXX。
it is used to XXX.II。
n of Coarse SaltXXX calcium chloride。
which can absorb moisture from the air and XXX purify coarse salt。
the XXX: n。

人教版九年级化学第十一单元盐和化肥知识点1、氯化钠:NaCl,食盐的主要成分物性:白色粉末状固体易溶于水用途:①、重要的调味品,②、医疗上配制生理盐水,③、农业上配制溶液选种,④、工业上作重要原材料,制取Na₂CO₃、NaOH、Cl₂、HCl等⑤、生活中腌制蔬菜、水果、肉类⑥、交通方面,用NaCl除积雪。
(其他可溶性盐也具有这种性质,但要注意环保)。
2、粗盐:含有可溶性NaCl、MgCl₂、CaCl₂,也含难溶性固体:如泥沙。
粗盐提纯方法:溶解→沉淀(反应或静置或吸附)→过滤→蒸发→结晶。
3、①名称:碳酸钠②化学式:Na₂CO₃③俗称:纯碱、苏打④物性:白色粉末状固体易溶于水⑤用途:工业原料,广泛用于玻璃、造纸、纺织和洗涤剂生产等4、①名称:碳酸钙②化学式:CaCO₃③主要成份:大理石,石灰石、鸡蛋壳、贝壳④物性:白色粉末状固体,难溶于水⑤用途:建筑材料、补钙剂、摩擦剂等。
5、①名称:碳酸氢钠②化学式:NaHCO₃③俗称:小苏打④物性:白色粉末状固体、可溶于水⑤、用途:发酵粉主要成分之一,医疗上治疗胃酸过多症,除去浓硫酸清洗后的残留液。
6、碳酸钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:Na₂CO₃+2HCl=2NaCl+CO₂↑+H207、碳酸氢钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:NaHCO₃+HCl=NaCl+CO₂↑+H₂O8、CO32-、HCO3-的鉴定方法①药品:稀盐酸、澄清石灰水②方法:取样,向待测样品中加入过量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-或HCO3-。
9、Na₂CO₃与Ca(OH)₂反应现象:溶液中有白色沉淀生成原理:Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH.10、Na₂CO₃与BaCl₂反应现象:溶液中有白色沉淀生成原理:Na2CO₃+BaCl₂=BaCO₃↓+2NaCl11、CuS04与Fe反应现象:在铁的表面析出红色物质,溶液由蓝色变为浅绿色。

九年级化学11单元知识点
(原创版)
目录
1.九年级化学第十一单元的主要内容
2.单元中的重点知识点
3.如何学习这一单元的知识
正文
九年级化学第十一单元主要涉及酸、碱和盐的化学性质,这是化学中重要的基础知识。
在这一单元中,学生需要掌握酸、碱和盐的定义、性质、发生反应的条件和规律,以及如何利用这些知识解决实际问题。
单元中的重点知识点包括:
1.酸、碱和盐的定义:酸是能够释放氢离子的物质,碱是能够释放氢氧根离子的物质,盐是酸和碱中所含离子部分发生交换形成的物质。
2.酸碱盐的性质:酸具有酸性、碱具有碱性、盐具有中性。
酸、碱和盐的水溶液可以呈现出不同的颜色,例如硫酸铜溶液为蓝色,氢氧化铁溶液为黄色,氯化钠溶液为无色。
3.酸碱盐的反应:酸和碱在一定条件下可以发生中和反应,生成盐和水。
酸和盐、碱和盐也可以发生反应,生成新的酸、碱或盐。
4.酸碱盐的用途:酸、碱和盐在生活和工业中具有广泛的应用,例如盐酸可以用于清洗金属表面,氢氧化钠可以用于处理污水,氯化钠可以用作调味品等。
要学习这一单元的知识,首先要加强对酸、碱和盐的概念和性质的理解,可以通过阅读教材、听老师讲解、做实验等方式进行学习。
其次,要掌握酸碱盐的反应规律,可以通过做习题、参加讨论等方式进行巩固。
最后,要结合实际应用,了解酸碱盐在生活和工业中的作用,增强学习的兴
趣和动力。
总的来说,九年级化学第十一单元的知识点是化学学习的重要基础,需要学生认真掌握。

第一单元、走进化学世界化学:是研究物质的组成、结构、性质以及变化规律的科学。
物理变化:没有新物质生成的变化。
化学变化:有新物质生成的变化。
物理性质:物质不需要通过化学变化就能表现出来的性质(包括:颜色、状态、气味、硬度、熔点、沸点、密度、水溶性)化学性质:物质在化学变化中表现出来的性质(包括:可燃性、还原性、氧化性、稳定性、活泼性)化学变化:蜡烛燃烧;区别: 化学性质:蜡烛能(可、易、是…的)燃烧。
对蜡烛燃烧的探究(P12—13)对人体呼出气体和吸入空气的探究(P14—16) ①使用药品要做到“三不”:不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
②取用药品应严格按照实验规定的用量取用,若没有说明用量,一般应按最小量,即液体1~2ml ;固体只需盖满试管底部。
③用剩的药品不能放回原瓶,也不要随意丢掉、更不要拿出实验室。
粉末状:(药匙或纸槽)(一斜二放三直立) 块状:(镊子或药匙)(一横二放三慢竖)大量:倾倒法(倾倒时瓶盖要倒放,标签向手心) 少量:用胶头滴管(注意胶头滴管的使用方法) 定量:量筒+胶头滴管(注意量筒的使用方法:读数时量筒必须放平,视线与量筒内液体的凹液面最低处保持水平)俯视:读数偏大,实际数偏小 仰视:读数偏小,实际数偏大 酒精灯的使用主要事项能直接加热:试管、燃烧匙、蒸发皿 加热仪器 垫石棉网:烧杯、烧瓶 不能加热:量筒、集气瓶、滴管等 液体:管外干燥;先预热;试管内液体不超过1/3;试管口向上倾斜45度,试管口不对人;固体:试管口略向下倾斜5、仪器的洗涤(干净标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股流下)6.仪器连接:右插进左,先湿润,再慢慢转动插进。
变化 物质的变化与性质 性质 学习化学的一个重要途径——化学实验 1、药品取用的规则2、固体药品的取用3、液体药品的取用4、给物质的加热 化学实验基本操作第二单元、我们周围的空气1、物性:无色无味的气体,密度比空气略小,难溶于水2、化性:不能燃烧,不支持燃烧,不能呼吸3、用途:1、氧气含量的实验测定(用红磷在空气中燃烧)实验现象:①红磷燃烧,产生大量白烟;②水进入瓶中大约占瓶体积的1/5化学方程式:4P + 5O 2 ===== 2P 2O 5结论:氧气约占空气体积的1/5①红磷量不足②装置漏气 ③瓶未冷却就打开夹子2、物性:无色无味的气体,密度比空气大,不易溶于水,在一定条件下可液化为淡蓝色液态氧,也可固化为淡蓝色的固态氧。

化学九年级十一单元知识点化学作为一门自然科学,研究物质的性质、组成和变化规律,对我们的生活和社会发展起着重要的作用。
在九年级的化学课程中,学生将接触到第十一单元的知识点,本文将对该单元中的主要内容进行介绍和探讨。
第十一单元主要涵盖了酸、碱和盐的相关知识,这些物质在我们的日常生活中无处不在,对环境和人体健康有着重要的影响。
在这一单元中,学生将学习到酸、碱和盐的定义、性质、制备和应用等方面的内容。
1. 酸的性质和制备酸是一类具有酸性的物质,其特点是呈酸味、导电、与碱反应能产生中和反应等。
学生在学习酸的性质时,可以通过实验来观察酸与金属、酸与碱、酸与酸指示剂等的反应,从而加深对酸性物质的理解。
在制备酸的过程中,学生将学习到常见的酸和其制备方法。
例如,硫酸、盐酸、硝酸等都是我们熟悉的酸,其制备方法有化学法、物理法等。
这些制备方法的学习不仅可以增加学生的实践操作能力,还能提高学生的分析和解决问题的能力。
2. 碱的性质和制备碱是一类具有碱性的物质,其特点是呈苦味、导电、与酸反应能产生中和反应等。
学生在学习碱的性质时,可以通过实验来观察碱与酸、碱与酸指示剂等的反应,从而深入了解碱性物质的特点。
在制备碱的过程中,学生将学习到常见的碱和其制备方法。
例如,氢氧化钠、氢氧化钙等都是我们熟悉的碱,其制备方法有化学法、物理法等。
这些制备方法的学习不仅可以增加学生的实验操作能力,还可以培养学生的观察和实验设计能力。
3. 盐的性质和制备盐是一类具有中性的物质,其特点是呈盐味、导电等。
学生在学习盐的性质时,可以通过实验来观察酸和碱中和产生的盐或金属与酸反应生成的盐,从而理解盐的特点。
在制备盐的过程中,学生将学习到常见的盐和其制备方法。
例如,氯化钠、硝酸钠等都是我们熟悉的盐,其制备方法有化学法、物理法等。
这些制备方法的学习不仅可以增加学生的实践操作能力,还可以提高学生的实验设计和问题解决能力。
通过对酸、碱和盐的学习,学生能够了解到这些物质在我们的日常生活中的应用。

化学九年级11单元知识点化学作为一门科学,研究的是物质的组成、结构、性质和变化规律。
在九年级的化学课程中,第11单元主要涉及化学方程式、物质的氧化和还原、电解质溶液以及酸碱中和等知识点。
让我们来一起探索这些内容。
第一部分:化学方程式化学方程式是化学反应过程的简略表示,通过方程式可以反映出反应物和生成物的组成及其摩尔比。
在化学方程式中,反应物位于反应式的左侧,生成物位于右侧,中间用箭头“→”连接。
例如,2H2 + O2 → 2H2O表示氢气和氧气反应生成水。
化学方程式中的反应物和生成物要满足质量守恒和电荷守恒定律。
质量守恒指的是反应物的质量等于生成物质量的总和,而电荷守恒要求反应前后的总电荷保持不变。
通过化学方程式,我们可以了解反应物与生成物之间的摩尔比,以及反应物和生成物的质量关系。
第二部分:物质的氧化和还原氧化和还原是一种常见的化学反应类型,其中氧化指的是物质失去电子,而还原则是物质获得电子。
以单质的氧化为例,当物质与氧气反应时,氧气得到了物质中元素的电子,因此称之为还原反应;相反,物质中元素失去了电子,称之为氧化反应。
在化学方程式中,氧化和还原反应常常同时进行,被称为氧化还原反应。
这类反应通过电子的转移,实现物质的氧化和还原,从而产生新的物质。
氧化还原反应在我们的日常生活中随处可见,例如金属的腐蚀、电池的工作原理等都与氧化还原反应有关。
第三部分:电解质溶液电解质溶液指的是能够导电的溶液,其中溶质分子或离子能够在溶液中自由移动。
电解质溶液可以通过溶解电离或者以水为媒介进行电离来形成。
在电解质溶液中,正离子向阴极(电极)迁移,而负离子向阳极(电极)迁移。
电解质溶液的电离程度越高,其导电性越强。
在实际应用中,电解质溶液的导电性可以用来检测物质的电离程度,如酸、碱和盐的溶液导电性可以区分它们的强弱。
电解质溶液也被广泛应用于电化学实验、电镀和电解等领域。
第四部分:酸碱中和酸和碱是化学中常见的概念,它们对水的溶液具有不同的酸碱性质。

九年级十一单元化学知识点化学是一门自然科学,研究物质的组成、结构、性质以及变化规律。
在九年级的化学学习中,你将学习到很多重要的知识点和概念。
本文将对九年级第十一单元的化学知识点进行系统总结和归纳。
1. 物质的三态及相互转化1.1 固态:分子或原子紧密有序排列,相对静止,具有一定形状和体积。
1.2 液态:分子或原子相对较近,无序排列,具有流动性、接触和粘附性,形状随容器变化,保持一定体积。
1.3 气态:分子或原子间距较大,高速运动,无固定形状和体积,可自由扩散和压缩。
2. 物质分离与纯净物2.1 混合物:由两种或两种以上的物质混合而成,具有物理性质的叠加效应。
可以通过物理手段进行分离。
2.2 纯净物:由同种组成部分构成,具有特定的化学性质,不能通过物理手段进行分离。
3. 化学变化与化学反应3.1 化学变化:物质在化学反应中发生的变化,原有的物质消失,新的物质产生。
3.2 化学反应:物质之间发生的具有质量守恒和能量守恒的变化过程。
4. 元素与化合物4.1 元素:由相同类型的原子组成,无法通过化学手段分解为其他物质。
4.2 化合物:由不同类型的元素通过化学反应结合而成,可以通过化学手段进行分解。
5. 元素周期表5.1 元素周期表是一种按照元素原子序数排列的表格,用于显示元素的周期性和规律性。
元素按照周期和族分组,具有相似的化学性质。
5.2 元素周期表中通常包括元素的原子序数、元素符号、相对原子质量等信息。
6. 原子结构6.1 原子由原子核和电子云组成。
6.2 原子核由质子和中子组成,带正电荷,以及电子云由电子组成,带负电荷。
6.3 元素的物理性质和化学性质由原子的结构和电子配置决定。
7. 元素化合价与化合物7.1 元素化合价:元素在化合物中所具有的相对电荷值。
7.2 同一族元素的化合价相同,不同族元素的化合价不同。
7.3 化合物由两种或者两种以上的元素以一定的比例结合而成。
8. 酸、碱与盐8.1 酸:能够产生氢离子(H+)的物质,通常具有酸性或者腐蚀性。

九年级化学十一单元知识点化学是一门丰富而复杂的科学,旨在研究物质的组成、结构、性质和变化过程。
九年级的化学学习包含了许多重要的知识点,其中化学十一单元是其中之一。
本文将介绍九年级化学十一单元的关键知识点和一些有趣的例子,以便于理解和掌握这些概念。
第一个重要的知识点是化学反应。
化学反应是物质之间发生变化的过程。
它可以用化学方程式表示,其中包含了反应物和生成物。
化学方程式中的化学式表示了物质的组成,反应物在方程式的左侧,生成物在右侧。
例如,当氢气与氧气发生反应时,会生成水。
这个反应可以用方程式表示为2H2(氢气)+ O2(氧气)→ 2H2O(水)。
第二个重要的知识点是化学平衡。
化学平衡指的是反应物和生成物之间的相对数量保持不变的状态。
反应物和生成物之间的相对浓度在达到平衡后不再发生改变,但是反应仍然在进行。
平衡状态下,反应物和生成物的速率相等。
例如,当二氧化碳溶解在水中时,会生成碳酸。
在达到平衡之后,二氧化碳和碳酸的浓度会保持不变。
第三个重要的知识点是酸碱反应。
酸碱反应是指酸和碱之间发生的化学反应。
酸具有酸性和碱具有碱性,它们可以通过 pH 值来衡量。
酸的 pH 值小于7,碱的 pH 值大于7,而中性物质的 pH 值为7。
例如,当氢氧化钠(碱)与盐酸(酸)反应时,会生成氯化钠和水。
这个反应可以用方程式表示为NaOH(氢氧化钠)+ HCl (盐酸)→ NaCl(氯化钠)+ H2O(水)。
第四个重要的知识点是氧化还原反应。
氧化还原反应是指物质失去或获得电子的过程。
在氧化还原反应中,物质可以被氧化剂氧化或被还原剂还原。
例如,当铁与氧气发生反应时,铁会被氧气氧化成铁氧化物。
这个反应可以用方程式表示为4Fe + 3O2 → 2Fe2O3。
第五个重要的知识点是物质的分子结构。
物质由分子组成,分子是由原子通过化学键结合而成的。
分子结构影响着物质的性质和化学反应。
例如,当水分子中的两个氢原子和一个氧原子通过共价键结合在一起时,水分子呈现出极性。

九年级化学11单元知识点
摘要:
1.九年级化学第十一单元的主要内容
2.单元中的重点知识点
3.溶液的形成及其基本特征
4.溶质、溶剂的种类和特点
5.溶液的命名方法
6.酸、碱和盐的化学式默写
7.初中化学知识点的总结和梳理
正文:
九年级化学第十一单元的知识点主要包括溶液的形成、溶质和溶剂的种类、溶液的命名方法以及酸、碱和盐的化学式默写。
在这个单元中,学生需要掌握溶液的基本特征和形成过程,了解不同溶质和溶剂的特点,以及如何正确地命名溶液。
此外,还需要对酸、碱和盐的化学式进行默写,加深对化学知识的理解。
溶液的形成是指一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。
溶液具有均一性和稳定性,其名称通常由溶质的溶剂溶液组成。
例如,碘酒是碘的酒精溶液。
值得注意的是,溶液不一定无色,例如硫酸铜溶液为蓝色,硫酸亚铁溶液为浅绿色,硫酸铁溶液为黄色。
溶质可以是固体、液体或气体,而水是最常用的溶剂。
溶液的质量等于溶质的质量加上溶剂的质量,溶液的体积等于溶质的体积加上溶剂的体积。
在九年级化学学习中,酸、碱和盐的化学式默写是一个重要的知识点。
学生需要熟练掌握常见酸、碱和盐的化学式,并了解它们的性质和用途。
为了更好地掌握九年级化学的知识点,学生可以通过总结和梳理的方式对已学过的内容进行复习。

九年级化学11单元知识点(一)九年级化学11单元知识点详解物质的性质和变化•物理性质–定义:物质在不改变其化学组成的情况下所表现出的特性–例子:颜色、形状、大小、密度等•化学性质–定义:物质在与其他物质发生化学反应时所表现出的特性–例子:腐蚀性、可燃性、稳定性等•物质的物理变化–定义:物质在改变外部条件下,如温度、压力等,而产生的性质或形态上的变化–例子:凝固、融化、沸腾等•物质的化学变化–定义:物质在与其他物质发生化学反应时,其化学组成发生变化的过程–例子:燃烧、氧化、腐败等物质的组成与结构•元素–定义:由同种原子组成的纯物质–例子:氧气、氢气、铁等•化合物–定义:由不同种类的原子以一定比例结合而成的物质–例子:水、二氧化碳、盐等•混合物–定义:由两种或两种以上的纯物质混合而成的物质–例子:空气、海水、土壤等•原子–定义:构成分子或离子的最小粒子–例子:氧原子、碳原子、氢原子等•分子–定义:由原子经化学键结合而成的粒子–例子:O2、H2O、CO2等•离子–定义:电荷不为零的原子或原子团–例子:Na+、Cl-、Ca2+等化学反应与化学方程式•化学反应–定义:物质发生化学变化的过程–例子:燃烧、腐蚀、酸碱中和等•反应物与生成物–定义:参与反应的物质称为反应物,反应后生成的物质称为生成物–例子:反应物:氧气、乙烯;生成物:二氧化碳、水•化学方程式–定义:用化学符号和化学式表示化学反应过程的表达式–例子:2H2 + O2 → 2H2O•氧化还原反应–定义:涉及到电子转移的化学反应–例子:金属与非金属的反应、酸与金属的反应等酸碱与中和反应•酸–定义:能产生氢离子的物质–例子:盐酸、硫酸、柠檬汁等•碱–定义:能产生氢氧根离子的物质–例子:氢氧化钠、氢氧化钾、氨水等•酸碱指示剂–定义:用于检测物质酸碱性质的化学物质–例子:酚酞、溴蓝等•中和反应–定义:酸与碱反应生成盐和水的化学反应–例子:HCl + NaOH → NaCl + H2O离子反应•离子反应的基本规律–定义:离子在水溶液中相互作用产生新物质的反应–例子:沉淀反应、气体生成反应等•沉淀反应–定义:在两个溶液混合后形成固体沉淀的反应–例子:AgNO3 + NaCl → AgCl↓ + NaNO3•气体生成反应–定义:在两个溶液混合后放出气体的反应–例子:HCl + ZnS → H2S↑ + ZnCl2离子方程式•离子方程式–定义:用离子表示化学反应的方程式–例子:2Ag+(aq) + 2Cl-(aq) + 2Na+(aq) + 2NO3-(aq) → 2AgCl↓(s) + 2Na+(aq) + 2NO3-(aq)•溶解度规律–定义:描述沉淀反应中固体沉淀的溶解情况–例子:溶解度越小,沉淀的量越大;溶解度越大,沉淀的量越小•离子方程式的平衡–定义:离子方程式中反应物和生成物的离子数要相等–例子:Al3+(aq) + 3OH-(aq) → Al(OH)3↓(s)电解质与非电解质•电解质–定义:能在水溶液中产生离子的物质–例子:NaCl、HCl、KOH等•非电解质–定义:不能在水溶液中产生离子的物质–例子:甘油、酒精、葡萄糖等•强电解质与弱电解质–定义:能完全离解生成离子的电解质称为强电解质,不能完全离解的则称为弱电解质–例子:强电解质:HCl、HNO3;弱电解质:CH3COOH、H2CO3 化学反应速率与化学平衡•化学反应速率–定义:单位时间内化学系统中物质浓度变化的快慢程度–影响因素:浓度、温度、催化剂等•化学平衡–定义:反应物与生成物浓度保持不变时的状态–特征:正向和逆向反应速率相等;宏观上看没有变化,微观上有反应在进行•平衡常数–定义:描述化学平衡达到的程度–例子:Kc、Kp以上是九年级化学11单元的相关知识点的详细解释,希望对你有帮助!。

第十一单元 《盐 化肥》学问点二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、 试验步骤:溶解、过滤、蒸发 2、 试验仪器三、盐的化学性质试验步骤溶解 过滤 蒸发试验仪器 烧杯、玻璃棒铁架台〔带铁圈〕、漏斗、烧杯、玻璃棒 铁架台〔带铁圈〕蒸发皿、酒精灯、玻璃棒1、 盐〔可溶〕+ 金属 1 → 金属 2 + 盐〔金属 1 比金属 2 活泼,K 、Ca 、Na 除外〕2、 盐 + 酸 → 盐 + 酸〔满足复分解反响的条件〕3、 盐 + 碱 → 盐 + 碱〔反响物需都可溶,且满足复分解反响的条件〕4、 盐 + 盐 → 两种盐〔反响物需都可溶,且满足复分解反响的条件〕 注:①复分解反响的条件:生成物中有沉淀或有气体或有水生成②常见沉淀:AgCl ↓ BaSO ↓Al(OH) ↓ Mg(OH) ↓ BaCO ↓ CaCO ↓白色沉淀4 3 2 3 3Fe(OH) ↓红褐色沉淀 Cu(OH) ↓蓝色沉淀32生成气体:H +与 CO 2- ;NH +与 OH -3 4生成水:H +与 OH -③反响实质:离子结合成H O :H +与 OH -2离子结合生成气体:H +与 CO 2-;NH +与 OH -34一、常见的盐 定义:能解离出金属离子(或 NH +)和酸根离子的化合物4 物质 氯化钠俗称 食盐物理性质 白色粉末,水溶液有咸味, 溶解度受温度影响不大 碳酸钠 Na CO 2 3碳 酸 氢 钠NaHCO 3 备注 纯碱〔因水溶液呈碱性〕苏打 小苏打白色粉末状 固体,易溶于水白色晶体, 易溶于水 用途〔1〕作调味品〔2〕作防腐剂 (3) 消退积雪〔降低雪的熔点〕 (4) 农业上用 NaCl 溶液来选种 (5) 制生理盐水〔0.9% NaCl 溶液〕Na +维持细胞内外的水分分布,促进细胞内外物质交换Cl - 促生盐酸、帮助消化,增进食欲用于玻璃、造纸、纺织、洗涤、食品工业等 制糕点所用的发酵粉 医疗上,治疗胃酸过多 1、粗盐中由于含有氯化镁、氯化钙等杂质,易吸取空气中的水分而潮解。

九年级化学11单元知识点摘要:一、九年级化学11单元概述二、11单元关键知识点梳理1.盐的分类和性质2.盐的溶解和溶液的形成3.酸碱盐的反应规律4.酸碱盐在生活中的应用三、11单元习题解析四、学习策略与建议正文:一、九年级化学11单元概述九年级化学11单元主要涉及酸碱盐的知识。
在这一单元,我们将学习酸碱盐的性质、分类、溶解规律以及它们在生活中的应用。
通过学习本单元内容,学生将对酸碱盐有更深入的理解,并为后续的化学学习打下基础。
二、11单元关键知识点梳理1.盐的分类和性质盐分为两类:一类是金属离子和非金属离子组成的化合物,如氯化钠(NaCl);另一类是酸根离子和金属离子组成的化合物,如硫酸钠(Na2SO4)。
盐具有不同的物理性质,如颜色、味道、溶解性等。
2.盐的溶解和溶液的形成当盐放入水中时,盐分子会与水分子相互作用,形成溶液。
溶液具有均一性和稳定性,溶液的颜色、味道、溶解度等与溶质和溶剂的性质有关。
3.酸碱盐的反应规律酸碱盐之间的反应遵循一定的规律。
例如,酸和碱反应生成盐和水,酸和盐反应生成新的酸和新的盐,碱和盐反应生成新的碱和新酸等。
通过掌握这些反应规律,我们可以更好地理解酸碱盐之间的变化。
4.酸碱盐在生活中的应用酸碱盐在现实生活中有许多应用。
例如,厨房中的调味品(如盐、醋、糖等)都是酸碱盐;医药领域中,一些盐类药物(如生理盐水)具有治疗作用;工业生产中也广泛应用酸碱盐等。
三、11单元习题解析为帮助大家更好地掌握11单元知识,我们将提供一些典型习题的解析。
这些习题涵盖盐的分类、溶解规律、酸碱盐反应等方面,希望大家通过做题加深理解。
四、学习策略与建议1.认真阅读教材,理解酸碱盐的相关概念和性质。
2.多做习题,加强理论与实践相结合,提高解题能力。
3.及时复习,巩固所学知识,避免遗忘。
4.参加课堂讨论和课外活动,拓宽视野,提高学习兴趣。
通过以上学习策略与建议,相信大家能够更好地掌握九年级化学11单元的知识,为未来的学习奠定坚实基础。
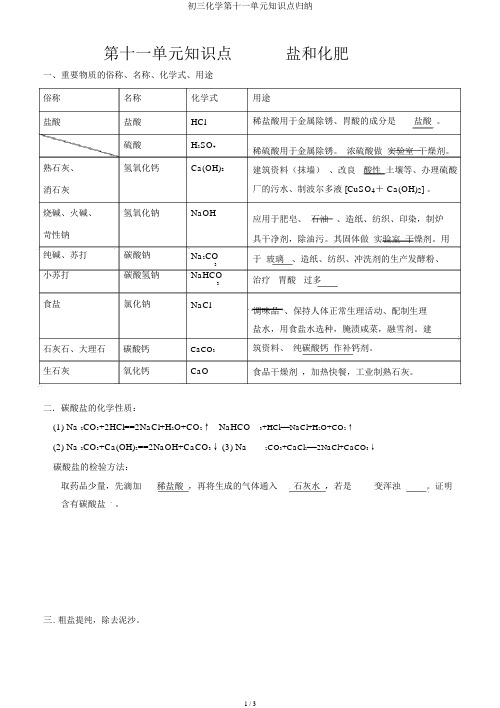
第十一单元知识点盐和化肥一、重要物质的俗称、名称、化学式、用途俗称名称化学式盐酸盐酸HCl硫酸H2SO4熟石灰、氢氧化钙Ca(OH)2消石灰烧碱、火碱、氢氧化钠NaOH 苛性钠纯碱、苏打碳酸钠Na2CO3小苏打碳酸氢钠NaHCO3食盐氯化钠NaCl石灰石、大理石碳酸钙CaCO3生石灰氧化钙CaO二.碳酸盐的化学性质:用途稀盐酸用于金属除锈、胃酸的成分是盐酸。
稀硫酸用于金属除锈。
浓硫酸做实验室干燥剂。
建筑资料(抹墙)、改良 _酸性土壤等、办理硫酸厂的污水、制波尔多液 [CuSO4+ Ca(OH)2] 。
应用于肥皂、石油 _、造纸、纺织、印染,制炉具干净剂,除油污。
其固体做实验室干燥剂。
用于玻璃 _、造纸、纺织、冲洗剂的生产发酵粉、治疗 _胃酸 _过多调味品、保持人体正常生理活动、配制生理盐水,用食盐水选种,腌渍咸菜,融雪剂。
建筑资料、纯碳酸钙作补钙剂。
食品干燥剂,加热快餐,工业制熟石灰。
(1) Na 2CO3+2HCl==2NaCl+H2O+CO2↑NaHCO3+HCl==NaCl+H2O+CO2↑(2) Na 2CO3+Ca(OH)2==2NaOH+CaCO3↓(3) Na2CO3+CaCl2==2NaCl+CaCO3↓碳酸盐的检验方法:取药品少量,先滴加_稀盐酸,再将生成的气体通入_石灰水,若是 ____变浑浊。
证明含有碳酸盐。
三. 粗盐提纯,除去泥沙。
1、操作步骤: __溶解 _、过滤、 _蒸发。
2、各步玻璃棒的作用:加速溶解、引流、_防液滴飞溅。
3、所需仪器:烧杯、玻璃棒、漏斗、铁架台、铁圈、蒸发皿、_酒精灯 _。
4、可能造成精盐产率低的原因_蒸发时液滴飞溅。
可能造成精盐产率高的原因_水分没有蒸干。
四 . 精制食盐,除去可溶物。
(1)、除去 NaCl 的可溶杂质 CaCl 2和 MgCl2:取样并溶解,加入 _ NaOH_ 溶液至过分,除去 MgCl2,接着再加入 _ Na2CO3_溶液至过分,除去 CaCl2。

九年级化学第十一章知识点化学作为一门自然科学,研究的是物质的性质、组成、结构、变化规律以及与能量的相互关系。
九年级化学的第十一章主要涉及化学反应速率、化学平衡和溶液中离子的动态平衡等知识点。
本文将以这些知识点为主线,深入剖析其原理与应用。
一、化学反应速率化学反应速率是指化学反应在单位时间内消耗物质或生成物质的量。
它是反映反应进行快慢的重要指标,也是判断反应效率的关键因素之一。
化学反应速率受多种因素的影响,如温度、浓度、催化剂和表面积等。
温度是影响化学反应速率的重要因素之一。
一般来说,温度升高,粒子活动加剧,化学反应速率也会增加。
这是因为高温下,分子的平均动能增加,碰撞机会增加,因而发生反应的机会也更多。
浓度是另一个影响化学反应速率的因素。
浓度越高,表明参与反应的物质分子数目越多,碰撞机会增加,从而加快反应速率。
催化剂是一种能够提高化学反应速率但本身并不参与反应的物质。
催化剂通过提供新的反应路径或减少反应的活化能,降低了反应的能量阈值,使化学反应更容易发生,从而加快了反应速率。
表面积是指物体单位质量或单位体积的外表面积。
表面积越大,固体反应物与液体或气体的接触面积就越大,反应速率也会相应增加。
二、化学平衡化学平衡是指在一定条件下,化学反应中反应物和生成物之间的比例保持不变的状态。
当反应物与生成物浓度达到一定平衡时,正向反应与逆向反应同时进行,且反应速率相等。
平衡的动态过程中,物质的转化是不断进行的,但总体上反应物与生成物的质量、浓度保持一定的比例。
平衡常数是描述化学平衡状态的一个重要参数。
平衡常数与平衡浓度之比有关,它的大小反映了反应物与生成物浓度之间的相对关系。
平衡常数大于1表示生成物浓度较多,反应趋向正向进行;平衡常数小于1表示反应物浓度较多,反应趋向逆向进行。
在平衡体系中,Le Chatelier's原理是描述物质在受到外界影响时如何达到新的平衡状态的重要原则。
根据Le Chatelier's原理,当平衡体系受到压力、温度、浓度等的改变时,系统将产生相应的变化以恢复平衡。

千里之行,始于足下。
九年级化学第十一单元知识点总结第十一单元主要涉及以下几个知识点:1. 元素周期表:九年级化学学习的重点是元素周期表,了解元素周期表的组成和特点,包括元素的周期性、族性、周期表的分类和命名规则等。
2. 元素的周期性:周期表上的元素是按照原子序数的大小排列的,原子序数逐渐增加,元素的性质也会发生周期性的变化。
例如,周期表的第一周期上的元素是金属锂、铍、硼等,它们有相似的性质,都是活泼的金属。
3. 元素的族性:周期表上的元素可以按照元素的性质进行分类,相同性质的元素被划分为一族。
周期表中有一些常见的元素家族,如碱金属、碱土金属、卤素等。
4. 阳离子和阴离子:在化学反应过程中,元素会失去或获得电子,形成带正电荷的离子叫做阳离子,带负电荷的离子叫做阴离子。
例如,氯原子获得一个电子形成氯离子Cl-,氧原子失去两个电子形成氧离子O2-。
5. 元素的电子层结构:了解元素的电子层结构对理解元素性质很重要。
电子层结构由电子的主能级、次能级和轨道组成,能量较低的层级能容纳的电子较多。
6. 元素的化合价:元素化合价是指一个原子在化合物中与其他原子结合时的电荷数,通过化合价可以推测元素的化合能力和化合方式。
第1页/共2页锲而不舍,金石可镂。
7. 元素的氧化还原:化合物中的元素可以发生氧化(失去电子)和还原(获得电子)反应,这种反应称为氧化还原反应。
根据元素的氧化态变化来描述氧化还原反应的化学方程式。
8. 元素的共价键和离子键:元素在化合物中结合的方式有共价键和离子键两种。
共价键是通过电子的共享形成的,通常是由两个非金属原子结合而成。
离子键是由电子的转移形成的,通常是由金属和非金属原子结合而成。
这些知识点是九年级化学第十一单元的重点内容,学好这些知识点对理解元素的性质和化合物的形成与性质具有重要意义。
第十一单元、盐与化肥
俗称:食盐
物性:
用途: 步骤:溶解→过滤→蒸发→计算产率 仪器:
溶解时:搅拌,加速溶解
粗盐提纯 玻璃棒用途 过滤时:引流
蒸发时:搅拌,防止局部温度过高,造成液滴飞溅
产率偏差原因 偏高:①过滤不干净;②蒸发时水没有蒸干。
偏低:①未充分溶解便过滤;②过滤
或蒸发时液滴飞溅;③转移固体不完全。
包括:碳酸钠(Na 2CO 3)、碳酸氢钠(NaHCO 3)、碳酸钙(CaCO 3)
俗称: 物性: 用途:
检验方法:(加盐酸,检验产物CO 2)
与金属反应:(如:Fe + CuSO 4 === Cu + FeSO 4) 与酸反应:(如:AgNO 3 + HCl === AgCl↓+ HNO 3) 与碱反应:(如:Ca(OH)2+Na 2CO 3 === CaCO 3↓+ 2NaOH ) 与盐反应:(如:Na 2SO 4 + BaCl 2 === 2NaCl + BaSO 4↓)
通式:AB + CD === AD + CB
复分解反应 条件:有H 2O 或↑或↓生成(酸、碱、盐的溶解性表P109) 应用:(物质共存、除杂质、鉴别)
分类:氮肥、磷肥、钾肥、复合肥
各种化肥的作用:氮肥(叶)、磷肥(果实)、钾肥(茎,抗倒伏)
氮肥 鉴别 磷肥 (①看外观或溶解→②加熟石灰研磨) 钾肥
使用化肥的利与弊 利:提高农作物的产量
弊:污染大气、污染土壤、污染水源、土壤退化
氯化钠 (NaCl ) 碳酸盐 盐的化性盐 (金属离子 +酸根离子) 化肥。