如何运用BLAST进行序列比对、检验引物特异性
- 格式:pdf
- 大小:548.92 KB
- 文档页数:2

Primer-BLAST:NCBI的引物设计和特异性检验工具一、Primer-BLAST介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-Blast可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
二、Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST 一样,点击底部的“Advanced parameters”有更多的参数设置。
(1)模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
(2)引物(Primers ) 如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters 区填入你的一条或一对引物。
并且选择好验证的目标数据库(在specificity check 区选择)。
根据需要可设置产物的大小,Tm 值等。
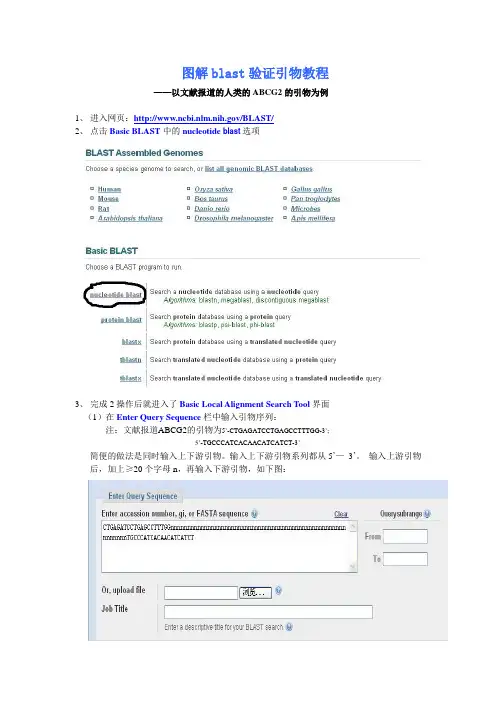
图解blast验证引物教程——以文献报道的人类的ABCG2的引物为例1、进入网页:/BLAST/2、点击Basic BLAST中的nucleotide blast选项3、完成2操作后就进入了Basic Local Alignment Search Tool界面(1)在Enter Query Sequence栏中输入引物序列:注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’;5’-TGCCCATCACAACATCATCT-3’简便的做法是同时输入上下游引物。
输入上下游引物系列都从5’—3’。
输入上游引物后,加上≥20个字母n,再输入下游引物,如下图:(2)在Choose Search Set栏中:Database根据预操作基因的种属定了,本引物可选Human genomic + transcript或Others (nr etc.)。
本人倾向于选后者,觉得此库信息更多。
如下图:(3)在Program Selection中:选择Somewhat similar sequences (blastn)项,如下图:(4)在此界面最下面:如下图Show results in a new window项是显示界面的形式,可选可不选,在此我们选上了。
关键要点击Algorithm parameters参数设置,进入参数设置界面。
4. 参数设置:(1)在General Parameters中:Expect thresshold期望阈值须改为1000,大于1000也可以;在Word size的下拉框将数字改为7。
如下图:(2)Scoring Parameters无须修改(3)Filters and Masking中,一般来说也没有必要改5.点击最下面一栏的BLAST按钮,如图:6.点击BLAST按钮后,跳转出现如下界面:7. 等待若干秒之后,自动跳转出现显示BLAST结果的网页。
该网页用三种形式来显示blast的结果。

Primer-BLAST:NCBI的引物设计和特异性检验工具一、Primer-BLAST介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-Blast可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
二、Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST 一样,点击底部的“Advanced parameters”有更多的参数设置。
(1)模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
(2)引物(Primers ) 如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters 区填入你的一条或一对引物。
并且选择好验证的目标数据库(在specificity check 区选择)。
根据需要可设置产物的大小,Tm 值等。

【必看】使⽤Primer-Blast⽐对引物的特异性使⽤ Primer-Blast ⽐对引物的特异性什么是引物的特异性引物是⼀段短的单链寡核苷酸,在PCR过程的退⽕阶段,引物与单链模板结合,DNA聚合酶沿着引物的3末端向后进⾏DNA的合成。
引物与模板的结合遵循碱基互补配对的原则,因此,当退⽕温度不合适或引物设计不合理时,引物会结合到模板的⾮⽬标区域,从⽽导致其他⽚段的扩增。
所谓引物特异性,就是引物结合模板正确位置的能⼒,或者避免结合⾮⽬标位置的能⼒。
引物的长度、GC含量、碱基分布、Tm值等性质,均会影响其特异性。
Primer-Blast⽐对引物特异性的原理NCBI收录了诸多物种的基因组DNA、编码序列mRNA以及其他相关核酸序列的数据。
使⽤Primer-Blast进⾏⽐对,⾸先要输⼊⼀对引物序列,并选择序列所属数据库。
此时系统将在该数据库中对序列进⾏查找和对⽐,并将引物可能结合的位置进⾏记录,⼀旦结合位置处于两条链并且产物⼤⼩符合要求,系统就会将这种情况列举到结果中。
需要注意的是,结合模板的引物不仅是⼀条正向⼀条反向,也有可能是两条正向或者两条反向引物。
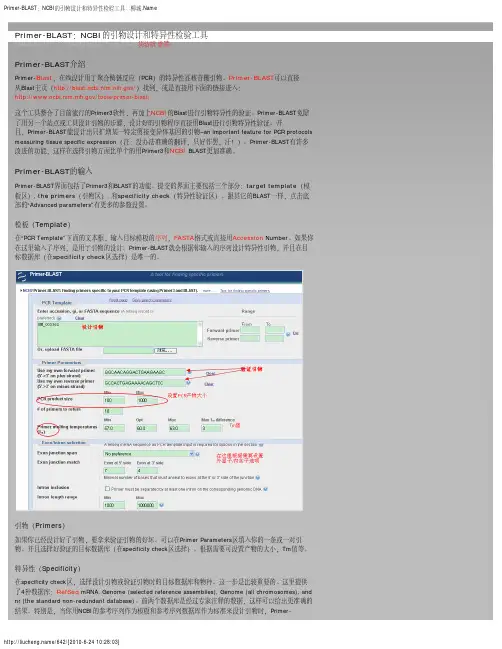
Primer-Blast⽐对引物特异性的步骤打开NCBI,进⼊Blast,⽹页如下:点击上图红框标记的Primer-Blast,进⼊如下界⾯,在界⾯引物序列处,将正反向引物序列粘贴进去,5-3⽅向。
产物⼤⼩默认为70~1000,可以根据实际情况进⾏调整。
选择相应的物种和参考数据库。
⾸先,要确保Specificity check⼀栏中已经打勾。
Search mode⼀般选择Automatic即可。
物种:⼈源的基因选择Homo sapiens(taxid:9606);⼩⿏的选择Mus musculus (taxid:10090);⼤⿏的选择Rattus norvegicus(taxid:10116)。
参考数据库:要看PCR的模板是什么,如果是提取的RNA反转录后得到cDNA就选择Refseq mRNA(针对mRNA)或Refseq RNA(针对mRNA和lncRNA);若模板是基因组,则应该选择Refseq representative genomes。
引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters区填入你的一条或一对引物。
并且选择好验证的目标数据库(在specificity check区选择)。
根据需要可设置产物的大小,Tm值等。
特异性(Specificity)在specificity check区,选择设计引物或验证引物时的目标数据库和物种。
这一步是比较重要的。
这里提供了4种数据库:RefSeq mRNA, Genome (selected reference assemblies), Genome (all chromosomes), and nr (the standard non-redundant database)。
前两个数据库是经过专家注释的数据,这样可以给出更准确的结果。
特别是,当你用NCBI的参考序列作为模板和参考序列数据库作为标准来设计引物时,Primer-BLAST可以设计出只扩增某一特定剪接变异体基因的特异引物。
selected reference assemblies 包括以下的物种: human, chimpanzee, mouse, rat, cow, dog, chicken, zebrafish, fruit fly, honeybee, Arabidopsis, 和rice。
Nr数据库覆盖NCBI所有的物种。
实例分析用人尿嘧啶DNA糖基化酶(uracil-DNA glycosylase genes, UNG, GeneID: 7374)的两个转录本序列作为一个例子来分析。
UNG1的序列长一点(NM_003362),UNG2的序列短一点(NM_080911,注:拿这两个基因的序列ClustalW一下就可以了)。
这里用UNG2的序列设计引物,选择RefSeq mRNA database,物种是Human,其它默认。
结果如下图A-B所示,设计的引物只能扩增出UNG2。

如何⽤Primer-Blast设计和验证引物——⽇读⼀帖,解螺旋⼤V团队伴你科研路【科研热点】让你时间⽐别⼈花的少、知道的⽐他早!【基⾦专栏】国⾃然等各项基⾦独到经验见解【SCI 专栏】从开始到接收全程tips【实验技能】这么棒快告诉你⽼板! 关注我们,为您的科研路提速 今天⽼谈给⼤家推荐NCBI的⼀款在线⼯具Primer-BLAST,⽤于PCR的特异性引物设计和特异性检验。
推荐的指数:5颗星。
理由:操作简单,使⽤⽅便,不需要安装程序,⽽且和NCBI数据库已⽐对,不⽤担⼼特异性问题。
理由:⼀、Primer-BLAST介绍 Primer-BLAST可以直接从Blast主页(/)找到,或是直接⽤下⾯的链接进⼊:/tools/primer-blast/,这个⼯具整合了⽬前流⾏的Primer3软件,再加上NCBI的Blast进⾏引物特异性的验证。
Primer-BLAST免除了⽤另⼀个站点或⼯具设计引物的步骤,设计好的引物程序直接⽤Blast进⾏引物特异性验证。
更强⼤的是Primer-BLAST能设计出只扩增某⼀特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,⽐单个的⽤Primer3和NCBI BLAST更加准确。
⼆、Primer-BLAST的输⼊ Primer-BLAST界⾯包括了Primer3和BLAST的功能。
提交的界⾯主要包括4部分:PCR Template(模板区), Primer Parameters(引物区), Exon/intron selection(外显⼦内含⼦设置)和specificity check(特异性验证区)。
(1)模板(Template) 在“PCR Template”下⾯的⽂本框,输⼊⽬标模板的序列,FASTA格式或直接⽤Accession Number。
如果你在这⾥输⼊了序列,是⽤于引物的设计。
Primer-BLAST就会根据你输⼊的序列设计特异性引物,并且在⽬标数据库(在specificity check区选择)是唯⼀的。

如何用Primer-Blast设计和验证引物——日读一帖,解螺旋大V团队伴你科研路【科研热点】让你时间比别人花的少、知道的比他早!【基金专栏】国自然等各项基金独到经验见解【SCI 专栏】从开始到接收全程tips【实验技能】这么棒快告诉你老板!关注我们,为您的科研路提速今天老谈给大家推荐NCBI的一款在线工具Primer-BLAST,用于PCR的特异性引物设计和特异性检验。
推荐的指数:5颗星。
理由:操作简单,使用方便,不需要安装程序,而且和NCBI数据库已比对,不用担心特异性问题。
一、Primer-BLAST介绍Primer-BLAST可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/,这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
更强大的是Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,比单个的用Primer3和NCBI BLAST更加准确。
二、Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括4部分:PCR Template(模板区), Primer Parameters (引物区), Exon/intron selection(外显子内含子设置)和specificity check(特异性验证区)。
(1)模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。

Primer-BLAST:NCBI的引物设计和特异性检验工具Primer-Blast介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-BLAST可以直接从Blast主页()找到,或是直接用下面的链接进入:这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物–an important feature for PCR protocols measuring tissue specific expression(注:没办法准确的翻译,只好作罢,汗!)。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST一样,点击底部的“Advanced parameters”有更多的参数设置。
模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST 就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters 区填入你的一条或一对引物。

如何利用BLAST分析验证引物序列引物设计完成之后,需要用软件进行分析,找到最佳的引物对,采用Blast分析验证引物,可以知道序列的正确性,也能知道引物的特异性状况、引物的具体位置以及PCR产物的大小。
先找到需要设计引物的目标基因的在有引物序列的mRNA序列,可以通过全文(如最先发现该基因的文章),全文中有时可以找到大鼠c-jun mRNA序列的ACCESSION NUMBER,在PubMed中的“Nucleotide”中用此ACCESSION NUMBER就能找到序列。
可以利用这个ACCESSION NUMBER在PubMed中的“Nucleotide”中搜索到序列后,点击右边的“Links”,再点击里面的“Related Sequences”就能找到所有的大鼠c-jun mRNA序列及其他物种的一些c-jun mRNA序列。
文献中的引物最好先验证其序列正确,并用软件分析引物比较好后再采用。
通过BLAST 验证,既可知道序列是否正确,也可同时了解引物的特异性、引物的位置及PCR产物的大小等。
如果仅仅是为了验证引物序列是否正确(仅适合于基于完全匹配原则设计的引物),也可以用Blast的“Nucleotide-nucleotide BLAST (blastn )”或“Search for short, nearly exact matches”搜索,具体方法为:1. 打开Blast,点击“Nucleotide-nucleotide BLAST (blastn)”或“Search for short, nearly exact matches”2. 等新页面完全显示后,将引物序列直接copy到“Search”框(没有必要将下游引物序列转换成其互补链),下面3种方法都可以(我觉得3种方法的搜索结果没什么区别,没仔细比较过哦!)(1)直接拷贝上游引物序列,然后直接将下游引物序列拷贝在上游引物后面(2)直接拷贝上游引物序列,在上游引物序列后加一空格,然后直接将下游引物序列拷贝在空格后面(3)直接拷贝上游引物序列,换行,然后直接拷贝下游引物序列注意:记住上、下游引物的长度,如上游引物为19bp、下游引物为18bp,这在查看Blast结果时有用。

Primer-BLAST:NCBI的引物设计和特异性检验工具一、Primer-BLAST介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-Blast可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
二、Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST 一样,点击底部的“Advanced parameters”有更多的参数设置。
(1)模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
(2)引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters区填入你的一条或一对引物。
并且选择好验证的目标数据库(在specificity check区选择)。
根据需要可设置产物的大小,Tm值等。

最近看到很多战友在论坛上询问如何查询基因序列、如何进行引物设计、如何使用BLAST 进行序列比对……,这些问题在 NCBI 上都可以方便的找到答案。
现在我就结合我自己使用 NCBI的一些经历(经验)跟大家交流一下 BCBI 的使用。
希望大家都能发表自己的使用心得,让我们共同进步!我分以下几个部分说一下 NCBI 的使用:Part one 如何查找基因序列、mRNA、PromoterPart two 如何查找连续的 mRNA、cDNA、蛋白序列Part three 运用 STS 查找已经公布的引物序列Part four 如何运用 BLAST 进行序列比对、检验引物特异性特别感谢本版版主,将这个帖子置顶!从发帖到现在,很多战友对该帖给与了积极的关注,在此向给我投票的(以及想给我投票却暂时不能投票的)各位战友表示真诚的感谢,谢谢各位战友!请大家对以下我发表的内容提出自己的意见。
关于NCBI 其他方面的使用也请水平较高的战友给予补充First of all,还是让我们从查找基因序列开始。
第一部分利用Map viewer 查找基因序列、mRNA 序列、启动子(Promoter)下面以人的 IL6(白细胞介素 6)为例讲述一下具体的操作步骤1.打开Map viewer 页面,网址为:/mapview/index.html 在 search 的下拉菜单里选择物种,for 后面填写你的目的基因。
操作完毕如图所示:2.点击“GO”出现如下页面:3.在步骤二图示的右下角有一个Quick Filter,下面是让你选择的几个复选框,在Gene 前面的小方框里打勾,然后点击Filter. 出现下图:说明一下:1、染色体的红色区域即为你的目的基因所处位置。
2、下面参考序列给出了三个,是不同的部门做出来的,经我验证,序列有微小的差异,但总体来说基本相同。
尽管你分别点击后,序列代码、序列代码等有所差异,但碱基基本一致,不影响大家研究分析序列。
Primer-BLAST:NCBI的引物设计和特异性检验工具Primer-Blast介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-BLAST可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物–an important feature for PCR protocols measuring tissue specific expression(注:没办法准确的翻译,只好作罢,汗!)。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST一样,点击底部的“Adva nced parameters”有更多的参数设置。
模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST 就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
blast引物设计流程Blast引物设计是基因组、转录组和蛋白质组研究中不可或缺的一环。
BLAST(基本局部序列比对工具)是用于在数据库中相似序列的一种工具。
它能够在数据库中找到一条或多条与查询序列相似的序列,并计算相似度分数。
利用BLAST工具进行引物设计可以帮助研究人员快速鉴定和选择目标基因、转录本或蛋白质,并进行后续实验。
下面将详细介绍BLAST引物设计的流程。
1.确定目标序列:确定要设计引物的目标序列,可以是基因组、转录组或蛋白质组中的一个特定基因、转录本或蛋白质。
2. 数据库选择:选择适当的数据库进行BLAST。
根据实际需要,可以选择不同的数据库,包括NCBI的GenBank、RefSeq、EST、非冗余蛋白质数据库等。
3.引物设计参数:根据实验需求和目标序列的特点,设置合适的引物设计参数。
参数包括引物长度、引物Tm值、引物GC含量、引物之间的距离等。
4. 引物设计工具选择:选择合适的引物设计工具进行设计。
目前有许多在线工具和软件可以进行BLAST引物设计,例如Primer-BLAST、Primer3、Geneious等。
5.引物设计:根据设置的参数和目标序列,使用选择的引物设计工具进行引物设计。
工具通常会生成多个潜在的引物序列,根据设计要求和实验条件进行筛选。
6.引物特性分析:对设计的引物进行分析,包括引物的Tm值、互补性、二聚体形成、酶切位点等。
高Tm值可增加引物与目标序列的稳定性,互补性较低可以避免二聚体的形成,酶切位点可能会影响后续实验的结果。
7.引物合成:选择合适的引物合成厂商进行引物合成。
根据实验需求,可以选择合成标记有荧光染料或其他分子的引物。
8.引物验证:将合成的引物进行验证,可以通过聚合酶链反应(PCR)或其他测序技术进行验证。
验证引物的特异性和效率,并根据需要进行优化。
9.实验应用:将验证通过的引物应用于实验中,如PCR扩增、基因表达分析、基因组重组等。
BLAST引物设计的流程如上所述,通过合理设置参数、使用适当的工具和对引物进行验证,在基因组、转录组和蛋白质组研究中可以选择出最合适的引物。
blast引物设计流程BLAST (Basic Local Alignment Search Tool) 引物设计是分子生物学研究中一个非常重要的步骤。
它用于通过比对已知的DNA或RNA序列来选择特定区域的引物,以进行PCR(聚合酶链式反应)、RT-qPCR(逆转录定量聚合酶链式反应)和荧光原位杂交等实验技术。
在本文中,我们将详细介绍设计BLAST 引物的流程。
1.收集目标序列数据:首先,我们需要收集目标序列的数据。
目标序列可以是基因序列、mRNA序列或其他DNA/RNA序列。
这些数据可以从公共数据库(如GenBank)或实验室内部的数据库获得。
2.确定引物长度:下一步是确定引物的长度。
通常,引物的长度在18到25个碱基对之间,相对长度和GC含量对于PCR引物尤为重要。
3.构建BLAST数据库:在设计引物之前,我们需要构建一个BLAST数据库。
选择适当的引物长度和需要比对的目标序列,将这些序列导入数据库中。
BLAST数据库可以通过使用NCBI(National Center for Biotechnology Information)或其他Bioinformatics软件来构建。
4.查询引物序列:使用BLAST软件,将具有已收集的目标序列信息的引物序列输入到BLAST数据库中。
BLAST会在数据库中寻找与引物序列相似的序列。
基于比对结果,可以评估引物的特异性和亲合性。
5.分析BLAST结果:根据BLAST比对的结果,需要对引物进行评估和筛选。
主要考虑以下几个方面:-特异性:引物应该与目标序列非常特异性地结合,而不会与其他非靶DNA或RNA结合。
特异性可以通过比对结果中的E值(期望值)和匹配长度来评估。
-互补性:引物应与目标序列互补,以便正确结合并形成PCR产物。
通过比对结果来评估引物序列与目标序列的互补性。
- 引物结构: 引物应具有适当的物理参数,如长度、GC含量和熔解温度等。
这些特征可以使用Bioinformatics工具来评估和优化。
序列比对,绝大多数战友都会想到BLAST,但BLAST的使用确实又是一个很大的难题,因为他的功能比较强悍,里面涉及到的知识比较多,而且比对结束后输出的结果参数(指标)又很多。
如果把BLAST的使用详细的都讲出来,我想我发帖发到明天也发不完,更何况我自己也不是完全懂得BLAST的使用。
所以我在这里也就“画龙点睛”——以比对核酸序列为例来给大家介绍一下BLAST的使用,也算是BLAST的入门课程吧。
请看帖的战友好好体会,如果你用心看,在看帖完毕之后BLAST的基本使用(包括其他序列的比对)应该没有问题了。
一、打开BLAST页面,http://www.ncbi.nlm.nih.go/BLAST/ 打开后如图所示:(缩略图,点击图片链接看原图)对上面这个页面进行一下必要的介绍:BLAST的这个页面主体部分(左面)包括了三部分:BLAST Assembled Genomes、Basic BLAST、Specialized BLAST。
相信大家可以看懂这三个短语的意思,我就不多说了;我要说的是,可以认为这是三种序列比对的方法,或者说是BLAST的三条途径。
第一部分BLAST Assembled Genomes就是让你选择你要比对的物种,点击相应物种之后即可进入比对页面。
第二部分Basic BLAST包含了5个常用的BLAST,每一个都附有简短的介绍。
第三部分Specialized BLAST是一些特殊目的的BLAST,如IgBLAST、SNP等等,这个时候你就需要在Specialized BLAST部分做出适当的选择了。
总之,这是一个导航页面,它的目的是让你根据自己的比对目的选择相应的BLAST途径。
下面以最基本的核酸序列比对来谈一下BLAST的使用,期间我也会含沙射影的说一下其他序列比对的方法。
二、点击Basic BLAST部分的nucleotide blast链接到一个新的页面。
打开后如图所示:screen.width-333)this.width=screen.width-333" width=640 height=462 title="Click to iew full 2.JPG (849 X 613)" border=0 align=absmiddle> 介绍一下上述页面:Enter Query Sequence部分是让我们输入序列的,你可以直接把序列粘贴进去,也可以上传序列,还可以选择你要比对的序列的范围(留空就代表要比对你要输入的整个序列)。
NCBI中Blast可以用来进行序列比对、检验引物特异性Blast导航主页面主体包括三部分BLAST Assembled Genomes选择你要对比的物种,点击物种之后即可进入对比页面BasicBLAST包含5个常用的Blast,每一个都附有简单介绍SpecializedBLAST是一些特殊目的的Blast,如Primer-BLAST、IgBLAST根据需要做出选择本学期学习了最基本的核苷酸序列的比对点击BasicBLAST部分的nucleotide链接到一个新的页面,打开后的页面特征:大体上包括三个部分EnterQuerySequence部分可以让我们输入序列,其中的JobTitle部分可以为本次工作命一个名字ChooseSearchSet部分可以选择要与目的序列比对的物种或序列种类。
其中的EntrezQuery可以对比对结果进行适当的限制。
ProgramSelection部分可以选择本次对比的精确度,种内种间等等。
其次Blast按钮下面有一个“Algorithmparameters”算法参数,可设置参数。
点击Blast后,出现的页面大体上包括四个部分一."所询问和比对序列的简单信息1."询问序列的简单信息——名称、描述、分子类型、序列长度2."所比对数据库的名称、描述和所用程序二."GraphicSummary——blast结果图形显示相似度颜色图(黑、蓝、绿、粉红、红,相似度由低到高)三."Descriptions——blast结果描述区1."到其他数据库的链接2."描述以表格的形式呈现(以匹配分值从大到小排序)(1)Accession下程序比对的序列名称,点击相应的可以进入更为详细的mapviewer(2)Descriptions下是对所比对序列的简单描述接下来是5个结果数值:(3)Max score匹配分值,点击可进入第四部分相应序列的blast的详细比对结果(4)Total score总体分值(5)Query coverage覆盖率(6)E value——E(Expect)值,表示随机匹配的可能性。