恩诺沙星溶液内控质量标准
- 格式:doc
- 大小:32.50 KB
- 文档页数:2

制药有限公司恩诺沙星溶液生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、产品概述 (3)2、生产的工艺流程图 (4)3、操作过程及工艺条件 (4)4、生产质量控制要点 (6)5、设备一览表及主要设备生产能力 (6)6、工艺验证及具体要求 (7)7、中间品的控制 (7)8、验证工作要点 (7)9、工艺卫生和环境卫生 (7)10、技术经济指标计算 (8)11、技术安全及劳动保护 (9)12、劳动组织与岗位定员 (9)一、产品概述(1)产品名称商品名:通用名:恩诺沙星溶液(2)剂型:溶液(3)规格:500ml:25g;包装规格:500ml/瓶(4)处方:300L水+7.5kg恩诺沙星(5)依据:二OO五版《中国兽药典》一部(6)有效期:二年(7)成品贮存方法及注意事项:成品贮存方法:遮光、密闭保存。
注意事项:按用法用量使用。
(8)原辅材料、半成品和成品质量标准:参见:塑料瓶质量内控标准标签、说明书内控质量标准纯水内控质量标准恩诺沙星内控质量标准恩诺沙星溶液半成品内控质量标准恩诺沙星溶液成品内控质量标准(9)原辅材料贮存注意事项:贮藏:遮光、密封,在阴凉处保存(10)半成品检查方法及生产质量控制恩诺沙星口服液半成品检验标准操作规程(11)包装要求:20瓶/件(12)标签、说明书(附样本):二、流程图:注:加粗部分为主要控制点三、操作过程及工艺条件1 生产前的检查与确认1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
2 称量、配料2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。
对称量室内的案称、天平、量筒等计量器具进行校零。
称量人核对原辅料、中间产品的品名、规格、批号、合格证等确认无误后记录、签名。

恩诺沙星溶液(0.5%)本品为恩诺沙星的水溶液,含恩诺沙星(C19H22FN303)应为标示量的90.0%~110%。
[处方][制法][性状] 本品为淡黄色粘稠液体。
相对密度本品的相对密度(附录33页)为1.01~1.02。
[鉴别][检查] pH值应为9.5~11.5(附录40页)。
装量按最低装量检查法(附录67页)检查,应符合规定。
有关物质照含量测定项下方法测定,如相对保留时间约为0.72(1)与0.53(2)处出现杂质峰,与主峰面积比较(1)不得过1.5%,(2)不得过1.0%。
[含量测定] 照高效液相色谱法(附录24页)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;柱温40℃;检测波长为278nm;理论板数按恩诺沙星峰计算应不低于2000。
(流动相配制:取庚烷磺酸钠1.10g,磷酸二氢钾2.27g,加水800ml使溶解,加乙腈200ml混匀,用磷酸调节pH至2.2即可。
)测定法取本品适量(约相当于恩诺沙星50mg),精密称定,置100ml量瓶中,用甲酸液(0.1mol/L)稀释至刻度,摇匀,即得。
精密量取20μl注入液相色谱仪,记录色谱图;另取105℃干燥至恒重的恩诺沙星对照品,同法测定,按外标法,用相对密度将供试品量换算成m1数,计算,即得。
[功能与主治]/[作用与用途] 抗菌药。
用于防治猪大肠杆菌所致的胃肠道疾病。
[用法与用量]/[用法与判定] 仔猪用给药器经口给药一次量每3kg体重1ml 连用3天[注意事项][规格] lOOml:0.5g[贮藏] 遮光,密封保存。
[制剂]《进口兽药质量标准》2003年增补。


10%恩诺沙星可溶性粉生产工艺规程目录1、产品概述2、处方和依据3、工艺流程图4、制剂工艺过程及工艺条件5、原辅材料质量标准和检查方法6、中间体质量标准和检查方法7、成品质量标准和检查方法8、包装规格、包装材料质量标准9、说明书、产品文字说明和标志10、工艺要求11、设备一览表和主要设备生产能力12、技术安全与劳动保护13、劳动组织与产品生产周期14、原辅料消耗定额15、包装材料消耗定额16、动力消耗定额17、环境保护18、编制说明1 产品概述:1.1 产品特点:1.1.1性状:本品为、白色或淡黄色粉末。
1.1.2药理作用:恩诺沙星为兽医专用的第三代氟喹诺酮类,有广谱杀菌作用,对静止期和生长期的细菌均有效。
本品对多种革兰氏阴性杆菌有良好的抗菌作用,包括绿脓杆菌、肠杆菌属、弯曲杆菌属、志贺氏菌属、沙门氏菌属、气单胞菌属、嗜血杆菌属、耶尔森菌属、沙雷氏菌属、弧菌属、变形杆菌等。
对布鲁氏菌属、巴斯德氏菌属、丹毒丝菌、博德特氏菌、葡萄球菌、支原体属和衣原体也有效。
本品禽内服吸收迅速,分布容积大,在体内广泛分布,消除半衰期较长。
1.1.3适应症:主治禽的沙门氏菌、大肠杆菌、巴斯德氏菌、嗜血杆菌、葡萄球菌、链球菌及各种支原体所引起的感染。
1.1.4用法用量:混饮每lL水鸡25~75mg(以恩诺沙星计),一日两次,连用3-5天。
1.1.5 休药期鸡8日,产蛋鸡禁用。
1.1.6 规格:100g:10g(恩诺沙星)1.1.7 贮藏:遮光、密封、在干燥处保存。
1.1.8有效期:二年1.1.9批准文号:2 处方和依据2.1处方:100g恩诺沙星10g(折纯) 无水碳酸钠 5.0g 无水葡萄糖:85g2.2处方依据:《兽药国家标准化学药品、中药卷》第一册3工艺流程图4制剂工艺过程及工艺条件4.1总述:按生产指令单领取恩诺沙星原料药、无水碳酸钠和无水葡萄糖。
分别过80目筛后(剩余少量不合格同批原辅料汇总粉碎处理过80目筛),按处方量将恩诺沙星和无水碳酸钠混合均匀后与葡萄糖粉按等两递加法混合均匀,定量分装即可。
制药GMP管理文件
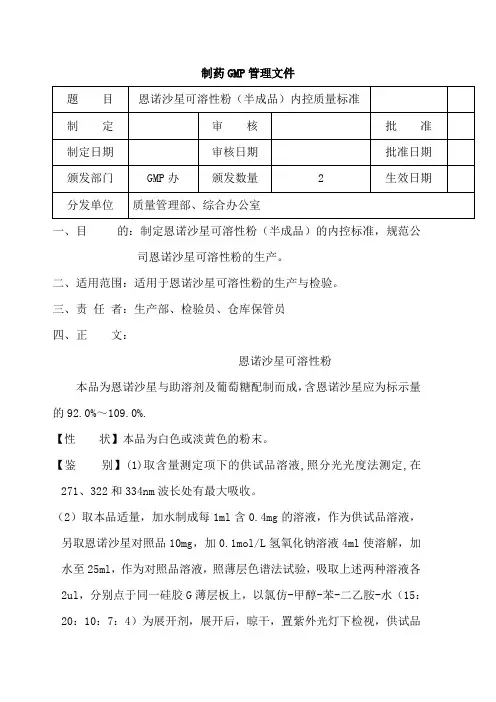
一、目的:制定恩诺沙星可溶性粉(半成品)的内控标准,规范公
司恩诺沙星可溶性粉的生产。
二、适用范围:适用于恩诺沙星可溶性粉的生产与检验。
三、责任者:生产部、检验员、仓库保管员
四、正文:
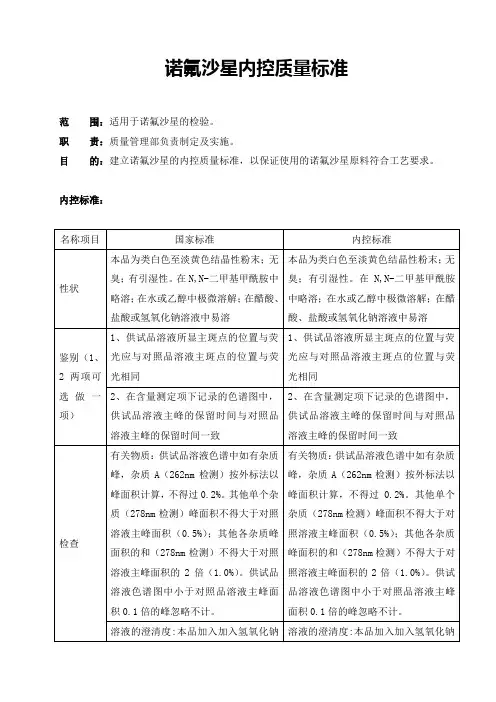
恩诺沙星可溶性粉
本品为恩诺沙星与助溶剂及葡萄糖配制而成,含恩诺沙星应为标示量的92.0%~109.0%.
【性状】本品为白色或淡黄色的粉末。
【鉴别】(1)取含量测定项下的供试品溶液,照分光光度法测定,在271、322和334nm波长处有最大吸收。
(2)取本品适量,加水制成每1ml含0.4mg的溶液,作为供试品溶液,另取恩诺沙星对照品10mg,加0.1mol/L氢氧化钠溶液4ml使溶解,加水至25ml,作为对照品溶液,照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一硅胶G薄层板上,以氯仿-甲醇-苯-二乙胺-水(15:20:10:7:4)为展开剂,展开后,晾干,置紫外光灯下检视,供试品
所显主斑点的荧光和位置应与对照品的主斑点相同。
【检查】pH值取溶解性项下的溶液,依法测定,pH值应为8.5-10.5. 溶解性取本品1.0g,加水50ml,搅拌,应全部溶解。
干燥失重取本品,在60℃减压干燥4小时,减失重量不得过8.0%.
装量按最低装量检查法检查,应符合规定.
【含量测定】取本品适量,精密称定,置500ml量瓶中,加氢氧化钠溶液(0.1mol/L)10ml,,振摇使溶解,加水稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加水稀释至刻度,摇匀,照分光光度法,在271nm 波长处测定吸收度,另取在105℃干燥至恒重的恩诺沙星对照品按上法同样测定;计算,即得。

GMP管理文件
一、目的:为规定恩诺沙星片生产过程中的质量控制和检验操作
要求,特制定此操作规程。
二、适用范围:适用于恩诺沙星片成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
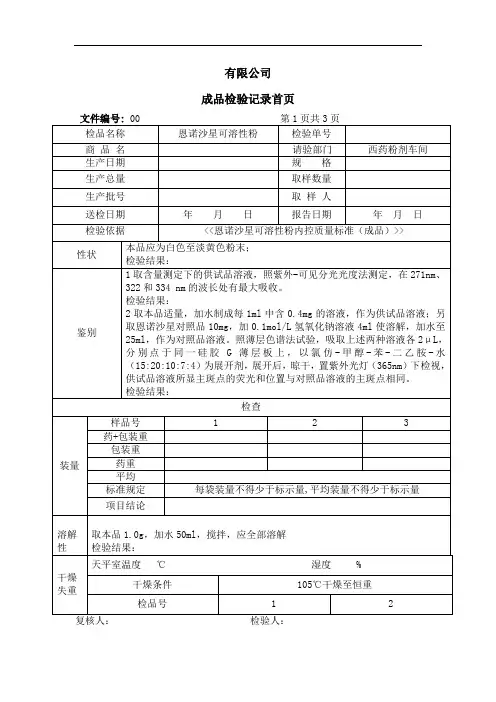
质量标准:见恩诺沙星片(成品)内控质量标准
操作内容:
【性状】本品为类白色片。
【鉴别】(1)取本品的细粉适量(约相当于恩诺沙星50mg),加稀醋酸溶解,滤过,取滤液,加碘化铋钾试液数滴,即生成橘红色沉淀。
(2)取含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】应符合片剂项下有关的各项规定。
【含量测定】取本品20片,精密称定,研细,精密称取适量(约相当于恩诺沙星25mg),加流动相70ml,超声15分钟,放冷,移入
100ml量瓶中,用流动相稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置25ml量瓶中,用流动相稀释至刻度,摇匀。
精密量取10ul,注入液相色谱仪,照恩诺沙星项下的方法测定,即得。
本品含恩诺沙星应为标示量的90.0%~110.0%。

GMP管理文件引用标准:恩诺沙星内控质量标准一、目的:为规定恩诺沙星的检查方法和操作要求,特制定此标准。
二、适用范围:适用于本公司恩诺沙星的质量检测。
三、责任者:检验员。
四、正文:检品名称:恩诺沙星分子式:C19H22FN3O3分子量:359.401.技术要求:1.1物理性状:取本品放在白纸上,在日光下观察为微黄色或淡橙黄色结晶性粉末;无臭,味微苦;遇光色渐变为橙红色。
本品在三氯甲烷中易溶,在二甲基酰胺中略溶,在甲醇中微溶,在水中极微溶解;在氢氧化钠试液中易溶。
熔点:取本品,照熔点测定法检测,把本品装入一段封口的毛细玻璃管中,压实,放入熔点仪中检测,本品的熔点为221-226℃。
熔融时同时分解。
1.2该产品应符合以下标准:2.鉴别2.1仪器与用具高效液相色谱仪、水浴锅、表面皿2.2操作方法(1)取本品约50mg放入试管中,加稀醋酸10ml,使溶解,加碘化铋钾试液数滴,即生成橘红色沉淀。
(2)取本品约50mg,置干燥的表面皿中,加丙二酸约50mg与醋酐1ml,在水浴上加热5-10分钟,即显红棕色。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
3检查3.1仪器与用具硅胶GF254薄层色谱板、高效液相色谱仪3.2操作方法氟喹啉酸取本品250mg放入25ml量瓶中,加0.1mol/L的氢氧化钠溶液溶解定容,稀释成每1ml中含10mg的溶液,作为供试品溶液。
取氟喹啉酸对照品5.0mg,置50ml的量瓶中,加6mol/L的氨溶液0.05ml与水适量使溶解,并用水稀释至刻度,摇匀,精密量取5ml置25ml量瓶中,用水稀释至刻度,使成每1ml中含0.02mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5µl,分别点于同一硅胶GF254薄层色谱板上,以乙酸乙酯-正丁醇-冰醋酸-水(50:9:25:15)为展开剂,直立展开,晾干约15分钟,置紫外灯(254nm)下检视。

盐酸恩诺沙星质量标准盐酸恩诺沙星是一种广谱抗生素,属于氟喹诺酮类药物。
它的质量标准对于保证药物的质量非常重要。
本文将以盐酸恩诺沙星质量标准为标题,对其相关内容进行详细介绍。
一、盐酸恩诺沙星的基本信息盐酸恩诺沙星是一种合成的氟喹诺酮类广谱抗生素,它对革兰氏阳性菌、革兰氏阴性菌以及一些肺炎支原体、衣原体等病原微生物具有较强的抗菌活性。
它的化学名为(±)-1-环己基-6-氟-1,4-二氢-4-氧-7-(2-噁唑基)-3-喹诺酮-3-羧酸盐酸盐。
二、盐酸恩诺沙星的质量标准盐酸恩诺沙星的质量标准是保证药物质量的重要依据。
根据国家药典等相关标准,其质量标准包括外观、比旋光度、溶解度、含量、相关物质、不同环境条件下的稳定性等多个方面。
1. 外观:盐酸恩诺沙星应为白色或类白色结晶性粉末,无可见杂质。
2. 比旋光度:盐酸恩诺沙星的比旋光度应在-18°至-20°之间。
3. 溶解度:盐酸恩诺沙星在水中的溶解度应不低于20mg/mL。
4. 含量:盐酸恩诺沙星的含量应在98.0%至102.0%之间。
5. 相关物质:盐酸恩诺沙星的相关物质应符合国家相关标准,其中特定杂质的含量应小于0.2%。
6. 稳定性:盐酸恩诺沙星在不同环境条件下的稳定性应符合相关标准,包括光照、温度、湿度等因素对药物质量的影响。
三、盐酸恩诺沙星的质量控制为了保证盐酸恩诺沙星的质量,生产过程中需要进行严格的质量控制。
其中包括原料药的选择与采购、生产工艺的优化与控制、质量检验的严格执行等环节。
1. 原料药的选择与采购:为了确保盐酸恩诺沙星的质量,必须选择高纯度的原料药,并与可靠的供应商建立长期稳定的合作关系。
2. 生产工艺的优化与控制:通过合理的工艺流程设计和严格的操作规范,确保盐酸恩诺沙星在生产过程中的纯度和质量稳定。
3. 质量检验的严格执行:生产过程中必须对盐酸恩诺沙星进行多个环节的质量检验,包括原料药的检验、中间体的检验、成品的检验等,以确保每一批药物的质量符合标准。
江苏长青兽药有限公司GMP管理文件一、目的:制定恩诺沙星标准,规范公司恩诺沙星的采购、使用。
二、适用范围:适用于恩诺沙星的采购、验收。
三、责任者:质保部、采供部。
四、正文:恩诺沙星EnnuoshaxingEnrofloxacinC19H22FN3O3359.40本品为1-环丙基-6-氟-4-氧代,4-二氢-7-(4-乙基-1-哌嗪基)-3-喹啉羧酸。
按干燥品计算,含C19H22FN3O3不得少于98.5%。
【性状】本品为微黄色或淡橙黄色结晶性粉末;无臭,味微苦;遇光色渐变为橙红色。
本品在氯仿中易溶,在二甲基甲酰胺中略溶,在甲醇中微溶,在水中极微溶解;在氢氧化钠试液中易溶。
熔点本品的熔点(附录34页)为221~226℃。
熔融时同时分解。
【性状】(1)取本品约50mg,加稀醋酸10ml,使溶解,加碘化铋钾试液数滴,即生成橘红色沉淀。
(2)取本品约50mg,置干燥的表面皿中,加丙二酸约50mg与醋酐1ml,在水浴上加热5~10分钟,即显红棕色。
(3)取本品,加0.1mol/L氢氧化钠溶液制成每1ml中约含5μg的溶液,照分光光度法(附录17页)测定,在271nm、322nm和334nm的波长处有最大吸收。
(4)本品的红外光吸收图谱应与对照的图谱一致。
【检查】氟取本品约40mg,精密称定,照氟检查法(附录53页)测定,按干燥品计算,含氟量不得少于5.0%。
氟喹啉酸取本品,加0.1mol/L氢氧化钠溶液溶解并制成每1ml中约含10mg的溶液,作为供试品溶液;另取氟喹啉酸对照品,加0.06mol/L氨溶液制成每1ml中约含0.1mg的溶液,再将此溶液加水制成每1ml中约含0.01mg和0.02mg的溶液,作为对照品溶液(1)和对照品溶液(2)。
照薄层色谱法(附录23页)试验,吸取上述3种溶液各5μl,分别点于同一硅胶GF薄层板上,以254醋酸乙酯-正丁醇-冰醋酸-水(50∶9∶25∶15)为展开剂,直立展开,晾干约15分钟,置紫外光灯(254nm)下检视。
盐酸恩诺沙星质量标准
盐酸恩诺沙星是一种广谱抗生素,具有很强的杀菌作用,被广泛应用于临床医学领域。
为了确保盐酸恩诺沙星的质量,制定了一系列的质量标准,以保证其在药物生产和临床使用过程中的安全性和有效性。
首先,盐酸恩诺沙星的外观应符合国家相关标准,应为白色或类白色结晶性粉末,无异物和机械杂质。
其次,在理化性质方面,盐酸恩诺沙星的熔点、溶解度、PH值等指标也应符合国家标准要求,以确保其稳定性和溶解性。
此外,对于有机杂质和重金属等有害物质的含量也有严格的限制,以保证盐酸恩诺沙星的纯度和安全性。
在药效学方面,盐酸恩诺沙星的含量和相关物质的含量也是质量标准所关注的重点。
盐酸恩诺沙星的含量应符合国家药典规定的要求,保证药物的有效成分含量稳定。
同时,对于可能存在的同分异构体、对映体和水合物等相关物质也有相应的限制,以保证盐酸恩诺沙星的纯度和药效。
除了以上所述的质量标准外,对于盐酸恩诺沙星的生产工艺、包装和贮存等方面也有相应的规定和要求,以保证整个生产和使用过程中的质量控制。
同时,针对不同用途和不同剂型的盐酸恩诺沙星制剂,还有相应的特殊要求和标准,以满足不同的临床需求。
总的来说,盐酸恩诺沙星作为一种重要的抗生素药物,在其质量标准中有着严格的要求和规定,以确保其在生产和临床使用过程中的安全性和有效性。
只有严格按照这些质量标准进行生产和使用,才能保证盐酸恩诺沙星的质量稳定,为临床治疗提供可靠的药物保障。
中华人民共和国农业农村部公告第55号——关于恩诺沙星溶液质量标准、标签和说明书样稿的公告
文章属性
•【制定机关】农业农村部
•【公布日期】2018.08.27
•【文号】中华人民共和国农业农村部公告第55号
•【施行日期】2018.08.27
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】农业科技
正文
中华人民共和国农业农村部公告
第55号
根据《兽药管理条例》,我部组织修订了拜耳(四川)动物保健有限公司提交的恩诺沙星溶液质量标准、标签和说明书样稿,现予发布,自发布之日起执行。
特此公告。
附件:1.恩诺沙星溶液质量标准
2.恩诺沙星溶液标签和说明书样稿
农业农村部
2018年8月27日。
2.5%恩诺沙星溶液标准以下是一份2.5%恩诺沙星溶液的标准文档,包括制备方法、质量标准和注意事项。
**2.5%恩诺沙星溶液标准****1. 制备方法:**取适量纯净水于容器中,称取恩诺沙星25克,溶解于纯净水中。
搅拌均匀后,即可得到2.5%恩诺沙星溶液。
**2. 质量标准:*** 外观:无色透明液体。
* 恩诺沙星含量:不少于2.5%(以重量计)。
* pH值:6.0-8.0。
* 无菌:经无菌检查,应无任何微生物生长。
**3. 注意事项:*** 该溶液应储存于阴凉、干燥处,避免阳光直射。
* 使用前应检查溶液是否澄清,如有浑浊或沉淀,不得使用。
* 该溶液为外用溶液,不得内服。
如不慎溅入眼内或与皮肤接触,应立即用大量清水冲洗。
* 对恩诺沙星过敏者禁用。
* 孕妇及哺乳期妇女慎用。
* 儿童应在成人监护下使用。
* 如出现皮肤刺激、红肿等症状,应立即停止使用并咨询医生。
* 该溶液应在开封后一个月内用完,过期不得使用。
* 药品应在有效期内使用,过期不得使用。
**4. 有效期:**本产品在2-8℃下可保存6个月。
为确保溶液质量,建议在开封后一个月内使用。
**5. 运输与包装:**本产品采用250ml的玻璃或塑料瓶进行包装,每瓶2.5%的恩诺沙星溶液。
在运输过程中,应确保容器密封,防止破损和污染。
**6. 生产日期与批号:**产品的生产日期和批号在产品标签上标明,消费者可依据此信息追溯产品的生产和使用情况。
---此文档仅供参考,实际操作中可能需要根据具体生产环境和设备进行调整。
同时,所有涉及药品生产和使用的操作,都应符合国家相关法律法规的规定。
恩诺沙星溶液生产工艺规程制药有限公司恩诺沙星溶液生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、产品概述 (3)2、生产的工艺流程图 (4)3、操作过程及工艺条件 (4)4、生产质量控制要点 (6)5、设备一览表及主要设备生产能力 (6)6、工艺验证及具体要求 (7)7、中间品的控制 (7)8、验证工作要点 (7)9、工艺卫生和环境卫生 (7)10、技术经济指标计算 (8)11、技术安全及劳动保护 (9)12、劳动组织与岗位定员 (9)一、产品概述(1)产品名称商品名:通用名:恩诺沙星溶液(2)剂型:溶液(3)规格:500ml:25g;包装规格:500ml/瓶(4)处方:300L水+7.5kg恩诺沙星(5)依据:二OO五版《中国兽药典》一部(6)有效期:二年(7)成品贮存方法及注意事项:成品贮存方法:遮光、密闭保存。
注意事项:按用法用量使用。
(8)原辅材料、半成品和成品质量标准:参见:塑料瓶质量内控标准标签、说明书内控质量标准纯水内控质量标准恩诺沙星内控质量标准恩诺沙星溶液半成品内控质量标准恩诺沙星溶液成品内控质量标准(9)原辅材料贮存注意事项:贮藏:遮光、密封,在阴凉处保存(10)半成品检查方法及生产质量控制恩诺沙星口服液半成品检验标准操作规程(11)包装要求:20瓶/件(12)标签、说明书(附样本):二、流程图:注:加粗部分为主要控制点三、操作过程及工艺条件1 生产前的检查与确认1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
2 称量、配料2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。
对称量室内的案称、天平、量筒等计量器具进行校零。
制药GMP管理文件
一、目的:本标准适用于恩诺沙星溶液的内控质量标准,规范
公司恩诺沙星溶液的采购与使用。
二、适用范围:适用于恩诺沙星溶液的采购与使用。
三、责任者:质检员。
四、正文:
恩诺沙星溶液
本品为恩诺星的水溶液.含恩诺沙星(C19H22FN3O3)应为标示量的92.0%~109.0%.
【性状】本品为几乎无色至淡黄色的澄清液体.
【鉴别】取本品,照恩诺沙星注射液项下的鉴别试验,应显相同的结果.
【检查】PH值应为11.5~12.5.
颜色取本品,加水制成每1ml中含25mg的溶液,依法检查,与黄色3号标准比色液比较,不得更深。
其他应符合内服溶液项下有关的各项规定。
【含量测定】精密量取本品适量,用流动相稀释成每1ml中约含恩诺
沙星0.05mg的溶液,摇匀,精密量取10ul,注入液相色谱仪,照恩诺沙星项下的方法测定,即得。
【类别】同恩诺沙星。
【规格】(1)100ml:2.5g (2)100ml:5g (3)100ml:10g 【贮藏】遮光,密封保存.。