扩散与固相反应
- 格式:docx
- 大小:74.65 KB
- 文档页数:8






实验28 热重分析技术在固相反应研究中的应用一、实验目的固相反应是材料制备中一个重要的高温动力学过程,固体之间能否进行反应、反应完成的程度、反应过程的控制等直接影响材料的显微结构,并最终决定材料的性质,因此,研究固体之间反应的机理及动力学规律,对传统和新型无机非金属材料的生产有重要的意义。
本实验的目的:1.掌握TG法的原理,熟悉采用TG法研究固相反应的方法。
2.通过CaCO3-SiO2系统的反应验证固相反应的动力学规律─杨德方程。
3.通过作图计算出反应的速度常数和反应的表观活化能。
二、实验原理许多固体材料在在高温下加热时,因其中的某些组分分解逸出或固体与周围介质中的某些物质作用使固体物系的重量发生变化,如盐类的分解、含水矿物的脱水、有机质的燃烧等会使物系重量减轻,高温氧化、反应烧结等则会使物系重量增加。
热重分析法(Thermogravimetric Analysis.简称TG) 及微商热重法(derivative thermogravimetry,简称DTG 法)是在程序控制温度下,测量物质质量与温度关系的一种技术。
微商热重法所记录的是TG曲线对温度或时间的一阶导数,所得的曲线称为DTG曲线。
现在的热重分析仪常与微分装置联用,可同时得到TG- DTG曲线。
通过测量物系质量随温度或时间的变化可以间接地揭示固体物系反应的机理和/或反应动力学规律。
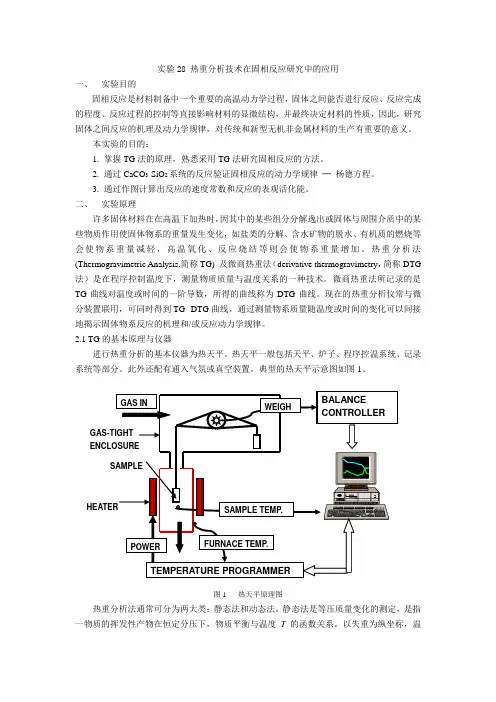
2.1 TG的基本原理与仪器进行热重分析的基本仪器为热天平。
热天平一般包括天平、炉子、程序控温系统、记录系统等部分。
此外还配有通入气氛或真空装置。
典型的热天平示意图如图1。
图1 热天平原理图热重分析法通常可分为两大类:静态法和动态法。
静态法是等压质量变化的测定,是指一物质的挥发性产物在恒定分压下,物质平衡与温度T的函数关系。
以失重为纵坐标,温度T为横坐标作等压质量变化曲线图。
等温质量变化的测定是指一物质在恒温下,物质质量变化与时间t的依赖关系,以质量变化为纵坐标,以时间为横坐标,获得等温质量变化曲线图。



第七章 扩散与固相反应例 题7-1 试分析碳原子在面心立方和体心立方铁八面体空隙间跳跃情况,并以D =γr 2Γ形式写出其扩散系数(设点阵常数为a )。
(式中r 为跃迁自由程;γ为几何因子;Γ为跃迁频率。
)解:在面心立方晶体中,八面体空隙中心在晶胞体心及棱边中心。
相邻空隙连线均为[110]晶向,空隙间距为。
因而碳原子通过在平行的[110]晶面之间跳动完成扩散。
若取[110]为X 轴、]101[为Y 轴、[001]为Z 轴,则碳原子沿这三个轴正反方向跳动的机会相等。
因此碳原子在平行[110]晶面之间跳动的几率即几何因子γ=1/6。
在体心立方晶体中,八面体空隙中心在晶胞面心及核边中心,相邻空隙间距为a /2。
其连线为[110]晶向,可以认为碳原子通过在平行的[200]晶面之间来完成扩散,取[100]、[010]、[001]为X 、Y 、Z 轴。
碳原子沿这三个轴正反方向跳动机会均等,因而碳原子在平行的[200]晶面间跳动的几率γ=1/6。
在面心立方铁中2261==r γ代入2D r γ=Γ12)2(6122ΓΓa aD =⨯⨯=面心在体心立方铁中16γ=2r a =24)2(6122ΓΓa a D =⨯⨯=体心7-2 设有一种由等直径的A 、B 原子组成的置换型固溶体。
该固溶体具有简单立方的晶体结构,点阵常数a =,且A 原子在固溶体中分布成直线变化,在0.12mm 距离内原子百分数由增至。
又设A 原子跃迁频率Γ=10-6s -1,试求每秒内通过单位截面的A 原子数解:已知16s 101--⨯=Γ,16γ=;nm 30.==a r ;求扩散通量J 。
s cm 105110)1030(612226372---⨯=⨯⨯⨯==..r D Γγ每cm 3固溶体内所含原子数为322371073)1030(1个⨯=⨯-..2224222421201506337101481000121510148102210s cm ........dc dx J D dc dx ----=⨯⨯=-⨯=-=⨯⨯⨯=⨯7-3 制造晶体管的方法之一是将杂质原子扩散进入半导体材料如硅中。

第七章扩散与固相反应§7-1 晶体中扩散的基本特点与宏观动力学方程一、基本特点1、固体中明显的质点扩散常开始于较高的温度,但实际上又往往低于固体的熔点;2、晶体中质点扩散往往具有各向异性,扩散速率远低于流体中的情况。
二、扩散动力学方程1、稳定扩散和不稳定扩散在晶体A中如果存在一组分B的浓度差,则该组分将沿着浓度减少的方向扩散,晶体A作为扩散介质存在,而组分B则为扩散物质。
如图,图中dx为扩散介质中垂直于扩散方向x的一薄层,在dx两侧,扩散物质的浓度分别为c1和c2,且c1>c2,扩散物质在扩散介质中浓度分布位置是x的函数,扩散物质将在浓度梯度的推动下沿x方向扩散。
的浓度分布不随时间变的扩散过程稳定扩散:若扩散物质在扩散层dx内各处的浓度不随时间而变化,即dc/dt=0。
这种扩散称稳定扩散。
不稳定扩散:扩散物质在扩散层dx内的浓度随时间而变化,即dc/dt≠0。
这种扩散称为不稳定扩散。
2、菲克定律(1)菲克第一定律在扩散体系中,参与扩散质点的浓度因位置而异,且随时间而变化,即浓度是坐标x、y、z和时间t函数,在扩散过程中,单位时间内通过单位横截面积的质点数目(或称扩散流量密度)j之比于扩散质点的浓度梯度△cD:扩散系数;其量纲为L2T-1,单位m2/s。
负号表示粒子从浓度高处向浓度低处扩散,即逆浓度梯度的方向扩散,对于一般非立方对称结构晶体,扩散系数D为二阶张量,上式可写为:对于大部分的玻璃或各向同性的多晶陶瓷材料,可认为扩散系数D将与扩散方向无关而为一标量。
J x=-D J x----沿x方向的扩散流量密度J y=-D J y---沿Y方向的扩散流量密度J z=-D J z---沿Z方向的扩散流量密度适用于:稳定扩散。
菲克第二定律:是在菲克第一定律基础上推导出来的。
如图所示扩散体系中任一体积元dxdydz在dt时间内由x方向流进的净物质增量应为:同理在y、z方向流进的净物质增量分别为:放在δt时间内整个体积元中物质净增量为:若在δt时间内,体积元中质点浓度平均增量δc,则:若假设扩散体系具有各向同性,且扩散系数D不随位置坐标变化则有:适用范围:不稳定扩散。
第七章 扩散与固相反应内容提要:晶体中原子(离子)的扩散是固态传质和反应等过程的基础。
本章讨论了扩散的两个问题。
一是扩散现象的宏观规律——菲克第一、第二定律,描述扩散物质的浓度分布与距离、时间的关系。
二是扩散微观机制,即扩散过程中原子迁移的方式。
在了解原子移动规律的基础上讨论了固相反应的扩散动力学方程。
杨德尔与金斯特林格方程的推导及其适用的范围。
简要介绍了影响固相反应的因素。
固体中质点(原子或离子)的扩散特点:固体质点之间作用力较强,开始扩散温度较高,但低于其熔点;晶体中质点以一定方式堆积,质点迁移必须越过势垒,扩散速率较低,迁移自由程约为晶格常数大小;晶体中质点扩散有各向异性。
菲克第一定律:在扩散过程中,单位时间内通过单位截面的质点数目(或称扩散流量密度)J 正比于扩散质点的浓度梯度c :)(zc k y c j x c i D D ∂∂+∂∂+∂∂-=∇-= 式中D 为扩散系数s m 2或s cm 2;负号表示粒子从浓度高处向浓度低处扩散,即逆浓度梯度的方向扩散。
菲克第一定律是质点扩散定量描述的基本方程,它可直接用于求解扩散质点浓度分布不随时间变化的稳定扩散问题。
菲克第二定律适用于求解扩散质点浓度分布随时间和距离而变化的不稳定扩散问题。
)(222222zc y c x c D t c ∂∂+∂∂+∂∂=∂∂ 扩散过程推动力是化学位梯度。
物质从高化学位流向低化学位是一普遍规律。
扩散系数的一般热力学关系式:)ln ln 1(i i i i N RTB D ∂∂+=γ式中i D 为i 质点本征扩散系数;i B 为i 质点平均速率或称淌度;i γ为i 质点活度系数;i N 为i 质点浓度。
)ln ln 1(i i N ∂∂+γ称为扩散系数的热力学因子。
当体系为理想混合时1=i γ,此时i i i RTB D D ==*。
*i D 为自扩散系数。
当体系为非理想混合时,有两种情况:(1)当0)ln ln 1(>∂∂+i i N γ,0>i D 为正扩散。
固相反应法的扩散原理固相反应法是一种常用于合成无机材料的方法,它基于反应物在固体相中的扩散过程,常被用于合成无机材料、合成陶瓷、高温材料和催化剂等。
在固相反应法中,反应物通过扩散在固体相中发生反应,产生所需的产物。
固相反应法的扩散原理可以从多个角度来解释。
以下将从热力学、扩散动力学和固体反应机理三个方面进行讨论。
首先,从热力学角度来看,固相反应需要满足热力学的平衡条件。
这意味着反应混合物组分的化学势之差在反应过程中趋于零。
在固相反应中,反应物分子通过扩散逐渐相互接触,形成局部的处于平衡状态的小区域。
在这些小区域内,反应物由于浓度梯度和局部的温度梯度,会发生反应并释放出能量。
随着时间的推移,反应会逐渐在整个反应体系中进行,直到达到平衡状态。
因此,固相反应法的扩散原理与热力学平衡密切相关。
其次,从扩散动力学的角度来看,固相反应是通过固体颗粒之间的物质迁移实现的。
扩散作为固体相中的质量传递过程,是指物质在固体内部的非均匀分布的自发性移动。
固体颗粒之间存在浓度梯度,质量从梯度高的区域扩散到梯度低的区域。
在固相反应中,反应物的迁移路径通常是由固体颗粒的晶格结构以及物质扩散的速率决定的。
例如,在固相反应法中,反应物粉末的大小、形状和分布对反应速率和产物的物理性质具有显著影响。
因此,固相反应法的扩散原理与物质分子的迁移和扩散速率有关。
最后,从固体反应机理的角度来看,固相反应法是通过反应物的物质转移和相互作用实现的。
在固相反应中,反应物的化学成分从一个相转移到另一个相,进而形成产物。
通常,反应物的转移路径可以分为三个步骤:扩散、表面反应和体相反应。
首先,反应物通过扩散进入固体颗粒相互接触的位置。
然后,在固体颗粒的表面处发生反应,通常是一些中间生成物的生成和反应。
最后,中间生成物会继续在固体内部进行扩散和反应,直到形成所需的产物。
因此,固相反应法的扩散原理与反应物的物质转移和固体表面反应密切相关。
综上所述,固相反应法的扩散原理涉及热力学平衡、扩散动力学和固体反应机理等方面。
固态化学反应原理及其在材料制备中的应用概述:固态化学反应是指在固态条件下进行的化学反应,是一种非常重要且广泛应用于材料制备的方法。
它以固体物质为反应物或生成物,反应过程中不伴随显著的相变,通过固态反应可以合成出具有特定结构和性质的材料。
本文将对固态化学反应的基本原理以及其在材料制备中的应用进行探讨。
一、固态化学反应原理固态化学反应是指在固态条件下进行的化学反应。
与溶液相反应和气相反应相比,固态反应通常需要高温、高压等特殊条件才能进行。
固态反应过程中,原子、离子或分子之间的相互作用主要通过固体晶格的扭曲和变形来实现。
固态反应中的反应速率通常较慢,这是由于固体晶格的特性决定的。
1.1 原子扩散固态反应中的原子扩散是反应过程中原子在晶格中的迁移和交换。
原子扩散是固相反应中的关键步骤之一,它决定了反应速率和反应性能。
在高温下,固体晶格中的原子具有足够的能量来克服势垒并跨越晶界或晶腔,从而实现原子的扩散。
原子扩散的速率受到温度、晶体结构、晶界和杂质的影响。
1.2 界面反应固态反应中的界面反应是指两个相界面上的原子、离子或分子之间的相互作用。
界面反应主要发生在晶体颗粒的表面、晶腔和晶界等位置。
界面反应的速率常受到扩散速率的限制,因此提高扩散速率可以加速固态反应的进行。
1.3 扭曲和应变固态反应中,原子扩散和界面反应往往伴随着晶格的扭曲和应变。
原子的迁移过程中,晶格会经历各种扭曲和变形,以适应新的构型。
晶格的变形对反应的速率和产物的结构起着重要的影响。
二、固态化学反应在材料制备中的应用固态化学反应在材料制备中具有广泛应用,可以用于合成各种结构和性能的材料。
以下是几个典型的应用领域:2.1 陶瓷制备固态反应在陶瓷材料制备中被广泛应用。
通过选择适当的固态反应方法和条件,可以合成出具有特殊结构和性能的陶瓷材料。
例如,氧化铝的合成可以通过铝粉和氧气的固态反应实现。
固态化学反应在陶瓷材料的掺杂、稳定相的形成等方面也发挥着重要作用。
铁氧体的烧结原理铁氧体是一种重要的磁性材料,具有广泛的应用领域,如电磁设备、电子元器件、电力工业等。
其中,烧结是铁氧体的主要制造工艺之一。
烧结是指将形状成型的粉末材料,在一定的温度和压力条件下加热处理,使其颗粒之间发生结合,形成致密的块状材料的过程。
铁氧体的烧结原理是通过粉末颗粒之间的扩散与固相反应使颗粒之间结合。
在烧结过程中,粉末颗粒之间的扩散是烧结结合的基础。
一般来说,烧结粉末颗粒表面产生活性溶胶,溶胶中的矿物质成分通过扩散逐渐从所制成的颗粒表面向内部扩散,形成晶体晶界。
当接触到其他表面的颗粒时,这些晶界之间的矿物质再次扩散,并与其他颗粒表面上的矿物质形成新的连接。
这种扩散和结合过程在整个烧结过程中不断进行,最终形成一个致密的块状材料。
在烧结过程中,粉末颗粒之间的结合还涉及到固相反应的过程。
固相反应是指当矿物质在烧结过程中达到一定温度时,发生化学反应,产生新的矿物质。
这些新的矿物质能够填充粉末颗粒之间的空隙,增强颗粒之间的结合,提高材料的致密度。
常见的固相反应有矿物质的相互转化、矿物质和添加剂的反应等。
烧结过程中的温度和压力是影响烧结效果的重要因素。
温度是促使颗粒扩散和固相反应发生的主要驱动力。
适当的温度能够提高颗粒之间的扩散速率,促进烧结过程的进行。
然而,过高的温度可能导致颗粒表面烧结过度,损坏颗粒原有的形态和特性。
压力则能够改善颗粒颗粒之间的接触性和结合力,降低颗粒扩散的活化能,促进颗粒之间的结合。
适当的压力能够提高材料的致密度,改善烧结效果。
此外,烧结过程中还存在一些其他因素对烧结效果的影响。
例如,材料粉末的粒径和分布对烧结效果具有重要影响。
通常,较小的粒径有利于提高烧结效果,因为较小的颗粒扩散速率更快。
另外,添加剂的选择和添加量也对烧结效果起到重要作用。
添加剂可调节烧结过程中的反应速率和固相反应产物的形成,进而影响材料的致密性和磁性能。
总的来说,铁氧体的烧结原理是通过粉末颗粒间扩散和固相反应来实现颗粒结合的过程。
第七章 扩散与固相反应1、名词解释:非稳定扩散:扩散过程中任一点浓度随时间变化;稳定扩散:扩散质点浓度分布不随时间变化。
无序扩散:无化学位梯度、浓度梯度、无外场推动力,由热起伏引起的扩散。
质点的扩散是无序的、随机的。
本征扩散:主要出现了肖特基和弗兰克尔点缺陷,由此点缺陷引起的扩散为本征扩散(空位来源于晶体结构中本征热缺陷而引起的质点迁移);非本征扩散:空位来源于掺杂而引起的质点迁移。
正扩散和逆扩散:正扩散:当热力学因子时,物质由高浓度处流向低浓度处,扩散结果使溶质趋于均匀化,D i >0。
逆扩散:当热力学因子 时,物质由低浓度处流向高浓度处,扩散结果使溶质偏聚或分相,D i <0。
2、简述固体内粒子的迁移方式有几种?答 易位,环转位,空位扩散,间隙扩散,推填式。
3、说明影响扩散的因素?化学键:共价键方向性限制不利间隙扩散,空位扩散为主。
金属键离子键以空位扩散为主,间隙离子较小时以间隙扩散为主。
缺陷:缺陷部位会成为质点扩散的快速通道,有利扩散。
温度:D=D 0exp (-Q/RT )Q 不变,温度升高扩散系数增大有利扩散。
Q 越大温度变化对扩散系数越敏感。
杂质:杂质与介质形成化合物降低扩散速度;杂质与空位缔合有利扩散;杂质含量大本征扩散和非本征扩散的温度转折点升高。
扩散物质的性质:扩散质点和介质的性质差异大利于扩散;扩散介质的结构:结构紧密不利扩散。
4、在KCl 晶体中掺入10-5mo1%CaCl 2,低温时KCl 中的K +离子扩散以非本征扩散为主,试回答在多高温度以上,K +离子扩散以热缺陷控制的本征扩散为主?(KCl 的肖特基缺陷形成能ΔH s =251kJ/mol ,R=8.314J/mo1·K ) 解:在KCl 晶体中掺入10-5mo1%CaCl 2,缺陷方程为:2'22KCl K K cl CaCl Ca V Cl ∙⨯−−−→++则掺杂引起的空位浓度为'710K V -⎡⎤=⎣⎦欲使扩散以热缺陷为主,则''K K V V ⎡⎤⎡⎤>⎣⎦⎣⎦肖 即7exp()102s H RT-∆-> 即7251000exp()1028.314T -->⨯ 解得T>936.5K5、(1)试述晶体中质点的扩散机构及方式。
扩散与固相反应7-1试分析碳原子在面心立方和体心立方铁八面体空隙间跳跃情况,并以D = Y 2r 形式写出其扩散系数(设点阵常数为a )。
(式中r 为跃迁自由程;丫为几何因子;r 为跃迁频率。
)7-2设有一种由等直径的 A 、B 原子组成的置换型固溶体。
该固溶体具有简单立方的晶 体结构,点阵常数 A = 0.3nm ,且A 原子在固溶体中分布成直线变化,在0.12mm 距离内原子百分数由0.15增至0.63。
又设A 原子跃迁频率 r= 10-6s 1,试求每秒内通过单位截面的 A原子数?7-3制造晶体管的方法之一是将杂质原子扩散进入半导体材料如硅中。
假如硅片厚度是0.1cm ,在其中每107个硅原子中含有一个磷原子,而在表面上是涂有每107个硅原子中有400个磷原子,计算浓度梯度(a )每cm 上原子百分数,(b )每cm 上单位体积的原子百分 数。
硅晶格常数为 0.5431 nm 。
7-4已知MgO 多晶材料中Mg 2+离子本征扩散系数(DQ 和非本征扩散系数(D ex )由 下式给出486000 2D in = 0.249exp ( ) cm ; sRT 5254500、 2 ■■D ex =1.2 10 exp ( ) cm . sRT(a ) 分别求出 25C 和 1000C 时,Mg 2+的(D in )和(D ex )。
(b ) 试求在Mg 2+的InD 〜1/T 图中,由非本征扩散转变为本征扩散的转折点温度?7-5从7-4题所给出的D in 和D ex 式中求MgO 晶体的肖特基缺陷形成焓。
若欲使 Mg 2+在MgO 中的扩散直至 MgO 熔点2800 C 时仍是非本征扩散,试求三价杂质离子应有什么样 的浓度?7-6若认为晶界的扩散通道宽度一般为 0.5nm ,试证明原子通过晶界扩散和晶格扩散的扩散系数。
Q gb = _ Q v7-7设体积扩散与晶界扩散活化能间关系为2(Qg b 、Q v 分别为晶界扩散与体积扩散激活能),试画出lnD 〜1/T 曲线,并分析在哪个温度范围内,晶界扩散超过体积扩散 ?7-8在一种柯肯达尔扩散中,假定(a )晶体为简单立方结构;(b )单位体积内原子数 为一常数1023; (c ) A 原子的跃迁频率为1010s -1, B 原子跃迁频率为109s -1; (d )点阵常数 a = 0.25nm ;(e )浓度梯度为10个/cm ; (f )截面面积为0.25cm 。
试求A 、B 原子通过标志 界面的扩散通量以及标志界面移动速度。
7-9纯固相反应在热力学上有何特点?为什么固相反应有气体或液体参加时,范特荷夫规则就不适用了?7-10假定从氧化铝和二氧化硅粉料形成莫来石为扩散控制过程,如何证明这一点?又 假如激活能为210kJ/mol ,并在1400 C 下1h (小时)内反应过程完成10%,问在1500 C 下质量之比为 10-9(〒)自。
其中d 为晶粒平均直径; D gb 、D v 分别为晶界扩散系数和晶格387000 D*+ 二 0.035exp()RT D Cr 2+ =0・444exp^420?00) Rl 131000、cm 2; scm 2 scm 2, s1h 内反应会进行到什么程度?在 1500C 下4h 又会如何?7-11在SiC 上形成一层非晶态 SiO 2薄膜,限制了进一步氧化。
完成氧化的分数是用测定增重的方法确定的,并发现是遵守抛物线氧化规律。
对特定颗粒尺寸的 SiC 和纯氧。
2,得到如下表所示实验数据,试确定表现激活能并说明这是一个扩散控制的反应。
7-12为观察尖晶石的形成,用过量的 MgO 粉包围1 ym 的Al 2O 3球形颗粒,在固定温度实验中的第1h 内有20%的Al 2O 3反应形成尖晶石。
试根据(a )无需球形几何修正时,(b ) 用Jander 方程作球形几何修正,计算完全反应的时间?7-13名词解释(a )自扩散和互扩散(b ) 本征扩散和非本征扩散(c ) 稳定扩散和非稳定扩散(d ) 几何因子(e ) 加成反应7-14图7-2中圆圈代表铝原子,带星号的圆圈代表它的冋位素原子。
(a )表示原子的原 始分布状态, (b )表示经过第一轮跳动后原子的分布情况。
试画出第二轮跳动后原子的可能 分布情况和示意画出三个阶段同位素原子的浓度分布曲线( c 浓度〜x 距离图)。
7-2题7-14附图7-15已知a -Cr 2O 3多晶材料中Cr 3+和O 2-的自扩散系数为256000 2:D Cr 3+ =0.137exp(- -------- ) cm /sRT423000、 2 .■D 2- =15.9exp( ) cm s O RT试求1000C 和1500C 时,Cr 3+和O 2+的自扩散系数为多少?( 1000C D Cr 3+—2 22 -—73+_Q2—24.29 X10 cm /s D O6.98 X101500 C D cr3.0 X10D O " 5.48 X10 )7-16在掺杂少量CaO 的ZrO 2多晶材料中,已知 Zr 4十、Ca 2+和O 2-自扩散系数为:000 00 00 o ooo oa 00000900000c? ooo#o®QO_*oo»6 u o ® oc ® Q o ® 00 ® 4 u 0®00®0»COO®03 ooaooooooooox 00 0000 co 00 ooioooooooocoooa o®oooooo ®oo O 丁oo® oooftooo® 06 00 000®oo«oo®s > o®oooo o® 00® 0 4<l •00 00000® 00 ® 3 c o o ®00 0000 2 o o coo cooo 000 i试求1200C 时三种离子的自扩散系数,计算结果说明什么 ?( D zr 4+ = 6.61X10-cm 2/sD CA 2+= 5.66X10-6D O 24.07 X10「7)7-17碳原子体心立方铁中的扩散系数为D = 2.0X 10-6exp (- 84X 105/RT ),求当振动频率为 I013s -1,迁移自由程 r =0.143nm 时的(△ SR )。
(2.686)7-18氢在金属中容易扩散, 当温度较高和压强较大时,用金属容器储存氢气极易渗漏。
试讨论稳定扩散状态下金属容器中氢通过器壁扩散渗漏的情况并提出减少氢扩散逸失的措 施?7-19 (a )已知银的自扩散系数D V = 7.2 X 10-5m 2/s , Q v = 190X 103j/mol ;晶界扩散系数D gb = 1.4X 10-5m 2/s , Q gb = 90 X 103J/mol 。
试求银在 927C 及 727C 时 D gb 和 D V 的比值。
(b )若实验误差为5%,试用例题7-6的结果,说明当晶体平均直径d = 10-4m 时,在927 C 和727C 下能否察觉到纯银的晶界扩散效应?34((a) ( D gb /D v ) 927 = 4.25X10 ( D gb /D V ) 727= 3.10X10( b) ( M gb /M v ) 927= 0.0425(M gt /M V ) 727 = 0.310)7-20试从D — T 图中查出(a ) CaO 在1145C 和1393 C 时的扩散系数。
(3AI 2O 3在1396 C 和1716C 时的扩散系数。
并计算CaO 和Al 2O 3中Ca 2+和Al 3+的扩散激活能Q 和系数D °? (( a )-3-12- 2 / 、 -1 -22.03 X0 1.92 X0 252kJ/mol4.06 X0 cm /s ( b ) 2.42 X0 7.02 X052597kJ/mol 1.12 X0 cm /s )7-21 Fe 2+离子在氧化铁(FeO )中的扩散系数,在 600 C 时为5 X 1010cm 2/s ,在900 C 时 是 1.5X 10-8cm 2/s ,求活化能 Q 和 Fe 在 FeO 中的扩散常数 D 。
(Q = 96.54 kJ/mol D ° = 3.0 X0 "cm/s)7-22 一个0.05cm 厚的硅晶体,在一个表面上每107个Si 原子中含有2个镓(Ga )原子,而在其它表面上处理成镓的高浓度面, 如果要产生一个-2 X 1018Ga 原子/cm 4的浓度梯度, 在这个表面上必须在 107个Si 原子中有多少个镓原子?(硅的晶格常数是0.5407nm )。
183(0.11X10 Ga 原子数 /cm •m )7-23硅表面沉积了一层硼薄膜持,经短时间扩散后硼的浓度分布情况如图7-3所示。
试考虑若硅表面硼浓度达到饱和并恒定不变时即C s = 3 X 1026cm -3,试求于1200 C 下扩散深度8^m 处硼浓度为1024m -3时所需扩散时间为多少?已知 1200C 时B (硼)的扩散系数为 4 X 10-13m 2/s 。
(分别用计算法和图解法求之) (25.68h )图7-3题7-23附图7-24在两根金晶体圆棒的端点涂上示踪原子Au #,并把两棒端部如图7-4 (a )所示方0 心 2 " 46 (J. ir E弋中苦"童丟式连接。
在920 C 加热100h , Au #示踪原子扩散分布如图(B )所示,并满足下列关系:图7-4在920C 加热100h 后Au*的扩散分布曲线7-25在一定温度下,若扩散退火时间增加一倍,那么扩散物质的平均渗透深度将增加几倍?(、2 )7-26试讨论从室温于熔融温度范围内,氧化锌添加剂10-4% (摩尔)对NaCI 单晶中所有离子(Zn 、Na 、Cl )的扩散能力的影响?7-27利用电导与温度依赖关系求得扩散系数和用示踪原子等方法直接测得的值常常不一致,试分析原因?7-28根据ZnS 烧结的数据测定了扩散系数。
在563C 时,测得扩散系数为3X 10-4cm 2/s ;在450C 时则为1.0 X 10-4cm 2/s , (1)试确定活化能 Q 和系数D 。
; ( 2)根据ZnS 结构,请从缺陷产生和运动的观点来推断活化能的含义;(3)根据六方ZnS 和ZnO 相互类似,预测 D1 6随硫分压改变而改变的关系?( 0.339cm 2/s 48.86kJ/mol D 尤艮)7-29钠钙硅酸盐玻璃中阳离子的扩散系数如图7-5所示,试问:(1) 为什么Na +比Ca 2+和Si 4+扩散得快?(2) Na +扩散曲线的非线性部分产生的原因是什么? (3) 将玻璃淬火,其曲线将如何变化? (4) Na +熔体中扩散活化能约为多少?式中C 是浓度; 2(二 Dt)22eXFM 为实验中示踪原子总量。