海水提镁方程式
- 格式:doc
- 大小:10.83 KB
- 文档页数:2






第4课时 镁的提取及应用[学习目标定位] 1.了解从海水中提取镁的原理和过程。
2.掌握镁及其化合物的性质和用途。
一、从海水中提取镁 1.工艺流程2.相关反应的方程式 (1)分解贝壳制取氢氧化钙: ①CaCO 3=====高温CaO +CO 2↑; ②CaO+H 2O===Ca(OH)2。
(2)沉淀镁离子: Mg 2++2OH -===Mg(OH)2↓。
(3)制备氯化镁:Mg(OH)2+2HCl===MgCl 2+2H 2O 。
(4)制取金属镁:MgCl 2(熔融)=====通电Mg +Cl 2↑。
由MgCl 2·6H 2O 加热制取无水MgCl 2时,要不断通入干燥的HCl 气体,防止MgCl 2水解生成Mg (OH )2。
例1 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。
某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na +、Mg 2+、Cl -、Br -等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH 溶液的原因是_________________。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有__________溶液的烧杯中,充分搅拌后经________、________(填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:其中装置A 的作用是____________________________________________________________。
(4)写出过程④中发生反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。

第10课时海水提镁从海水中提取重水学案【学习目标】1.掌握海水提镁的原理与工艺流程。
2.了解从海水中提取重水的工艺流程。
【重点难点】1.海水提镁的原理与工艺流程2.海水中提取重水的工艺流程课前预习【情景材料】我国的镁矿储量世界第一,是世界上最大的镁生产和出口国,2003年,原镁产量占全球的63%。
目前主要是通过煅烧陆地天然菱镁矿来制取镁,用这种方法制得的氧化镁,纯度不高,还要消耗大量的能源,并且对环境污染很大。
海水提镁自本世纪40年代开创以来,发展极快,目前世界上生产的镁已有60%取自海水中,英国、美国、日本在这方面走在前列。
因为这种方法不仅可以得到高纯度的镁,而且能耗低、没有污染。
我国近几年也开始了研究工作,相信在不久的将来即可实现海水提镁的工业化生产。
海水中的镁主要是氯化镁,浓度很小,那么人们如何利用自然资源从海水中把氯化镁提取出来,又怎样将氯化镁中的镁还原出来呢?【预习内容】根据教材有关内容填写下列空白:一、海水提镁1.原理电解熔融的MgCl2就可以得到金属镁和氯气。
2.提取过程3.主要化学反应或离子反应①制备石灰乳:、。
②沉淀Mg2+:③制备MgCl2:④电解MgCl2:二、从海水中提取重水提取重水的方法有法、法、法和法,其中常用的一种是,交换按下列反应进行:,重水D2O可作原子反应堆的中子减速剂和传热介质(重水堆)。
预习内容答案一、石灰乳Mg(OH)2盐酸MgCl2Mg+Cl2CaCO3CaO+CO2↑ CaO+H2O=Ca(OH)2Mg2++Ca(OH)2===Mg(OH)2↓+Ca2+Mg(OH)2+2HCl==MgCl2+2H2O MgCl2(熔融)Mg+Cl2↑二、蒸馏电解化学交换吸附硫化氢—水双温交换法H2O(l)+HDS(g)==HDO(l)+H2S(g)堂中互动【问题探究1】海水提镁的工艺流程和有关反应原理怎样?【教师点拨】海水资源提取金属镁的生产步骤:加熟石灰→过滤→加盐酸→浓缩、结晶、脱水、干燥→熔融电解。
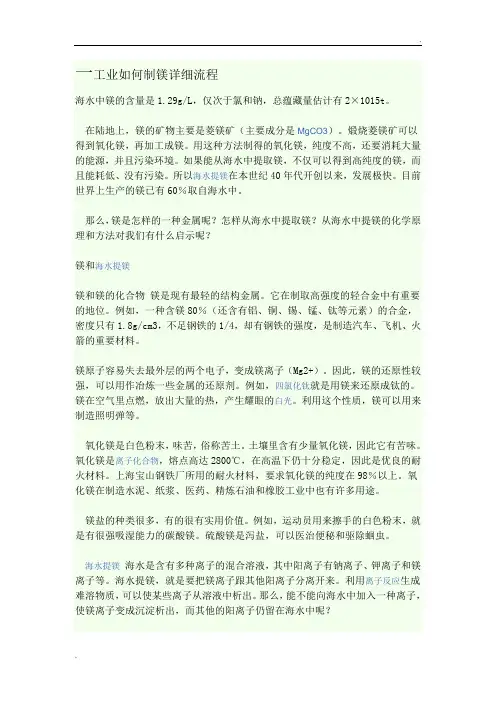
一工业如何制镁详细流程海水中镁的含量是1.29g/L,仅次于氯和钠,总蕴藏量估计有2×1015t。
在陆地上,镁的矿物主要是菱镁矿(主要成分是MgCO3)。
煅烧菱镁矿可以得到氧化镁,再加工成镁。
用这种方法制得的氧化镁,纯度不高,还要消耗大量的能源,并且污染环境。
如果能从海水中提取镁,不仅可以得到高纯度的镁,而且能耗低、没有污染。
所以海水提镁在本世纪40年代开创以来,发展极快。
目前世界上生产的镁已有60%取自海水中。
那么,镁是怎样的一种金属呢?怎样从海水中提取镁?从海水中提镁的化学原理和方法对我们有什么启示呢?镁和海水提镁镁和镁的化合物镁是现有最轻的结构金属。
它在制取高强度的轻合金中有重要的地位。
例如,一种含镁80%(还含有铝、铜、锡、锰、钛等元素)的合金,密度只有1.8g/cm3,不足钢铁的1/4,却有钢铁的强度,是制造汽车、飞机、火箭的重要材料。
镁原子容易失去最外层的两个电子,变成镁离子(Mg2+)。
因此,镁的还原性较强,可以用作冶炼一些金属的还原剂。
例如,四氯化钛就是用镁来还原成钛的。
镁在空气里点燃,放出大量的热,产生耀眼的白光。
利用这个性质,镁可以用来制造照明弹等。
氧化镁是白色粉末,味苦,俗称苦土。
土壤里含有少量氧化镁,因此它有苦味。
氧化镁是离子化合物,熔点高达2800℃,在高温下仍十分稳定,因此是优良的耐火材料。
上海宝山钢铁厂所用的耐火材料,要求氧化镁的纯度在98%以上。
氧化镁在制造水泥、纸浆、医药、精炼石油和橡胶工业中也有许多用途。
镁盐的种类很多,有的很有实用价值。
例如,运动员用来擦手的白色粉末,就是有很强吸湿能力的碳酸镁。
硫酸镁是泻盐,可以医治便秘和驱除蛔虫。
海水提镁海水是含有多种离子的混合溶液,其中阳离子有钠离子、钾离子和镁离子等。
海水提镁,就是要把镁离子跟其他阳离子分离开来。
利用离子反应生成难溶物质,可以使某些离子从溶液中析出。
那么,能不能向海水中加入一种离子,使镁离子变成沉淀析出,而其他的阳离子仍留在海水中呢?【实验3-1】氯化镁、氯化钠跟碱溶液的反应在两支试管里分别加入3mL氯化镁溶液和氯化钠溶液。

第4课时 镁的提取及应用目标与素养:1.了解从海水中提取镁的原理和过程。
(宏观辨识与微观探析)2.掌握镁及其化合物的性质和用途。
(宏观辨识与微观探析)一、海水中提取镁1.镁的存在自然界中的镁主要以化合态的形式存在于地壳和海水中。
2.从海水中提取镁(1)从海水中提取金属镁,其简单流程如下:海水中的Mg 2+Mg(OH)2MgCl 2Mg――→① ――→② ――→③ 试写出各步骤发生反应的化学方程式:①MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2;②Mg(OH)2+2HCl===MgCl 2+2H 2O ;③MgCl 2(熔融)Mg +Cl 2↑。
=====通电 (2)石灰乳的制备贝壳(CaCO 3)生石灰(CaO)熟石灰[Ca(OH)2]。
――→煅烧 ①――→H2O ②试写出两步反应的化学方程式:①CaCO 3CaO +CO 2↑;=====煅烧 ②CaO +H 2O===Ca(OH)2。
二、镁的结构与性质1.镁的原子结构镁的原子结构示意图为,原子最外层有2个电子,在化学反应中容易失去最外层电子,形成镁离子。
2.镁的物理性质银白色金属,密度较小,熔点较低,硬度较小,易传热、导电。
3.镁的化学性质镁是一种较活泼的金属,具有较强的还原性。
可以与非金属单质、水、酸、盐以及某些氧化物反应。
(1)与O 2反应反应方程式:2Mg +O 22MgO 。
=====点燃 现象:剧烈燃烧,发出耀眼的白光,生成白色固体。
(2)与N 2反应反应方程式:3Mg +N 2Mg 3N 2。
=====点燃 (3)与CO 2反应反应方程式:2Mg +CO 22MgO +C 。
=====点燃 现象:剧烈燃烧,发出耀眼的白光,生成白色物质并附有黑色固体。
(4)与稀硫酸反应离子方程式为Mg +2H +===Mg 2++H 2↑。
4.镁的重要应用镁是一种重要的金属材料,密度较小,能与Cu 、Al 、Sn 、Mn 、Ti 等形成多种合金,这些镁合金硬度和强度都较大。

高中化学《镁的提取及应用》学案苏教版必修1教学目标1、知识目标(1)了解海水的成分;初步认识海水提取镁的原理与过程。
(2)初步掌握镁的化学性质,物理性质。
教学重点、难点海水提取镁的原理与过程;镁的化学性质。
自学导航:1、自然界的镁主要以的形式存在于和海水中,海水中镁的总储量约为。
2、写出下列反应的化学方程式:MgCl2+NaOH ==Mg(OH)2+H2SO4===Mg(OH)2△学习过程一、从海水中提取镁的过程及原理:海水提镁的步骤:相关的化学反应方程式为:①②③④⑤【思考】海水中提取镁的过程中,海水沉淀池中得到氢氧化镁沉淀时为什么加入的是石灰乳而不是NaOH溶液?电解得到金属镁为什么不采用电解熔融的氧化镁?电解产生的Cl2怎么处理?二、镁的性质1、物理性质:镁是色的金属固体,是热和电的良导体,质地。
硬度较,熔点较低,镁的密度较_____,镁能与铜、铝、锡、锰、钛等形成许多合金,但是硬度和强度都很____,因此镁合金被大量用于制造、和的部件,氧化镁的熔点可以达到2800℃,是很好的______材料2、镁的化学性质1)、[演示实验]探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐酸的试管中;现象:结论或化学方程式:2)、[演示实验]的集气瓶中。
探究二:取一根除去氧化膜的镁条,点燃后插入充满CO2现象:结论或化学方程式::3)、镁条在氮气中燃烧反应的化学方程式::三镁的用途1、制合金2、信号弹、焰火3、制耐火材料(MgO)熔点高当堂演练1 写出下面的反应方程式(1)与非金属的反应与氧气反应、与氯气反应 、与氮气反应(2)与水反应:(3)与二氧化碳反应:______________________________________(4)与酸反应(盐酸、硫酸等)_______________________________________、_____________________________2 根据本节课所学知识,结合下图转化关系完成方程式,并说明镁的重要用途。

第10课时海水提镁从海水中提取重水学案【学习目标】1.掌握海水提镁的原理与工艺流程。
2.了解从海水中提取重水的工艺流程。
【重点难点】1.海水提镁的原理与工艺流程2.海水中提取重水的工艺流程课前预习【情景材料】我国的镁矿储量世界第一,是世界上最大的镁生产和出口国,2003年,原镁产量占全球的63%。
目前主要是通过煅烧陆地天然菱镁矿来制取镁,用这种方法制得的氧化镁,纯度不高,还要消耗大量的能源,并且对环境污染很大。
海水提镁自本世纪40年代开创以来,发展极快,目前世界上生产的镁已有60%取自海水中,英国、美国、日本在这方面走在前列。
因为这种方法不仅可以得到高纯度的镁,而且能耗低、没有污染。
我国近几年也开始了研究工作,相信在不久的将来即可实现海水提镁的工业化生产。
海水中的镁主要是氯化镁,浓度很小,那么人们如何利用自然资源从海水中把氯化镁提取出来,又怎样将氯化镁中的镁还原出来呢?【预习内容】根据教材有关内容填写下列空白:一、海水提镁1.原理电解熔融的MgCl2就可以得到金属镁和氯气。
2.提取过程3.主要化学反应或离子反应①制备石灰乳:、。
②沉淀Mg2+:③制备MgCl2:④电解MgCl2:二、从海水中提取重水提取重水的方法有法、法、法和法,其中常用的一种是,交换按下列反应进行:,重水D2O可作原子反应堆的中子减速剂和传热介质(重水堆)。
预习内容答案一、石灰乳Mg(OH)2盐酸MgCl2Mg+Cl2CaCO3CaO+CO2↑ CaO+H2O=Ca(OH)2Mg2++Ca(OH)2===Mg(OH)2↓+Ca2+Mg(OH)2+2HCl==MgCl2+2H2O MgCl2(熔融) Mg+Cl2↑二、蒸馏电解化学交换吸附硫化氢—水双温交换法H2O(l)+HDS(g)==HDO(l)+H2S(g)堂中互动【问题探究1】海水提镁的工艺流程和有关反应原理怎样?【教师点拨】海水资源提取金属镁的生产步骤:加熟石灰→过滤→加盐酸→浓缩、结晶、脱水、干燥→熔融电解。
海水提取镁的操作流程化学方程式1.首先,我们需要收集海水作为镁的原料。
First, we need to collect seawater as the source of magnesium.2.然后,对海水进行过滤和沉淀操作,以去除杂质。
Next, the seawater is filtered and precipitated to remove impurities.3.海水经过过滤后,我们需要蒸发海水以浓缩镁的含量。
After filtration, the seawater needs to be evaporated to concentrate the magnesium content.4.在蒸发过程中,镁会在溶液中沉淀出来。
During the evaporation process, magnesium willprecipitate out of the solution.5.接下来,将沉淀的镁进行过滤和洗涤。
The precipitated magnesium is then filtered and washed.6.随后,通过加热和其他化学处理,可以将镁从沉淀物中提取出来。
Subsequently, magnesium can be extracted from the precipitate through heating and other chemical treatments.7.最后,得到的镁可以通过干燥和净化来得到最终产品。
Finally, the obtained magnesium can be further purified through drying and purification processes.8.海水中镁提取的过程需要严格控制温度和化学物质的使用。
The process of extracting magnesium from seawater requires strict control of temperature and the use of chemicals.9.提取镁的过程需要耗费大量的能源和资源。
第八单元海水中的化学第一节海洋化学资源一、海水中的物质1.海水中的元素由多到少的顺序:O、H、Cl、Na、Mg2.海水中的物质由多到少的顺序:H2O、NaCl、MgCl23.从海水中提炼金属镁:发生的化学反应:①MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2(从海水中分离出镁元素)②Mg(OH)2 + 2HCl = MgCl2 + 2H2O(转化成可电解的氯化镁)③MgCl2 通电Mg + Cl2↑二、海底矿物1.常规化石燃料:煤、石油、天然气2.新型矿产资源:天然气水合物——可燃冰(主要成分为甲烷):产生的能量多,污染少。
3.金属矿物:多金属结核——锰结核三、海水淡化1.常用方法:蒸馏是通过加热蒸发而将液体从溶液中提取出来的一种方法。
2.其他海水淡化的方法:“多级闪急蒸馏法”“结晶法”“膜法”第二节海水“晒盐”一、海水晒盐的过程盐田法(也称“太阳能蒸发法”):二、饱和溶液1.定义:在一定温度下,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
注意:⑴饱和溶液只是针对某一种溶质来说的,对于其他溶质可能是不饱和溶液。
如饱和食盐水,对食盐来说是饱和溶液,而该溶液还可以继续溶解蔗糖。
(2)描述饱和溶液时,必须指明温度。
如“100g,20℃时氯化钠饱和溶液”,而不能说“100g氯化钠饱和溶液”。
2.判断:①根据食盐溶液中是否有未溶解固体来判断,如果有未溶解的食盐固体存在,则溶液达到饱和状态;②向溶液中加入少量溶质,如果溶液不能继续溶解溶质,则溶液达到饱和状态。
3.饱和溶液与不饱和溶液的转化三、固体物质溶解度的定义、影响因素以及相关的计算1.溶解度:在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量。
注意:1)概念中的四要素:①一定温度;②100克溶剂;③饱和状态;④质量;⑤单位:克2)溶解度的含义。
20℃时,氯化铵的溶解度为37.2克,表示在20℃时,100g水中溶解37.2g 氯化铵达到饱和。
海水制镁五个化学方程式全文共四篇示例,供读者参考第一篇示例:海水中的镁是一种十分重要的元素,它不仅在海水中存在丰富,还在人类的生活中发挥着重要的作用。
制备海水中的镁元素可以通过化学方法来实现,下面我们就来看看海水制镁的五个化学方程式。
1. 氢氧化镁和氯化钠生成氯化镁和氢氧化钠这是一种常见的制备氯化镁的方法。
当氢氧化镁和氯化钠反应时,会生成氯化镁和氢氧化钠两种化合物。
化学方程式如下:Mg(OH)2 + 2NaCl → MgCl2 + 2NaOH这个方程式表示了氢氧化镁和氯化钠在一定条件下发生反应,生成氯化镁和氢氧化钠。
通过这种反应可以得到氯化镁,从而实现对海水中镁元素的提取。
除了氯化镁的制备方法外,还可以通过碳酸镁和氢氯酸的反应来制备氯化镁。
在反应条件下,碳酸镁和氢氯酸会生成氯化镁、二氧化碳和水。
化学方程式如下:海水中的镁元素可以通过多种化学方法来提取,其中包括通过氢氧化镁、碳酸镁、氯化镁等物质的反应来实现。
这些化学方程式展示了海水制镁的几种常见方法,对于研究镁元素的提取和应用具有重要的参考价值。
希望通过这些方程式的介绍,可以更深入地了解海水中镁元素的制备过程。
【结束】。
第二篇示例:海水是地球上最丰富的资源之一,其中含有大量的镁元素。
在提取海水中的镁元素时,通常会采用化学方法进行处理。
下面将介绍五个关于海水制镁的化学方程式。
1. 镁在海水中的存在形式海水中含有丰富的镁元素,一般以镁离子(Mg2+)的形式存在。
镁离子在水中是稳定的,但要提取镁元素需要将镁离子与其他物质结合形成沉淀物。
2. 镁离子与碳酸钠的反应将海水中的镁离子与碳酸钠(Na2CO3)反应,生成碳酸镁(MgCO3)沉淀。
化学方程式如下:Mg2+ + Na2CO3 → MgCO3↓ + 2Na+碳酸镁是一种不溶于水的白色沉淀物,可以通过过滤等方法分离出来。
3. 碳酸镁的热分解接下来,将碳酸镁进行热分解处理,得到氧化镁(MgO)和二氧化碳(CO2)。
海水提镁方程式
海水中的镁主要以镁离子(Mg2+)的形式存在。
海水提镁是一种利用化学反应将海水中的镁离子提取出来的方法。
这个过程可以通过以下方程式来表示:
Mg2+ + 2OH- → Mg(OH)2
在这个方程式中,两个氢氧根离子(OH-)与一个镁离子(Mg2+)反
应生成了镁氢氧化物(Mg(OH)2)。
海水提镁的过程通常是通过使用化学试剂来实现的。
一种常用的试剂是氢氧化钠(NaOH),它可以提供氢氧根离子(OH-)。
当氢氧化钠溶
液与海水混合时,其中的氢氧根离子会与镁离子反应生成镁氢氧化物沉淀。
这个沉淀可以通过过滤或离心的方式从溶液中分离出来。
随后,镁氢氧化物可以经过烘干或加热的处理,使其转化为镁氧化物(MgO)。
最终,镁氧化物可以被用于制备镁合金或其他镁相关的产品。
海水提镁是一种可持续的方法,因为海水是地球上最丰富的资源之一。
而且,这种方法可以有效地提取海水中的镁离子,同时不会对环境造成严重的污染。
然而,海水提镁过程中也需要注意对副产物的处理,
以确保其不对周围环境造成负面影响。
总之,海水提镁方程式描述了海水中镁离子的提取过程。
这种方法可以通过化学反应将镁离子与氢氧根离子结合形成镁氢氧化物,然后通过一系列步骤转化为镁氧化物。
海水提镁是一种可持续的方法,可以用于制备镁合金等产品。
同时,对副产物的处理也是该过程中需要关注的问题。