1物理化学2013——2015[1]
- 格式:pdf
- 大小:630.88 KB
- 文档页数:14


物理化学实验试卷1一、选择题( 共29题50分)1. 1 分(8401)在燃烧热实验中,需用作图法求取反应前后真实的温度改变值△T,主要是因为:( )(A) 温度变化太快,无法准确读取(B) 校正体系和环境热交换的影响(C) 消除由于略去有酸形成放出的热而引入的误差(D) 氧弹计绝热,必须校正所测温度值2. 2 分(8408)在氧弹实验中, 若要测定样品在293 K时的燃烧热, 则在实验时应该:()(A) 将环境温度调至293K (B) 将内筒中3000 cm3水调至293 K(C) 将外套中水温调至293 K (D) 无法测定指定温度下的燃烧热。
3. 2 分(8409)在氧弹实验中, 若测得∆c H m=-5140.7 kJ·mol-1, ∆│∆H│最大=25.47 kJ·mol-1, 则实验结果的正确表示应为: ( )(A) ∆c H m= -5140.7 kJ·mol-1(B) ∆c H m= -5140.7±25.47 kJ·mol-1(C) ∆c H m= -(5.1407±0.02547)×103 kJ·mol-1(D) ∆c H m= -5140.7±25.5 kJ·mol-14. 2 分(8414)为测定物质在600~100℃间的高温热容, 首先要精确测量物系的温度。
此时测温元件宜选用:( )(A) 贝克曼温度计(B) 精密水银温度计(C) 铂-铑热电偶(D) 热敏电阻5. 2 分(8415)在测定中和热的实验中, 试样为10 ml, 中和作用的热效应引起试样的温度改变不到1℃, 根据这样的实验对象, 宜选择的测温元件是:( )(A) 贝克曼温度计(B) 0.1℃间隔的精密温度计(C) 铂-铑热电偶(D) 热敏电阻6. 2 分(8416)测温滴定实验中, 当用NaOH来滴定H3BO3时, 随着NaOH加入记录仪就记录整个过程的温度变化。

物理化学总复习1物理化学是一门研究物质的性质、结构和变化规律的学科,它融合了物理学和化学的原理和方法,对于理解化学反应、物质的状态和性质等方面具有重要意义。
以下是对物理化学的一些重要知识点的总复习。
一、热力学第一定律热力学第一定律,也称为能量守恒定律,其核心表述为:能量可以在不同形式之间转换,但总能量保持不变。
这一定律在物理化学中有着广泛的应用。
比如,在一个封闭系统中,如果有热量 Q 传递给系统,同时系统对外做功 W,那么系统的内能变化ΔU 就等于 Q W 。
这个公式清晰地展示了能量的转化关系。
理解热力学第一定律,对于分析各种热力学过程至关重要。
例如,在一个绝热过程中,Q = 0 ,那么系统内能的变化就完全取决于系统对外做功或者外界对系统做功。
二、热力学第二定律热力学第二定律揭示了自发过程的方向性。
常见的表述有克劳修斯表述和开尔文表述。
克劳修斯表述指出:热量不能自发地从低温物体传递到高温物体。
开尔文表述则表明:不可能从单一热源吸取热量使之完全变为有用功而不产生其他影响。
通过熵的概念,可以更定量地理解热力学第二定律。
熵是一个系统混乱程度的度量。
在一个孤立系统中,熵总是增加的,这反映了自发过程总是朝着更加混乱、无序的方向发展。
三、热力学第三定律热力学第三定律指出:绝对零度时,纯物质的完美晶体的熵值为零。
这一定律为确定物质的熵值提供了基准。
四、化学热力学在化学热力学中,我们经常关注化学反应的热力学性质,如反应的焓变、熵变和自由能变化。
通过计算反应的焓变,可以判断反应是吸热还是放热。
熵变则反映了反应前后系统混乱程度的变化。
而自由能变化(ΔG)是判断反应能否自发进行的重要依据。
当ΔG < 0 时,反应在给定条件下能够自发进行;当ΔG = 0 时,反应处于平衡状态;当ΔG > 0 时,反应不能自发进行。
五、多组分系统热力学多组分系统中,需要考虑溶质和溶剂的相互作用。
引入了偏摩尔量的概念来描述多组分系统中某一组分的性质。




物理化学总分-回复物理化学总分:物理化学是研究物质的性质及其变化规律的科学,它是化学中的一门重要分支。
在物理化学的学习过程中,我们需要了解和掌握一系列的基础知识和实验技能。
本文将从物理化学的基本概念、主要内容和实验技巧三个方面,一步一步回答关于物理化学总分的问题。
一、物理化学的基本概念物理化学(Physical Chemistry)是将物理学与化学相结合的学科,它研究的是物质的基本性质、物质与能量的相互关系以及物质的组成和变化规律。
物理化学主要包括热力学、量子化学、统计力学和动力学等内容。
热力学是研究物质能量转化和能量转移的学科,它主要关注物质在不同条件下的热力学性质,如温度、压力和能量等。
热力学通过研究物质的热力学函数和热力学过程的定性和定量关系,揭示了物质在不同能量状态下的变化规律。
量子化学是研究微观领域的学科,它主要关注原子和分子的量子力学性质。
量子化学通过求解薛定谔方程来描述原子和分子的行为,并通过计算方法和模型来预测化学反应和化学性质。
量子化学的发展对于理论和计算化学的发展具有重要意义。
统计力学是研究物质组成和热力学性质之间关系的学科,它通过统计方法和概率模型描述了大量微观粒子的行为规律。
统计力学的研究可以帮助我们理解物质的宏观性质,如熵、热容和相变等。
动力学是研究物质变化速率和反应机制的学科,它可以揭示物质的化学反应过程中的速率规律和反应途径。
动力学通过实验数据和理论模型来研究物质的反应速率和反应机理,为实验和工业应用提供了理论支持。
二、物理化学的主要内容物理化学的主要内容包括热力学、量子化学、统计力学和动力学等。
这些内容相互关联、相互支撑,构成了物理化学的基础理论体系。
热力学是物理化学的基础,它研究物质的能量和热力学性质。
热力学通过热力学函数和热力学过程的关系,描述了物质在不同条件下的热现象。
热力学不仅揭示了物质热力学性质的基本规律,还为工程和实验提供了指导原则。
量子化学是研究微观粒子行为的学科,它可以预测原子和分子的光谱性质和反应行为。

目 录1.华南理工大学物理化学历年考研真题2014年华南理工大学629物理化学(一)考研真题2015年华南理工大学629物理化学(一)考研真题2016年华南理工大学629物理化学(一)考研真题2017年华南理工大学629物理化学(一)考研真题2018年华南理工大学629物理化学(一)考研真题2014年华南理工大学852物理化学(二)考研真题2015年华南理工大学852物理化学(二)考研真题2016年华南理工大学852物理化学(二)考研真题2017年华南理工大学852物理化学(二)考研真题2018年华南理工大学852物理化学(二)考研真题2.湖南大学物理化学历年考研真题2013年湖南大学831物理化学(理)考研真题2014年湖南大学831物理化学(理)考研真题2013年湖南大学832物理化学(工)考研真题3.武汉大学物理化学历年考研真题2013年武汉大学651分析化学和物理化学(C卷)考研真题2015年武汉大学655分析化学和物理化学(B卷)考研真题4.四川大学物理化学历年考研真题2015年四川大学887物理化学考研真题2016年四川大学887物理化学考研真题5.电子科技大学物理化学历年考研真题(含部分答案)2012年电子科技大学834物理化学考研真题及详解2013年电子科技大学834物理化学考研真题及详解2015年电子科技大学834物理化学考研真题6.中国科学技术大学物理化学历年考研真题2010年中国科学技术大学物理化学考研真题2011年中国科学技术大学物理化学考研真题2012年中国科学技术大学物理化学考研真题2013年中国科学技术大学物理化学考研真题2014年中国科学技术大学物理化学考研真题2015年中国科学技术大学物理化学考研真题2015年中国科学技术大学物理化学B考研真题7.其他名校物理化学历年考研真题(含部分答案)2011年南开大学831物理化学(含结构化学)考研真题2011年浙江大学726物理化学(甲)考研真题(含部分答案)2012年浙江大学726物理化学(甲)考研真题及详解2012年天津大学839物理化学考研真题及答案2012年厦门大学826物理化学考研真题2014年北京交通大学981物理化学考研真题2014年北京科技大学627物理化学B考研真题2015年北京科技大学804物理化学A考研真题2015年北京交通大学981物理化学考研真题2015年湘潭大学837物理化学(一)考研真题2014年华南理工大学629物理化学(一)考研真题2015年华南理工大学629物理化学(一)考研真题2016年华南理工大学629物理化学(一)考研真题2017年华南理工大学629物理化学(一)考研真题2018年华南理工大学629物理化学(一)考研真题2014年华南理工大学852物理化学(二)考研真题2015年华南理工大学852物理化学(二)考研真题2016年华南理工大学852物理化学(二)考研真题2017年华南理工大学852物理化学(二)考研真题2018年华南理工大学852物理化学(二)考研真题2013年湖南大学831物理化学(理)考研真题2014年湖南大学831物理化学(理)考研真题2013年湖南大学832物理化学(工)考研真题。
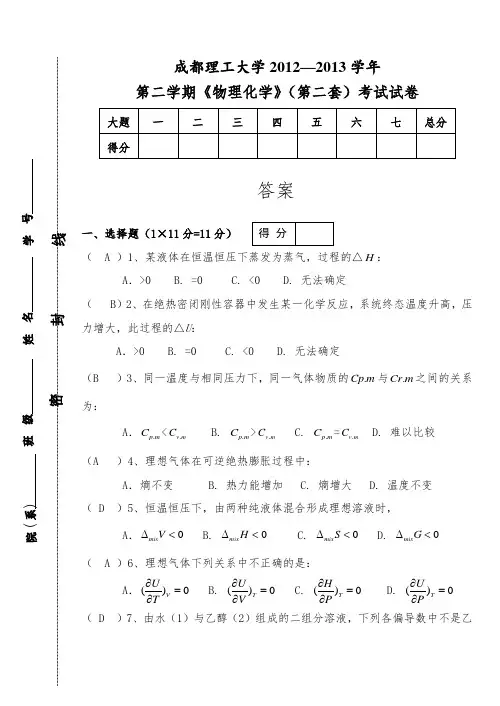
成都理工大学2012—2013学年 第二学期《物理化学》(第二套)考试试卷答案一、选择题(1×11分=11分)( A )1、某液体在恒温恒压下蒸发为蒸气,过程的△H :A .>0 B. =0 C. <0 D. 无法确定( B )2、在绝热密闭刚性容器中发生某一化学反应,系统终态温度升高,压力增大,此过程的△U :A .>0 B. =0 C. <0 D. 无法确定(B )3、同一温度与相同压力下,同一气体物质的.Cp m 与.Cr m 之间的关系为:A ..p m C <.v m C B. .p m C >.v m C C. .p m C =.v m C D. 难以比较(A )4、理想气体在可逆绝热膨胀过程中:A .熵不变B. 热力能增加C.熵增大 D. 温度不变(D )5、恒温恒压下,由两种纯液体混合形成理想溶液时,A.0mix V∆<B. 0mix H ∆<C. 0mix S ∆<D. 0mix G ∆<( A )6、理想气体下列关系中不正确的是:A .()0V U T ∂=∂ B. ()0T U V ∂=∂ C. ()0T H P ∂=∂ D. ()0T UP∂=∂ ( D )7、由水(1)与乙醇(2)组成的二组分溶液,下列各偏导数中不是乙得 分醇化学势的有:A .1,,2()S P n H n ∂∂ B. 1,,2()T P n G n ∂∂ C. 1,,2()T V n A n ∂∂ D. 1,,2()T P n U n ∂∂ ( A )8、在某一温度下,由纯A 与纯B 形成理想态混合物。
已知**AB P P <,当气液两相平衡时,气相组成B y 与该相组成B x 关系为:A .B y >B x B. B y <B x C. B y =B x D. 无法判断( C )9、将固体42()NH HCO s 放入真空容器中,恒温到400k ,43NH HCO 按下式分解并达平衡:43()NH HCO s 322()()NH H O g CO g +(g )+,体系的组分数C 和自由度F 为:A .C=2,F=1 B. C=2,F=2 C. C=1,F=0 D. C=3,F=2( C )10、某连串反应A →B →C ,实验测得B 非常活泼,当反应稳定后,则B 的生成速率与B 的消耗速率关系为:A .> B. < C. = D. 无法确定( D )11、对行反应A 11k k - B ;当温度一定时由A 开始,下列说法中是不对的:A .开始时A 的消耗速率最快 B. 反应的净速率是正逆二向反应速率之差 C. 11/k k -的值是恒定的D. 平衡时正逆二向速率常数相等二、填空题(20×0.5=10分)1、封闭系统由一始态出发,经历一循环过程,过程的U ∆ =0 ;H ∆得 分=0 ;Q 与W 的关系是 Q=-W ,但Q 与W 的具体数值 无法确定 ,因为 不知具体途径 。


2012-2013学年度第一学期《物理化学》期末考试复习阶段综合测试题〖复习建议与说明〗1. 期末考试题型:简答题和证明题;判断题;选择题;计算题。
2. 综合测试题独立必须认真完成;有些内容作为考核要求。
一、思考题1. Dalton 分压定律的适用条件是什么?Amagat 分体积定律的使用前提是什么?2. 有一种气体的状态方程为 m pV RT bp =+ (b 为大于零的常数),试分析这种气体与理想气体有何不同?将这种气体进行真空膨胀,气体的温度会不会下降?3. 气体的临界温度和临界压力是如何定义的?4. 当各种物质都处于临界点时,它们有哪些共同特性?5. 可逆热机的效率最高,在其他条件都相同的前提下,用可逆热机去牵引火车,能否使火车的速度加快?6. 理想气体的绝热可逆和绝热不可逆过程的功,都可用公式V W C T =∆计算,这两种过程所做的功是否一样?7. 在同温和同压下,一定量氢气和氧气从四种不同的途径生成水:(1)氢气在氧气中燃烧,(2)爆鸣反应,(3)氢氧热爆炸,(4)氢氧燃料电池。
在所有反应过程中,保持反应方程式的始态和终态都相同,请问这四种变化途径的热力学能和焓的变化值是否相同?8. 对处于绝热钢瓶中的气体,进行不可逆压缩,这过程的熵变一定大于零,这种说法对吗?9. 四个热力学基本公式适用的条件是什么? 是否一定要可逆过程?10. 什么是化学势? 它与偏摩尔量有什么区别? 哪个状态函数既是偏摩尔量,由是化学势?11. Raoult 定律和Henry 定律的表示式和适用条件分别是什么?12. 什么是稀溶液的依数性? 稀溶液有哪些依数性? 在室温下,物质的量浓度相同的蔗糖溶液与食盐水溶液的渗透压是否相等?13. 溶液的化学势等于溶液中各组分的化学势之和,这样说对不对? 为什么?14. 二组分理想溶液的总蒸气压,一定大于任一组分的蒸气分压,这样说对不对? 为什么?15. 液态物质混合时,若形成液态混合物,其混合性质的数学表达式分别是怎样的?16. 什么是物质的解离压? 如何确定化学反应的解离压?17. 在一定温度、压力且不作非膨胀功的条件下,若某反应的r m0G ∆,能否研制出一种催化剂使反应正向进行?18. 沸点和恒沸点有何不同?19. 如何用相律来说明恒沸混合物不是化合物?20. 低共熔混合物能不能看作是化合物?21. 某化学反应的计量方程为A B C +=,能认为这是二级反应吗? 为什么?22. 零级反应是否是基元反应? 为什么?23. 具有简单级数的反应是否一定是基元反应?24. 催化剂为什么能加快反应速率?二、单项选择题1. 理想气体模型的基本特征是【 】。
物理化学(一)复习题一、单选题1.在一个绝热钢瓶中,发生一个放热的分子增加的化学反应,那么 【 C 】A. Q >0,W >0,U ∆> 0B. Q =0,W =0,U ∆< 0C. Q =0,W =0,U ∆= 0D. Q < 0,W >0,U ∆< 02.在一个绝热钢瓶中,发生一个放热的分子减少的化学反应,那么 【 C 】A. Q >0,W >0,U ∆> 0B. Q =0,W =0,U ∆< 0C. Q =0,W =0,U ∆= 0D. Q < 0,W >0,U ∆< 03.1mol 双原子理想气体,从同一始态出发经绝热可逆压缩和绝热不可逆压缩到相同压力的终态,终态的熵分别为1S 和2S ,则两者的关系为 【 B 】A. 1S =2SB. 1S <2SC. 1S >2SD. 1S ≥2S4.理想气体在绝热可逆膨胀过程中,体系的H ∆和S ∆下列关系中正确的是 【C 】A. H ∆>0,S ∆>0B. H ∆=0,S ∆=0C. H ∆<0,S ∆=0D. H ∆<0,S ∆<05.关于S T H G ∆-∆=∆,下列说法中正确的是 【B 】A. 适用于任意热力学过程B. 适用于任意等温热力学过程C. 适用于等温下的化学反应D. 适用于无化学反应的等温过程6.C 反应C (石墨) + O 2 CO 2(g ),该反应的H ∆(298 K )< 0 ,若将此反应放于一个恒容绝热的容器中进行,则体系【B 】A. T < 0,U ∆< 0,H ∆< 0B. T >0,U ∆= 0 ,H ∆>0C. T >0,U ∆>0,H ∆>0D. T >0,U ∆=0, H ∆= 07.下列偏微分中,能称为偏摩尔量的是 【A 】 A. ()c C B C n P T Bn U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, B. ()c C B C n P S B n H ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. ()c C B C n V P Bn G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, D. ()c C B C n H T B n S ≠⎪⎪⎭⎫ ⎝⎛∂∂,, 8.下列偏微分中,不是化学势的是 【B 】 A. ()c C B C n V S Bn U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, B. ()c C B C n P T B n U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. ()c C B C n T P B n G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, D. ()cC B C n V T B n A ≠⎪⎪⎭⎫ ⎝⎛∂∂,, 9.2mol A 和3mol B 在等温、等压下,混合形成理想液态混合物,该系统中A 和B 的偏摩尔体积分别为1.791510--⋅⨯mol m 和1351015.2--⋅⨯mol m ,则混合物的总体积为 【C 】A. 9.673510m -⨯B. 9.853510m -⨯C. 1.0033410m -⨯D. 8.953510m -⨯10在298K 和标准压力下,有两瓶含萘的苯溶液。
上了大学,化学教材如果按学习顺序是哪一些教材三基础:1-0 化学导论•傅献彩,等. 大学化学. 第二版 (上册). 高等教育出版社, 2019•华彤文,等. 普通化学原理. 第4版. 北京大学出版社, 2013.•申泮文. 近代化学导论. 第二版 (上、下册). 高等教育出版社•北京师范大学无机化学教研室,等. 无机化学. 第四版(上册). 高等教育出版社•蒲雪梅,寇兴明,李桂英,等. 大学化学实验. 第二版. 化学工业出版社[1]0-1 高等数学•同济大学数学系. 高等数学. 第七版 (上、下). 高等教育出版社•龚昇. 简明微积分. 第四版. 高等教育出版社•四川大学数学学院. 高等数学. 第二版(上、下). 四川大学出版社1-1 无机化学(元素化学)•北京师范大学无机化学教研室,等. 无机化学. 第四版(下册). 高等教育出版社•车云霞,等. 化学元素周期系. 南开大学出版社, 1999•张祖德. 无机化学. 第2版. 中国科学技术大学出版社[2]•刘新锦,等. 无机元素化学. 第二版. 科学出版社•傅献彩. 大学化学. 第2版 (下册). 高等教育出版社,2019[3]•李瑞祥,曾红梅,等. 无机化学. 第2版. 化学工业出版社2-1 有机化学•David Klein. Organic chemistry. Wiley•邢其毅,裴坚,等. 基础有机化学. 第4版(上、下册).北京大学出版社, 2016,2017.•李瑛,张骥. 有机化学基础. 第三版. 科学出版社, 2020•王玉良,等. 有机化学实验. 科学出版社, 20200-2 概率统计•盛骤,等. 概率论与数理统计. 第4版. 高等教育出版社•陈鸿建,等. 概率论与数理统计. 第二版. 高等教育出版社0-3 普通物理•Feynman. The Feynman lectures on physics.•赵凯华. 新概念物理教程. 第二版. 高等教育出版社•王磊,陈钢,等. 大学物理学. 第二版 (上、下册). 高等教育出版社3-1 分析化学•Daniel Harris. Quantitative chemical analysis.•武汉大学. 分析化学. 第6版 (上、下册). 高等教育出版社[4]•柴逸峰,等. 分析化学. 第8版. 人民卫生出版社, 2016.•胡坪,等. 仪器分析实验. 第三版. 高等教育出版社,2016.4-1 物理化学•Peter Atkins,et al. Atkins物理化学, Atkins'physical chemistry. 第7版 (影印版). 高等教育出版社•傅献彩,等. 物理化学. 第五版 (上、下册). 高等教育出版社•彭笑刚. 物理化学讲义. 高等教育出版社•何玉萼,童冬梅,等. 物理化学. (上、下册). 化学工业出版社, 2006.•王健礼,等. 物理化学实验. 第二版. 化学工业出版社, 2015.•复旦大学,等. 物理化学实验.•袁永明,等. 物理化学学习指导. 中国石化出版社[5]0-4 线性代数•Gilbert Strang,et al. Linear algebra and itsapplication. 4th edition. Thomson Learning•北京大学数学系前代数小组. 高等代数. 第五版. 高等教育出版社•四川大学数学学院. 线性代数. 第二版. 四川大学出版社4-2 结构化学•李炳瑞. 结构化学. 第4版. 高等教育出版社, 2020.•周公度,等. 结构化学基础. 第5版. 北京大学出版社•李平. 量子化学导论:原子、分子结构. 科学出版社,2018.[6]进阶:1-2《中级无机化学》4-1-1 分子光化学•Turro,Ramamurthy,et al. Modern molecularphotochemistry of organic molecules. UniversityScience Books•图罗,拉马穆尔蒂,等. 现代分子光化学. 吴骊珠,吴世康,等译 (原理篇、反应篇). 化学工业出版社2-1-1 有机反应机理•Daniel Levy. Arrow-pushing in organic chemistry.Wiley•Robert Grossman. 有机反应机理的书写艺术, The artof writing reasonable organic reaction mechanisms.2nd edition. 科学出版社, 2012.2-1-2 合成化学•Stuart Warren,et al. Organic synthesis, thedisconnction approach. 2nd edition. Wiley•巨勇,等. 有机合成化学与路线设计. 第2版. 清华大学出版社, 2007.2-1-3 有机立体化学•David Morris. Stereochemistry.•叶秀林. 立体化学. 2版. 北京大学出版社, 1999•Hellwich,et al. Stereochemistry workbook.translated by Allan Dunn3-2 谱学导论•Robert Silverstein. Spectrometric identification of organic pounds.•周向葛,徐开来,等. 波谱解析. 化学工业出版社2-2 中级有机化学4-2-1《量子化学》4-2-2《计算化学》其它:2-3 高分子科学•王玉忠,等. 高分子科学导论. 科学出版社•丁会利,等. 高分子材料及应用. 化学工业出版社2-4 生物化学•David Nelson,et al. Lehninger principles ofbiochemistry. 7th edition, 2017•朱圣庚,等. 生物化学教程. 第4版 (上、下册). 高等教育出版社, 2017.•王靳娥,等. 生物化学基础. 第二版. 化学工业出版社, 2019.•Koolman,et al. Color atlas of biochemistry. 2ndedition, 20135-3 环境化学•马纳汉. 环境化学. 第九版, 孙红文,等译. 高等教育出版社•戴树桂. 环境化学. 高等教育出版社5-1-1《化工原理》5-1-2 工业化学•李金铭,等. 现代工业化学. 第二版. 华中科技大学出版社5-1-3 化工制图•林大钧. 简明化工制图. 化学工业出版社•陈志. 化工制图. 四川大学出版社5-2《精细化学品》1-3 放射化学•王祥云,等. 核化学与放射化学. 北京大学出版社•祝霖. 放射化学. 原子能出版社4-2-2《计算化学》5-4《化学信息学》。