2008年高考重庆理综化学试题和参考答案
- 格式:doc
- 大小:266.00 KB
- 文档页数:5

2008年普通高等学校夏季招生考试(重庆卷)理科综合能力测试1.以下关于种群、群落和生态系统的叙述,正确的是()A.种群中的个体是生物进化的基本单位B.亚热带生长的常绿阔叶林组成一个种群C.马尾松林地中所有树木构成了生物群落D.生态系统的营养结构是食物链和食物网参考答案与解析:D解析:考查了生态系统的相关概念。
一定时间、空间内同种生物个体的总和构成种群;一定地域内所有种群(包括动物、植物和微生物)的总和构成群落;群落及其生活的无机环境共同构成生态系统。
生态系统的结构由生态系统的成分和营养结构组成:生态系统的成分有非生物的物质和能量、生产者、消费者和分解者;营养结构包括食物链和食物网。
生物进化的基本单位是种群而非个体。
2.下列叙述错误的是()A.酵母菌有核膜,而固氮菌没有B.酵母菌有细胞膜,而固氮菌没有C.黑藻细胞有线粒体,而蓝藻细胞没有D.黑藻细胞有内质网,而蓝藻细胞没有参考答案与解析:B解析:考查了微生物细胞结构的有关知识。
微生物包括细菌、真菌和病毒。
其中细菌和真菌的区别是真菌有成形的细胞核,属于真核生物,细菌无成形的细胞核,属于原核生物。
真核生物,细胞内有多种复杂的细胞器,而原核生物细胞内只有核糖体一种细胞器。
二者的共同点是均有细胞壁、细胞膜和遗传物质DNA。
在本题中酵母菌和黑藻属于真核生物,固氮菌和蓝藻属于原核生物。
3.下列有关神经系统及其调节的叙述,正确的是()A.切除下丘脑的动物丧失血糖调节能力B.调节人体生理活动的高级神经中枢是下丘脑C.机体对刺激作出迅速反应的调节属于神经调节D.先天性行为与神经系统的调节作用无直接联系参考答案与解析:C解析:考查了动物神经调节的知识。
血糖的调节过程是神经—激素调节,其中主要是激素调节,切除下丘脑后失去了血糖调节中枢,但仍有激素调节;下丘脑是调节内分泌的枢纽,大脑皮层才是调节人体生理活动的最高级神经中枢;先天性行为的发生是由一系列的非条件反射构成的,与神经调节有直接关系。
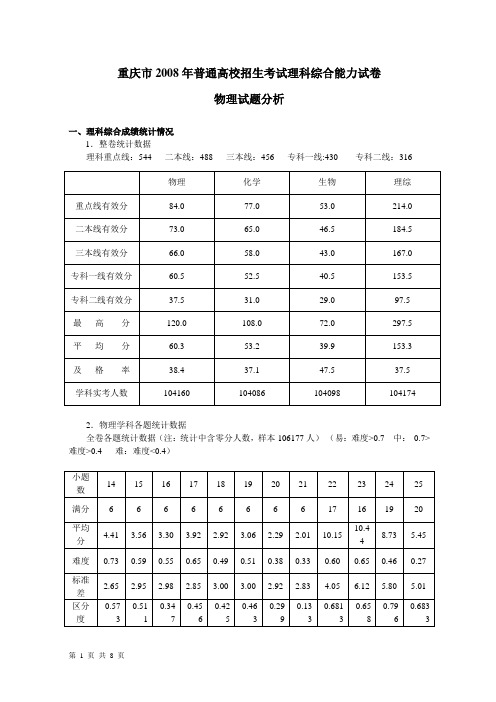
重庆市2008年普通高校招生考试理科综合能力试卷物理试题分析一、理科综合成绩统计情况1.整卷统计数据理科重点线:544 二本线:488三本线:456 专科一线:430 专科二线:3162.物理学科各题统计数据全卷各题统计数据(注:统计中含零分人数,样本106177人)(易:难度>0.7 中:0.7>难度>0.4 难:难度<0.4)第Ⅰ卷各题选项统计数据题号 A B C D 正确选项易错选项14 4.14 11.68 8.66 73.47 D B15 59.37 19.51 4.92 14.07 A B16 4.55 4.35 55.08 33.97 C D17 4.1065.36 20.99 7.51 B C18 10.70 16.47 22.05 48.64 D C19 9.85 51.01 25.26 11.71 B C20 38.22 29.4515.81 14.40 A B21 10.88 11.6233.44 41.84 D C二、试题分析(一)试题总的印象今年是理科综合能力测试自主命题的第三年,总体看物理学科试题与2007年相比变化较大,试题难度大为降低,计算量和阅读思考量较为合理,物理试题的平均分从2007年的45.38升高到今年的61.42。
全卷题量与2007年相同,试卷结构和去年相比有一定变化,物理的8道选择题均为单选题。
各学科占分比例仍为,物理120分、化学108分、生物72分。
第Ⅰ卷选择题的题目顺序仍然保持往年的生物、化学、物理的顺序;第Ⅱ卷物理题放在最前面,化学题放在中间,生物题放在最后。
(二)试题值得肯定的方面1.试卷整体设计基本体现了《考试大纲》的要求。
物理试题强调基础,注意了主干知识的考查。
力学50分,电磁学50分,热学6分,光学6分,近代物理8分,知识分布基本合理。
力学考查了平衡、万有引力定律和卫星、简谐运动、机械波的传播、牛顿第二定律、运动学、动能定理、机械能守恒定律、动量守恒定律等内容;电磁学考查了电场、电容器、电路和电功率、电路实验、电磁感应、带电粒子在磁场中的运动;热学考查了气体的性质、热力学第一定律;光学考查了光电效应、光的折射和全反射;原子物理考核反应的衰变方程。


目夺市安危阳光实验学校高考有机化学部分试题详解一.选择题:1.(全国理综Ⅰ8.)下列各组物质不属于...同分异构体的是A.2,2-二甲基丙醇和2-甲基丁醇B.邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D.甲基丙烯酸和甲酸丙酯[答案]D。
[解析]考查:判断同分异构体、根据有机物名称写出其结构简式的能力。
[解析]根据有机物的名称,知道各选项中有机物的碳原子数是一样多的。
D选项中的甲基丙烯酸中有两个双键(碳碳双键和碳氧双键),而甲酸丙酯中只有一个碳氧双键,故这两种物质不是同分异构体。
2.(山东卷 12).下列叙述正确的是A.汽油、柴油和植物油都是碳氢化合物B.乙醇可以被氧化为乙酸,二者都能发生酯化反应C.甲烷、乙烯和苯在工业上都可通过石油分馏得到D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键[答案]B。
[解析]:植物油是碳氢氧化合物,故A错;乙醇可以被氧化为乙酸,二者都能发生酯化反应,B对;乙烯和苯在工业上都不能通过石油分馏得到,所以C错;含5个碳原子的环状烷就烃含5个C-C单键,故D错。
3.(重庆卷11).食品香精菠萝酯的生产路线(反应条件略去)如下:下列叙述错误..的是A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应D.步骤(2)产物中残留的烯丙醇可用溴水检验【答案】D【试题分析】A项苯酚与ClCH2COOH反应生成的苯氧乙酸不含有酚羟基,故残留物中若含有苯酚可以与FeCl3显紫色;B项苯酚可以被O2所氧化而呈粉红色,当然也可以被KMnO4所氧化,菠萝酯含有碳碳双键,故也可被KMnO4氧化;苯氧乙酸中含有羧酸可与碱反生中和反应,菠萝酯属于酯可以在碱性条件下发生水解;由于菠萝酯含有碳碳双键也可以使溴水褪色,故不能用来检验残留的烯丙醇。
【高考考点】有机物中官能团的性质检验【易错提醒】理不清在多重官能团时检验的相互干扰。

2008年高考四川理综化学试题第Ⅰ卷本卷共21小题,每小题6分,共126分 相对原子质量(原子量):H1 C12 N14 O16 Al 127 Cl 35.5一.选择题:(本大题共13小题,每小题出的四个选项中,只有一项是符合题目要求的。
) 6.下列说法不正确...的是 A .1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L B .1mol 臭氧和1.5mol 氧气含有相同的氧原子数C .等体积、浓度均为1mol/L 的磷酸和盐酸,电离出的氢离子数之比为3∶1D .等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3 7.下列关于热化学反应的描述中正确的是A .HCl 和NaOH 反应的中和热ΔH =-57.3kJ/mol ,则H 2SO 4和Ca(OH)2反应的中和热ΔH =2×(-57.3)kJ/molB .CO(g)的燃烧热是283.0kJ/mol ,则2CO 2(g) =2CO(g)+O 2(g)反应的ΔH =2×283.0kJ/molC .需要加热才能发生的反应一定是吸热反应D .1mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热8.在密闭容器中进行如下反应:H 2(g) +I 2(g) 2HI(g),在温度 T 1和T 2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是A .T1>T 2,ΔH >0 B .T 1>T 2,ΔH <0 C .T 1<T 2,ΔH >0 D .T 1<T 2,ΔH <09.下列叙述中正确的是A .除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的租序数B .除点周期外,其他周期均有18个元素C .副族元素中没有非金属元素D .碱金属元素是指ⅠA 族的所有元素 10.下列说法中正确的是A .离子晶体中每个离子周围均吸引着6个带相反电荷的离子B .金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动C .分子晶体的熔沸点很低,常温下都呈液态或气态D .原子晶体中的各相邻原子都以共价键相结合 11.能正确表示下列反应的离子方程式是A .足量硫酸铝与纯碱反应:↑+↓=++-+232233CO 3)OH (Al 2O H 3COI 3Al 2 B .硫酸铜与烧碱反应:--+↓=+2424S O )OH (Cu OH 2CuS OC .苯酚与碳酸钠反应:O H CO O H C 2CO OH H C 222562356+↑+=+--D .碳酸钡与硫酸反应:↓=+-+4242BaSO S O Ba 12.胡椒粉是植物挥发油的成分之一。

2008年高考(全国Ⅱ)理综化学试题6.2008年北京奥运会的“祥云”火炬所用的燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确...的是A.分子中碳原子不在一条直线上B.光照下能够发生取代反应C.比丁烷更易液化D.是石油分馏的一种产品解析:烷烃分子结构,是以每个碳为中心的四面体结构,多碳烷烃的碳链是锯齿型的,碳原子不在一条直线上;烷烃的特征反应是在光照条件下发生取代反应;石油分馏所获碳原子在1—4之间的烷烃混合物叫石油气,更进一步分离石油气可获得丙烷。
烷烃随分子内碳原子数的增多,状态由气态、液态、固态变化,组成和结构相似的物质,随分子量的增大,分子间作用力增大,因此丁烷比丙烷易液化。
考点:烷烃的结构、物理性质(液化)、化学性质(取代反应)、丙烷的获取(石油分馏)。
7.实验室现有3种酸碱指示剂,其pH变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.1000mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂解析:反应恰好完全时,生成CH3COONa是强碱弱酸盐,因发生水解而使溶液显碱性,因此,应该选用酚酞作指示剂。
8.对于ⅣA族元素,下列叙述中不正确...的是A. SiO2和CO2中,Si和O、C和O之间都是共价键B. Si、C、Ge的最外层电子数都是4,次外层电子数都是8C. SiO2和CO2中都是酸性氧化物,在一定条件下都能和氧化钙反应D. 该族元素的主要化合价是+4和+2考点:物质结构、元素周期律。
9.取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为A.0.01mol/LB. 0.017mol/LC. 0.05mol/LD. 0.50mol/L解析:设原溶液物质的量浓度为cmol/L,V(NaOH)=3L,V(HCl)=2L,二者混合后反应,混合溶液体积为5L,二者混合后反应,所得溶液pH=12,则c(OH-)=10-2mol/L3L×cmol/L-2L×cmol/L = 10-2mol/L×5L则,c=0.05mol/L10.右图为直流电源电解稀Na2SO4水溶液的装置。
2008年高考重庆理综化学试题和参考答案
第一部分(选择题共126分)
本部分包括21小题,每小题6分,共126分,每小题只有一个
....选项符合题意
6、下列做法中用到物质氧化性的是
A.明矾净化水
B.纯碱除去油污
C.臭氧消毒餐具
D.食醋清洗水垢
7、向三份0.1mol,L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2因体(忽略
溶液体积变化),则CH3COO-浓度的变化依次为
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
8、下列实验装置图正确的是
9、下列各组离子在给琮条件下能大量共存的是
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO2-4存在的溶液中:Na+、Mg2+、Ca2+、l-
C.有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-
D.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
10、下列叙述正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
11、食品香精菠萝酯的生产路线(反应条件略去)如下:
下列叙述错误..
的是 A.步骤(1)产物中残留的苯酚可用FeCl,溶液检验
B.苯酚和菠萝酯均可与酸性RmnO 4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH 溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
12、如题12图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl 的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是
A.a 中铁钉附近呈现红色
B.b 中铁钉上发生还原反应
C.a 中铜丝上发生氧化反应
D.b 中铝条附近有气泡产生
13、化学反应N 2+3H 2=2NH 3的能量变化如题13
图所示,该反应的热化学方程式是
A.N 2(g)+3H 2(g)=2NH 3(1); △H =2(a-b-c)kJ ·mol
-1
B. N 2(g)+3H 2(g)=2NH 3(g);
△H =2(b-a)kJ ·mol -1 C.1
2N 2(g)+3
2H 2(g)=NH 3(1);
△H =(h+c-a)kJ ·mol -1 D. 1
2N 2(g)+3
2H 2(g)=NH 3(g);
△H =(a+b)kJ ·mol -1
参考答案:
6.C
7.A
8.B
9.D 10.C 11.D 12.B 13.A
第二部分(非选择题共174分)
26.(14分)
N 2O 5—是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N 2O 5与苯发生硝化反应生成的硝基苯的结构简式是
2N 2O 5(g )→4NO 2(g )+O 2(g);ΔH >0
①反应达平衡后,若再通入一定量氮气,则N 2O 5的转化率将 .(填“增大”、“减小”、“不变”)
②下表为反应在T 温度下的部分实验数据:
则500 s 内N 2O 5的分解速率为 .
③在T 3温度下,反应1 000 s 时测得NO 2的浓度为4.98 mol ·L -1,则T 2 T 1.
(3)题26图所示装置可用于制备N 2O 5,则N 2O 5在电解池的 区生成,其电极反
应式为 .
参考答案:
(1)
(2)①不变
②0.00296 mol·L-1·s-1
③“<”或“小于”
(3)阴极.N2O4+2HNO3-2e-=2N2O5+2H+
27.(14分)
某学习小组用题27图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
(1)A中试剂为.
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是.
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是;(填序号)记录C的液面位置时,除视线平视外,还应.
(4)B中发生反应的化学方程式为.
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将.(填“偏大”、“偏小”、“不受影响”)
参考答案:
(1)NaOH溶液.
(2)除去铝镁合金表面的氧化膜.
(3)⑤①④③②(2分);使D和C的液面相平
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
或2Al+2OH-+2H2O=2AlO-
2
+3H2↑
(5)33600()
.
a c
b
-
(6)偏小.
28.(16分)
天然气化工是重庆市的支柱产业之一.以天然气为原料经下列反应路线可得工程塑料PBT.
(1)B分子结构中只有一种氢、一种氧、一种碳,则B的结构简式是;B的同分异构体中与葡萄糖具有类似结构的是.(写结构简式)
(2)F的结构简式是;PBT属于类有机高分子化合物.
(3)由A、D生成E的反应方程式为,其反应类型为. (4)E的同分异构体G不能发生银镜反应,能使汾水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是.
参考答案:
(1)
(2)HO—CH2—CH2—CH2—CH2—OH;酯(或聚酯)
(3)HC ≡CH+2HCHO −−→HOCH 3C ≡CCH 2OH;加成反应
(4)CH 2=CH —COOCH 3+NaOH −−→CH 2=CH —COONa+CH 3OH
29.(16分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化
学式为XY 2,X 、Y 均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY 2含有54 mol 电子.
(1)该融雪剂的化学式是 ;X 与氢元素形成的化合物的电子式是 .
(2)元素D 、E 原子的最外层电子数是其电子层数的2倍,D 与Y 相邻,则D 的离子结构
示意图是 ;D 与E 能形成一种非极性分子,该分子的结构式为 ;D 所在族元素的氢化物中,沸点最低的是 .
(3)元素W 与Y 同周期,其单质是原子晶体;元素Z 的单质分子Z 2中有3个共价健;W
与Z 能形成一种新型无机非金属材料,其化学式是 .
(4)元素R 与Y 同主族,其氢化物能用于刻蚀玻璃,R 2与NaOH 溶液反应的产物之一是
OR 2,该反应的离子方程式为 .
参考答案:
(1)CaCl 2;
(2)
S=C=S ;H 2S
(3)Si 3N 4
(4)2F 2+2OH —=2F —+OF 2+H 2O
碱。