化学反应速率 化学反应速率理论共65页
- 格式:ppt
- 大小:6.60 MB
- 文档页数:65

化学反应速率化学反应速率是指在一定时间内,反应物消耗或生成的物质的量与时间的比值。
它是化学反应过程的重要指标之一,可以帮助我们了解反应的快慢和反应机理。
本文将从反应速率的定义、影响因素以及如何调控反应速率等方面展开讨论。
一、反应速率的定义反应速率可以用以下公式表示:速率= Δ物质产生量/ Δ时间其中,Δ物质产生量表示在某一段时间内生成或消耗的物质的量,Δ时间表示这段时间的长度。
反应速率的单位通常是摩尔/升·秒。
根据反应速率的定义,可以得出以下结论:1. 反应速率越大,表示反应进行得越快;反之,反应速率越小,表示反应进行得越慢。
2. 反应速率可以根据反应物的浓度变化来推测。
当反应物浓度较高时,反应速率通常较快;当反应物浓度较低时,反应速率通常较慢。
二、影响反应速率的因素反应速率受到多种因素的影响,主要包括以下几个方面:1. 温度:温度对反应速率的影响是最主要且最直接的。
一般情况下,温度升高会使反应速率增加,因为温度升高可以提高反应物的分子动能,增加碰撞频率和碰撞能量,从而有利于反应进行。
2. 浓度:反应物浓度越高,反应物之间的碰撞频率就越高,反应速率也就越快。
3. 催化剂:催化剂是一种能够提高反应速率但本身不参与反应的物质。
它可以通过降低反应物之间的活化能降低反应速率,从而加速反应进行。
4. 压力:对气相反应而言,压力的增加可以增加反应物分子之间的碰撞频率,从而提高反应速率。
5. 表面积:固相反应中,反应物的表面积越大,反应速率越快。
这是因为表面积的增加可以提高反应物之间的碰撞频率。
三、调控反应速率的方法1. 温度控制:根据反应速率与温度的关系,我们可以通过调节反应温度来控制反应速率。
例如,对于发生在生物体内的化学反应,我们可以通过维持恒定的体温来保证反应在一个适宜的速率下进行。
2. 浓度控制:可以通过改变反应物的浓度来控制反应速率。
增加反应物浓度将提高反应速率,减少反应物浓度则会降低反应速率。

化学反应速率及其影响因素(总13页)-本页仅作为预览文档封面,使用时请删除本页-明士教育集团个性化教学辅导导学案(2015秋季使用)编写教师: 校对教师: 审核教师:教学课题 化学反应速率和化学平衡 课时计划第(1)次课授课教师 学科 化学 授课日期和时段上课学生年级 高二 上课形式 阶段 基础( ) 提高(√ ) 强化( ) 教学目标 1.使学生了解化学反应速率的概念及表示方法2.使学生理解浓度、压强、温度和催化剂等条件对化学反应速率的影响重点、难点 重点:浓度对化学反应速率的影响难点:浓度对化学反应速率影响的原因知识点一:化学反应速率1、含义:化学反应速率是用来衡量化学反应进行快慢的物理量。
2、表示方法:在容积不变的反应器中,通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示 。
3、数学表达式: V = △C/ △t4、单位:mol/(L·s )或mol/(L·min )或mol/(L·h )注意事项:1. 化学反应速率是标量,即只有大小而没有方向;2. 一般地计算出来的化学反应速率是一段时间内的平均反应速率,不同时刻的化学反应速率是不相同的;3. 对于固体物质或气态反应中的液体物质,反应在其表面进行,它们的“浓度”是不变的,因此不用液体和固体表示化学反应速率;4. 对于同一化学反应,用不同的物质表示其化学反应速率可能不相同,但其化学反应速率比等于化学方程式中化学计量数之比。
例如在N 2+3H 2 2NH 3中 v (N 2)∶v (H 2)∶v (NH 3)=1∶3∶2。
要点诠释:知识点二:影响化学反应速率的因素“凡事预则立,不预则废”。
科学地预习才能使我们上课听讲更有目的性和针对性。
我们要在预习的基础上,认真听讲,做到眼睛看、耳朵 Ⅰ、知识梳理 认真阅读、理解教材,带着自己预习的疑惑认真听课学习,复习与本次课程相关的重点知识与公式及规律,认真听老师讲解本次课程基本知识要点。
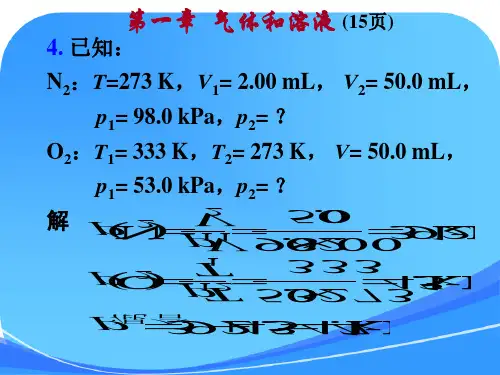

反应速率-习题(总11页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--化学反应速率1.在一定条件下,活化能越大,活化分子的百分数越 ,化学反应速率越 。
2.对于 反应,可根据质量作用定律按化学反应方程式直接写出速率方程。
3.反应(果糖)葡萄糖612661262112212)(O H C O H C O H O H C +→+为二级反应。
若反应系统中122211C H O 浓度很稀时,实际上二级反应可作为 级反应来处理,此时它的动力学反程式是 。
4.实验表明,在一定温度范围内,反应222NO Cl NOCl +=符合质量作用定律。
该反应的速率方程为 ,该反应级数为 。
若其他条件不变,将容器的体积增加为原来的2倍,则反应速率为原来的 。
5.对于符合质量作用定律的化学反应aA+bB?dD+gG ,其速率方程为)()(B c A kc v b a =。
式中,k 称为 ,c(A)、c(B)分别表示 ,a+b 称为 。
6.反应速率常数与 无关,但受 和 的影响。
7.某反应速率常数311.310k s --=⨯,则此反应为 级反应,以 对 做图得一直线,直线的斜率为 。
8.催化剂能加快反应速率的机制为 。
9.某药物从血浆中的清除速率为一级反应,测得其1/24t h =,该反应的速率常数k= 。
10.当反应物A 的浓度分别是L 和L 时,测得2A B →反应前后两次反应速率之比为2:1,则该反应级数为 级。
11.反应物A 分解为B 和C 。
在某反应条件下A 最后有30﹪分解,现条件不变,使用催化剂,则A 最后分解应 30﹪(大于,等于,小于)。
12.反应C B A +→,若正向反应的活化能为a E ,逆向反应的活化能为'a E 。
已知正向反应是吸热反应,则a E 'a E (大于,等于,小于)。
13.欲使反应物单位体积活化分子数增加以加快反应速率,可采取增加浓度、升高温度和的方法。


化学中的化学反应速率(化学知识点)化学反应速率是指单位时间内反应物消失或产物生成的速率。
反应速率的快慢对于化学反应的研究和应用具有重要的意义。
本文将介绍化学反应速率的定义、影响因素以及如何测定反应速率。
一、化学反应速率的定义化学反应速率是指在一定条件下,反应物消失或产物生成的速率。
一般情况下,反应速率可以通过反应物消失的速率来描述,以此来衡量反应进行的快慢。
化学反应速率可以用如下公式来表示:速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间的变化量。
速率的单位可以是摩尔/升·秒(mol/L·s)、分子/升·秒(molecules/L·s)等。
二、影响化学反应速率的因素化学反应速率受到多种因素的影响,主要包括以下几个方面。
1.反应物浓度:当反应物浓度增加时,反应物之间的碰撞频率增加,从而增加了反应的可能性,使得反应速率加快。
2.温度:提高温度会增加反应物的动能,使反应物之间的碰撞更加频繁且具有更高的能量。
因此,温度升高会加快反应速率。
3.催化剂:催化剂可以降低反应的活化能,使反应物更容易发生反应。
催化剂的存在可以提高反应速率,而不参与反应本身。
4.表面积:反应物的表面积越大,反应物颗粒之间的碰撞频率就越高,反应速率也会增加。
5.反应物的物理状态:气相反应相较于固相反应和液相反应具有更高的反应速率,因为气态分子之间的自由运动能带来更频繁的碰撞。
三、测定反应速率的方法测定反应速率是研究反应动力学的重要手段,常用的方法有以下几种。
1.逐点法:在反应过程中,定时取样,通过测定不同时间点上反应物消失或产物生成的量来计算反应速率。
2.连续监测法:利用分光光度计、电导计等仪器对反应过程进行实时监测,获得反应物浓度的变化曲线,从而计算反应速率。
3.消失溶液平行测定法:将相同溶液分装到多个容器中,分别对不同容器中的反应液进行逐点法测定并计算平均速率,以提高测定结果的准确性。


大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。


化学反应速率化学反应速率是指反应物质在单位时间内消耗或形成的量。
反应速率的大小与化学反应进行的快慢有关,可以通过实验来确定。
本文将介绍化学反应速率的概念、影响因素以及如何测量和调控反应速率。
一、化学反应速率的定义化学反应速率是指在单位时间内反应物质的消耗或生成速度。
一般用反应物浓度的变化量来表示,可以通过下式计算:反应速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间间隔。
反应速率越大,反应进行得越快,反之亦然。
二、影响化学反应速率的因素1. 浓度:反应物浓度越高,反应速率越快。
这是因为高浓度意味着反应物分子碰撞的几率增加,从而增加了反应速度。
2. 温度:温度升高会导致分子动能增加,分子碰撞频率增加,反应速率增加。
根据阿伦尼乌斯方程,温度每升高10摄氏度,反应速率会增加2倍至3倍。
3. 催化剂:催化剂是能够改变反应机理、降低活化能的物质。
添加催化剂可以提高反应速率,但催化剂本身在反应中不参与化学变化。
4. 表面积:反应物分子在固体表面上的反应速率比在液体中要快。
这是因为固体表面积大,反应物分子易于吸附在固体表面上进行反应。
三、测量和调控1. 实验测量:可以通过实验来确定反应速率。
例如,在固定温度下,测量反应物浓度随时间的变化,根据测得的数据计算反应速率。
2. 温度控制:调控反应温度可以改变反应速率。
通过改变温度,可以调节反应的快慢,实现对反应速率的控制。
3. 催化剂的使用:添加催化剂可以提高反应速率。
选择适当的催化剂,可以加快反应速度,提高反应效率。
4. 反应物浓度调节:调节反应物浓度也可以改变反应速率。
增加反应物浓度可以加快反应速率,减少浓度则相反。
结语化学反应速率是化学反应进行的快慢的量化指标,受多种因素影响。
了解化学反应速率的概念和影响因素,对于实际应用具有重要意义。
实验测量和调控反应速率是化学研究和工业生产中常用的手段,可以根据实际需要选择合适的方法来控制反应速率。

化学动力学Contents •概述•总包反应和基元反应•基元反应速率–双分子反应和碰撞理论–其他基元反应•多步机理的反应速率–净生成率–简洁形式–速率系数和平衡常数的关系•稳态近似方法–单分子反应机理–链式和链式分支反应•链式反应•链式分支反应•化学反应时间尺寸–单分子反应–双分子反应•局部平衡方法•小结概述•化学反应速率控制燃烧速率•化学速率决定污染物的形成与分解.•点火与熄火与化学过程密切相关•基元反应及其化学动力学是物理化学的一个特定的领域. •从反应物到产物的详细化学路径的定义•测量或计算它们相应的速率.•构建计算机模型来模拟反应系统.•基本化学动力学概念(本章)•与燃烧相关的重要化学机理(5)•化学过程与热力学模型的联立(6)•流体力学、化学、热力学方程(7)化学动力学•热力学: 反应是偏向产物还是反应物?•没有给出反应过程进行的速度的信息•动力学—是反应速度速率及相应反应进行的进程的关系的研究:机理.反应的实例!H2(g) + ½O2→H2O (l) 很慢N2O(g) → N2 (g) + ½O2 (g) 慢燃烧反应⇒快速过程TNT 爆炸⇒非常快的反应食物变质药物分解化学反应与时间的联系•讨论化学反应的动能学(energetics).2 A → B 化合反应.•这个反应需要多长时间来进行?化学动力学•动力学是研究化学反应的速率的,速率是指随时间变化的过程•速率的单位是单位时间的浓度, M/s•随时间,浓度可以增加(产物)也可以减少(反应物)A +B → C化学动力学•当对一个化学反应的浓度与时间变化曲线作图,图上任意一点的切线(过浓度点) 定义了反应的瞬时速度•某个反应在一段时间内的平均速度可以用浓度图上的三角形来确定(直角三角形的斜边的斜率)•反应速度减少表示反应物是被消耗•速率表达式必须与化学计量数一致2A + B 3C瞬时速度的定义•反应物的消耗速度是-d[R]/dt•产物的形成速度是d[P]/dt平均速度•从图中看,平均速度是连接两点的斜率,为正值化学动力学•某个反应的速度与反应物的浓度相关•当反应物的浓度减少时,反应速度也减少•某个反应的速度与以下的参数有关:–反应物浓度–温度–催化剂的存在与浓度–固体、液体或催化剂的表面积•反应速度随浓度变化在数学上用实验速度规律来表示•反应物浓度以指数率上升,其乘积等于反应速度实验速度规律aA + bB →产物速度= -∆[A]/ t = k[A]m[B]n[C]p •[A] & [B] = 反应物浓度(M)•[C] = 催化剂浓度(M)•m, n, & p =指数(与化学反应中的系数无关)实验速度规律•由于化学计量方程没有给出反应机理的信息,指数就必须依靠实验来确定•分别来改变反应物的浓度来观察速度的变化•应用初始速度的方法; 观察随时间线性变化时的反应速度(瞬时速度= 平均速度); 通常在反应开始时•总的反应级数= 反应速度方程中指数之和Rxn级数可能的指数实验规律1 k[A]2 k[A]2 or k[A][B]3 k[A]2[B] or k[A][B][C]反应物与时间:一级反应•对一级反应,浓度可以由反应中给定的时间来确定•对数函数[A]t= 在t时刻组分A的浓度,M[A]o =组分A的初始浓度(t=0), Mk =一级速度常数, 1/时间t = 时间浓度与时间: 二级反应•对二级反应,反应中浓度随时间的变化•逆函数[A]t = 时刻t时组分A的浓度, M[A]o = 组分A的初始浓度,(t=0), Mk = 二级速度常数, 1/(M x t)t =时间总包反应与基元反应•一摩尔的燃料与a摩尔的氧化剂反应形成b摩尔的燃烧产物可用总包的反应机理来表示: •燃料消耗的速度可以表示为•式中, K G称为总包反应系数(g l o b a l r a t e c o e f f i c i e n t), 是温度的强函数. •n和m 与反应级数相关,对于总包反应,n 和m 不一定是整数.•对基元反应,反应级数一定是整数。
化学反应的速率常数化学反应是一种物质之间发生变化的过程,而反应速率常数则是描述反应速率快慢的物理量。
本文将介绍化学反应速率常数的定义、计算方法以及影响因素。
一、定义化学反应速率常数是指在一定条件下,当反应物浓度为单位摩尔/立方米时,单位时间内反应物消失或生成的摩尔数。
速率常数通常用符号k表示,其单位为mol/(L·s)。
二、计算方法化学反应速率常数的计算方法与反应的级数有关。
对于一级反应,速率常数可通过以下公式计算:k = (1/t) * ln(C0/Ct)其中,t为反应的时间,C0为初始反应物浓度,Ct为反应物浓度在任意时刻t的值。
对于二级反应,速率常数的计算方法则为:k = 1/(t * Ct)对于零级反应,速率常数的计算方法为:k = (-1/t) * ΔC三、影响因素化学反应速率常数受多个因素的影响,主要包括温度、浓度和催化剂。
1. 温度:根据阿伦尼乌斯方程,当温度升高1摄氏度时,速率常数会增加2到3倍。
因此,温度升高可以加快化学反应速率。
2. 浓度:反应物浓度的增加可以提高反应速率常数。
根据速率方程,反应速率与反应物浓度的指数关系有关,一般来说,浓度越高,反应速率越快。
3. 催化剂:催化剂可以降低化学反应的活化能,从而提高反应速率。
催化剂本身不参与反应,但能够提供新的反应路径,使得反应更容易进行。
四、实际应用化学反应速率常数在许多实际应用中起着重要作用。
例如,在化工生产中,通过研究反应速率常数可以确定合适的反应条件,提高产量和效率。
在制药领域,了解药物的反应速率常数可以指导药物的合成和研发。
此外,化学反应速率常数也对环境保护和能源利用等领域具有重要意义。
总结:化学反应速率常数是描述反应速率快慢的物理量,可以通过计算得到。
其值受温度、浓度和催化剂等因素的影响。
了解反应速率常数对于实际应用具有重要意义,可以指导化工生产和药物研发等领域的工作。
总的来说,化学反应速率常数是化学反应中一个重要的物理量,它描述了反应快慢的程度。
四年级上册寒假新启航科学第65页答案四年级上册寒假新启航科学第65页答案。
1. 组成大分子在自然界中,一些小分子可以经过化学反应结合成为大分子。
大分子一般具有较高的化学稳定性和物理性质稳定性,如聚乙烯、聚丙烯等。
这些大分子可以用于制造塑料、纤维和其他物品等。
2. 塑料和环保随着现代工业的不断发展,我们使用塑料制品越来越多,塑料污染也越来越严重。
因此,我们应该尽可能地减少使用塑料制品,使用环保袋、木质餐具、可降解塑料等代替传统的塑料制品。
3. 变态反应变态反应是指反应中某些反应物由于分子的排列位置等原因无法正常反应的情况。
为了避免产生变态反应,我们应该保证反应物质的质量纯度和反应条件的严格控制等。
4. 天然合成在自然界中,一些有机物质可以通过生命活动合成出来,如植物合成淀粉、动物合成蛋白质等。
这些天然合成的有机物质不仅具有很高的化学纯度,还具有很好的生物活性和生物可降解性。
5. 化学平衡化学反应不仅是反应物质向产物的变化,还包括产物向反应物质的变化。
当反应物质和产物达到一定比例时,化学反应会处于平衡状态,这种状态称为化学平衡。
6. 化学反应的速率化学反应速率是指单位时间内反应物质的消耗量或产物的生成量。
影响化学反应速率的因素有很多,如反应物质的浓度、温度、催化剂等。
7. 酸碱中和酸和碱在适当的条件下可以互相中和,形成水和盐。
中和反应是一种重要的化学反应,可以用于水处理、洗涤和制备化学试剂等。
8. 氧化还原反应氧化还原反应是指物质中的氧化剂与还原剂之间进行电荷转移的化学反应。
在这种反应中,氧化剂接受电子,还原剂释放电子,并同时发生氧化和还原的反应。
9. 化学分析化学分析是指采用化学方法将一个物质分解成其组成部分。
化学分析可以分为定量分析和定性分析两种,其中定量分析是测量物质中某种成分的含量,而定性分析则是确定物质中是否存在某种成分。
化学反应速率的速率方程化学反应速率描述了化学反应中物质转化的快慢程度,是研究化学动力学的重要内容之一。
反应速率方程是用来描述反应速率与物质浓度之间的关系的数学表达式。
本文将介绍化学反应速率以及速率方程的概念和相关内容。
一、化学反应速率的定义及意义化学反应速率(Reaction rate)是指化学反应物质转化的速度。
速率可以用反应物质浓度变化的快慢来表示,通常是指每单位时间内反应物浓度变化的量。
反应速率的大小直接影响着化学反应的进行程度以及反应物和产物的浓度变化情况。
二、速率方程的概念速率方程(Rate equation)是一种用数学表达式表示反应速率与反应物浓度之间关系的方程。
速率方程可以通过实验数据和化学反应机理来推导得到。
一般来说,反应速率方程是由各个反应物的浓度的幂函数决定。
例如,某一反应的速率方程可以表示为:v = k[A]^m[B]^n。
其中,v表示反应速率,k是反应速率常数,[A]和[B]分别表示反应物A和B的浓度,m和n分别是反应物A和B的反应级数。
三、速率常数的意义速率常数(Rate constant)是在给定温度下,各反应物浓度均为单位浓度条件下的速率。
速率常数是由实验测定的,它大小与反应机理、催化剂、温度等因素有关。
速率常数越大,反应速率越快。
四、速率方程的影响因素速率方程反映了反应速率与反应物浓度之间的关系,它与实际反应过程密切相关。
速率方程的形式和参数会受到以下因素的影响:1. 反应物浓度:反应速率一般与反应物浓度成正比关系,浓度越高,反应速率越快。
2. 温度:随着温度升高,反应物分子的平均动能增加,反应速率也随之增加。
3. 催化剂:催化剂的加入可以改变反应的速率常数,提高反应速率。
4. 反应机理:反应的分子碰撞和键的断裂、形成过程会影响反应速率。
五、速率方程的应用速率方程在化学工程、环境科学、生物学等领域具有重要的应用价值。
通过研究反应速率方程,可以了解反应过程中物质转化的机制和规律,为实际工业生产和环境保护提供理论基础和实践指导。