从含乙醇混合物中分离乙醛的方法
- 格式:pdf
- 大小:201.78 KB
- 文档页数:1
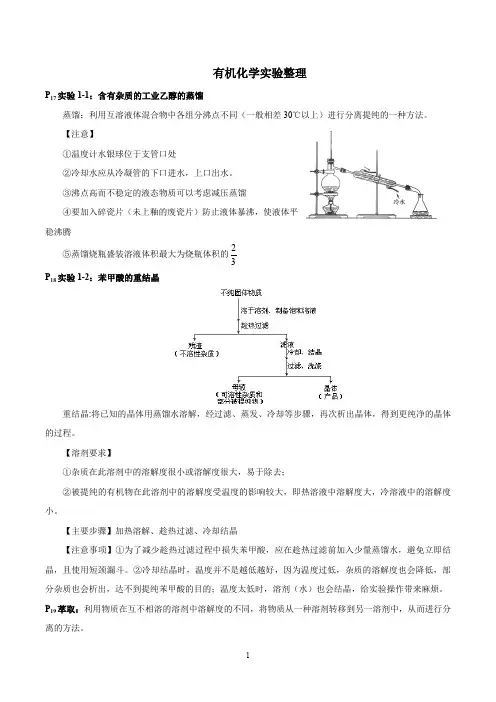
有机化学实验整理P17实验1-1:含有杂质的工业乙醇的蒸馏蒸馏:利用互溶液体混合物中各组分沸点不同(一般相差30℃以上)进行分离提纯的一种方法。
【注意】①温度计水银球位于支管口处②冷却水应从冷凝管的下口进水,上口出水。
③沸点高而不稳定的液态物质可以考虑减压蒸馏④要加入碎瓷片(未上釉的废瓷片)防止液体暴沸,使液体平稳沸腾2⑤蒸馏烧瓶盛装溶液体积最大为烧瓶体积的3P18实验1-2:苯甲酸的重结晶重结晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
【溶剂要求】①杂质在此溶剂中的溶解度很小或溶解度很大,易于除去;②被提纯的有机物在此溶剂中的溶解度受温度的影响较大,即热溶液中溶解度大,冷溶液中的溶解度小。
【主要步骤】加热溶解、趁热过滤、冷却结晶【注意事项】①为了减少趁热过滤过程中损失苯甲酸,应在趁热过滤前加入少量蒸馏水,避免立即结晶,且使用短颈漏斗。
②冷却结晶时,温度并不是越低越好,因为温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度太低时,溶剂(水)也会结晶,给实验操作带来麻烦。
P19萃取:利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一溶剂中,从而进行分离的方法。
1、萃取包括液—液萃取和固—液萃取。
2、常用的萃取剂有乙醚、石油醚、二氯甲烷、CCl 4等 注意:萃取剂的选择①萃取剂与原溶剂不互溶、不反应②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度 分液:常用于两种互不相溶的液体的分离和提纯。
P 32实验2-1:乙炔的实验室制取1、反应方程式:CaC 2+2H 2O→Ca(OH)2+C 2H 2↑2、注意事项:①电石与水反应非常剧烈,为减缓电石与水的反应速率,实验时常滴加饱和食盐水。
②因电石中往往含有杂质硫化钙,反应后产生H 2S ,H 2S 具有还原性,可使酸性KMnO 4溶液褪色,影响乙炔的性质检验,故用CuSO 4把H 2S 除去。

实验报告思考题一:乙醇氧化制乙醛1. 实验目的本实验旨在通过乙醇氧化制备乙醛,探讨乙醇氧化反应的条件和机理,以及提高产品收率和选择性的方法。
2. 实验原理乙醇氧化制备乙醛的反应方程式为:CH3CH2OH + [O] → CH3CHO + H2O乙醇在氧气气氛下发生部分氧化反应,生成乙醛和水。
反应需要催化剂的存在,并且温度、压力等条件对反应速率和产品选择性有显著影响。
3. 实验步骤此实验首先是收集所需试剂和设备,然后将乙醇和催化剂放入反应瓶中,向瓶中通入氧气气流,控制反应条件并收集生成的乙醛。
4. 实验结果和分析乙醇氧化制乙醛的实验结果可能受到催化剂种类和用量、氧气气流速率、反应温度等多种因素的影响。
对于催化剂的选择,硫酸、铬酸等均可作为催化剂,但对生成乙醛的收率和选择性有显著影响。
实验中,搭配合适的催化剂,并控制反应条件,可以获得较高的乙醛产率和纯度。
实验结果也需要分析可能存在的副产物和未反应物,以及产品的鉴定和定量分析。
5. 实验讨论乙醇氧化制备乙醛的实验涉及到多种氧化还原反应和有机化学知识,对反应条件和催化剂的选择、对产品的分离和纯化等都需要深入讨论。
在此基础上,可以进一步探讨该反应的工业应用和环境影响等方面的问题。
6. 总结与展望通过本实验的学习,我对乙醇氧化制乙醛的反应机理和条件要求有了更深入的了解。
在今后的学习和科研工作中,我将会积极应用所学知识,探索更高效的催化剂和反应条件,以提高有机合成的效率和可持续性。
7. 个人观点从本实验中,我深刻认识到反应条件和催化剂对有机合成反应的重要性。
在未来的科研工作中,我将不断探索新的反应条件和催化剂,以满足高产率、高选择性和可持续性的要求。
在本次文章中,我们通过对乙醇氧化制乙醛的实验报告思考题的深入探讨,对该反应的条件要求、机理和影响因素有了更全面的了解。
通过本次文章的阅读,读者可以更深入地理解乙醇氧化制乙醛的反应过程和相关知识,为今后的学习和科研工作提供参考。

研究有机化合物的一般步骤和方法—————————————————————————————————————[课标要求]1.了解研究有机化合物的一般步骤和方法。
2.初步学会分离提纯有机物的常规方法。
3.初步了解测定元素种类、含量以及相对分子质量的方法。
4.了解确定分子式的一般方法与过程以及根据特征结构和现代物理技术确定物质结构的方法。
1.研究有机化合物结构的基本步骤:分离、提纯→元素定量分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式2.采用蒸馏法可将沸点差大于30 ℃热稳定性强的有机混合物提纯。
3.利用萃取剂将有机物从另一种溶剂中提取出来的过程叫萃取。
4.质谱图中最大质荷比即为相对分子质量。
5.红外光谱测定有机物分子中的化学键或官能团。
6.核磁共振氢谱图中峰数即氢原子种类数,面积之比为各类氢原子个数之比。
有机物的分离与提纯1.研究有机化合物的一般步骤2.有机物的分离与提纯(1)蒸馏①用途:分离、提纯液态有机物。
③装置和主要仪器:(2)重结晶①用途:分离提纯固态有机物。
②原理:利用两种物质在同一溶剂中溶解度随温度的变化相差较大,采用冷却或蒸发将物质分离提纯。
③适用条件a.杂质在所选溶剂中溶解度很小或很大,易于除去。
b.被提纯的有机化合物在所选溶剂中的溶解度,受温度的影响较大。
该有机化合物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出。
④实验仪器与操作步骤:(3)萃取①原理:液-液萃取是利用有机化合物在两种互不相溶的溶剂里溶解度的不同,将有机化合物从一种溶剂转移到另一种溶剂的过程。
固-液萃取是用有机溶剂从固体物质中溶解出有机化合物的过程。
②适用条件:有机化合物与杂质在某种溶剂中的溶解度有较大差异。
③实验装置:④实验操作:加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。
[特别提醒] 选用萃取剂的三原则(1)萃取剂与原溶剂互不相溶。
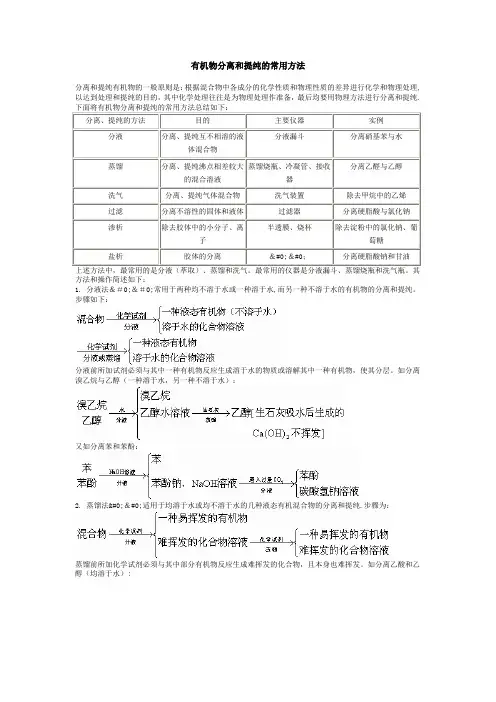
有机物分离和提纯的常用方法分离和提纯有机物的一般原则是:根据混合物中各成分的化学性质和物理性质的差异进行化学和物理处理,以达到处理和提纯的目的,其中化学处理往往是为物理处理作准备,最后均要用物理方法进行分离和提纯.下面将有机物分离和提纯的常用方法总结如下:分离、提纯的方法目的主要仪器实例分液分离、提纯互不相溶的液体混合物分液漏斗分离硝基苯与水蒸馏分离、提纯沸点相差较大的混合溶液蒸馏烧瓶、冷凝管、接收器分离乙醛与乙醇洗气分离、提纯气体混合物洗气装置除去甲烷中的乙烯过滤分离不溶性的固体和液体过滤器分离硬脂酸与氯化钠渗析除去胶体中的小分子、离子半透膜、烧杯除去淀粉中的氯化钠、葡萄糖盐析胶体的分离��分离硬脂酸钠和甘油上述方法中,最常用的是分液(萃取)、蒸馏和洗气。
最常用的仪器是分液漏斗、蒸馏烧瓶和洗气瓶。
其方法和操作简述如下:1. 分液法��常用于两种均不溶于水或一种溶于水,而另一种不溶于水的有机物的分离和提纯。
步骤如下:分液前所加试剂必须与其中一种有机物反应生成溶于水的物质或溶解其中一种有机物,使其分层。
如分离溴乙烷与乙醇(一种溶于水,另一种不溶于水):又如分离苯和苯酚:2. 蒸馏法��适用于均溶于水或均不溶于水的几种液态有机混合物的分离和提纯.步骤为:蒸馏前所加化学试剂必须与其中部分有机物反应生成难挥发的化合物,且本身也难挥发。
如分离乙酸和乙醇(均溶于水):3。
洗气法�;�适用于气体混合物的分离提纯.步骤为:例如:此外,蛋白质的提纯和分离,用渗析法;肥皂与甘油的分离,用盐析法。
有机物分离和提纯的常用方法 1,洗气 2,萃取分液溴苯(Br2),硝基苯(NO2),苯(苯酚),乙酸乙酯(乙酸) 3, a,制无水酒精:加新制生石灰蒸馏 b,酒精(羧酸)加新制生石灰(或NaOH固体)蒸馏 c,乙醚中混有乙醇:加Na,蒸馏 d,液态烃:分馏 4,渗析 a,蛋白质中含有Na2SO4 b,淀粉中KI 5,升华奈(NaCl)鉴别有机物的常用试剂所谓鉴别,就是根据给定的两种或两种以上的被检物质的性质,用物理方法或化学方法,通过必要的化学实验,根据产生的不同现象,把它们一一区别开来.有机物的鉴别主要是利用官能团的特征反应进行鉴别.鉴别有机物常用的试剂及特征反应有以下几种:1. 水适用于不溶于水,且密度不同的有机物的鉴别.例如:苯与硝基苯.2。

第1篇一、实验目的1. 了解乙醇分馏的原理和操作方法。
2. 掌握分馏实验的操作技能。
3. 学习通过分馏法从混合物中分离出乙醇。
4. 测定乙醇的沸点。
二、实验原理乙醇分馏是利用乙醇和水的沸点差异(乙醇沸点约为78.3℃,水沸点为100℃)来分离两者的过程。
在分馏过程中,混合物被加热至沸腾,低沸点的乙醇会先蒸发,然后通过冷凝管冷凝成液体收集,而水则留在烧瓶中。
三、实验仪器与试剂1. 仪器:圆底烧瓶、蒸馏头、温度计、冷凝管、接收瓶、酒精灯、冷凝水槽等。
2. 试剂:乙醇-水混合物。
四、实验步骤1. 准备工作:将乙醇-水混合物倒入圆底烧瓶中,加入几粒沸石以防止爆沸。
2. 装置连接:将圆底烧瓶与蒸馏头连接,蒸馏头与温度计连接,温度计的水银球置于蒸馏头支管口处,蒸馏头与冷凝管连接,冷凝管末端插入冷凝水槽中。
3. 加热:用酒精灯加热圆底烧瓶,注意观察温度计的读数,当温度升至78℃时,开始收集馏分。
4. 收集馏分:将接收瓶置于冷凝管末端,收集温度在78℃左右的馏分。
5. 实验结束:收集完毕后,关闭酒精灯,拆除装置。
五、实验结果与分析1. 馏分收集:在实验过程中,收集到一定量的无色透明液体,初步判断为乙醇。
2. 馏分沸点:通过温度计的读数,确定收集到的馏分沸点在78℃左右,与乙醇沸点相符。
3. 实验分析:通过分馏实验,成功从乙醇-水混合物中分离出乙醇,证明了分馏法在分离沸点相近物质中的有效性。
六、实验讨论1. 影响分馏效果的因素:分馏效果受多种因素影响,如加热速度、温度计位置、回流比等。
加热速度过快会导致分馏效果变差,温度计位置不准确会影响馏分的沸点,回流比过大或过小也会影响分馏效果。
2. 实验误差分析:本实验中,由于温度控制不够严格,可能导致乙醇沸点存在一定偏差。
此外,实验过程中可能存在一定的理论误差,如分馏柱的效率、冷凝管冷却效果等。
七、实验结论1. 乙醇分馏是一种有效的分离沸点相近物质的方法。
2. 通过分馏实验,成功从乙醇-水混合物中分离出乙醇,证明了分馏法在分离沸点相近物质中的有效性。

实验室中常⽤的有机溶剂的纯化⽅法1.⼄酸⼄酯市售的⼄酸⼄酯常含有微量⽔、⼄醇和⼄酸。
可先⽤等体积的5%碳酸钠溶液洗涤,再⽤饱和氯化钙溶液洗涤,酯层倒⼊⼲燥的锥形瓶中,加⼊适量⽆⽔碳酸钾⼲燥1h后,蒸馏,收集77.0。
77.5℃馏分。
2.⽯油醚⽯油醚是低级烷烃的混合物。
根据沸程范围不同可分为30~60℃、60~90℃和90~120℃等不同规格。
⽯油醚中常含有少量沸点与烷烃相近的不饱和烃,难以⽤蒸馏法进⾏分离,此时可⽤浓硫酸和⾼锰酸钾将其除去。
⽅法如下。
在150mL分液漏⽃中,加⼊100mL⽯油醚,⽤10mL浓硫酸分两次洗涤,再⽤10%硫酸与⾼锰酸钾配制的饱和溶液洗涤,直⾄⽔层中紫⾊不再消失为⽌。
⽤蒸馏⽔洗涤两次后,将⽯油醚倒⼊⼲燥的锥形瓶中,加⼊⽆⽔氯化钙⼲燥lh。
蒸馏,收集需要规格的馏分。
3.氯仿普通氯仿中含有1%⼄醇(这是为防⽌氯仿分解为有毒的光⽓,作为稳定剂加进去的)。
除去⼄醇的⽅法是⽤⽔洗涤氯仿5~6次后,将分出的氯仿⽤⽆⽔氯化钙⼲燥24h,再进⾏蒸馏,收集60.5~61.5℃馏分。
纯品应装在棕⾊瓶内,置于暗处避光保存。
4.苯普通苯中可能含有少量噻吩,除去的⽅法是⽤少量(约为苯体积的15%)浓硫酸洗涤数次,再分别⽤⽔、10%碳酸钠溶液和⽔洗涤。
分离出苯,置于锥形瓶中,⽤⽆⽔氯化钙⼲燥24h后,⽔浴加热蒸馏,收集79.5~80.5℃馏分。
在有机化学实验中,经常使⽤各类溶剂作为反应介质或⽤来分离提纯粗产物。
由于反应的特点和物质的性质不同,对溶剂规格的要求也不相同。
有些反应(如格⽒试剂的制备反应)对溶剂的要求较⾼,即使微量杂质或⽔分的存在,也会影响实验的正常进⾏。
这种情况下,就需对溶剂进⾏纯化处理,以满⾜实验的正常要求。
这⾥介绍⼏种实验室中常⽤的有机溶剂的纯化⽅法。
5.⽆⽔⼄醚市售⼄醚中常含有微量⽔、⼄醇和其他杂质,不能满⾜⽆⽔实验的要求。
可⽤下述⽅法进⾏处理,制得⽆⽔⼄醚。
在250mL⼲燥的圆底烧瓶中,加⼊100mL⼄醚和⼏粒沸⽯,装上回流冷凝管。
有机实验习题答案(总7页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--有机实验习题答案实验1 常压蒸馏1.为什么蒸馏瓶所盛液体的量一般不超过容积的2/3,也不少于1/3(多于2/3,易溅出;少于1/3,相对多的蒸汽残留在烧瓶中,收率低)2.温度计水银球应处于怎样的位置才能准确测定液体的沸点,画出示意图;水银球位置的高低对温度读数有什么影响(参见图2-2,温度计水银球处于气液平衡的位置。
位置高,水银球不易充分被馏出液润湿,沸点偏低,位置低,直接感受热源的温度,结果偏高。
)3.为什么蒸馏时最好控制馏出液的速度为1~2 滴/秒(保持气液平衡)4.如果加热后发现未加沸石,应如何处理如果因故中途停止蒸馏,重新蒸馏时,应注意什么(停止加热,稍冷,再补加沸石。
重新蒸馏时,一定要补加沸石,原来的沸石表面的空隙已充满液体而失效)5.如果某液体具有恒定的沸点,能否认为该液体一定是纯净的物质你提纯得到的乙醇是纯净物吗(不一定,可能是恒沸物;蒸馏得到的乙醇不是纯净物,是恒沸物,参见附录5)6.在蒸馏过程中,火大小不变,为什么蒸了一段时间后,温度计的读数会突然下降这意味着什么(瓶中的蒸气量不够,意味着应停止蒸馏或者某一较低沸点的组分已蒸完。
)7.蒸馏低沸点或易燃液体时,应如何防止着火(严禁用明火加热。
收集瓶中的蒸气应用橡皮管引入桌下、水槽或室外。
参见P50 图2-3)实验2 水蒸气蒸馏1.应用水蒸气蒸馏的化合物必须具有哪些条件水蒸气蒸馏适用哪些情况(参见“二)2.指出下列各组混合物能否采用水蒸气蒸馏法进行分离。
为什么(1)乙二醇和水;(2)对二氯苯和水(对二氯苯和水可以用水蒸气蒸馏分开)3.为什么水蒸气蒸馏温度总是低于100℃(因当混合物中各组分的蒸气压总和等于外界大气压时,混合物开始沸腾)4.简述水蒸气蒸馏操作程序。
(当气从T形管冲出时,先通冷凝水,再将螺旋夹G夹紧,使水蒸气通入D,参见图2-7;结束时,先打开螺旋夹G使体系和大气相通,方可停止加热)。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
一、常用的去除杂质的方法10种(1)杂质转化法欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为酚钠,利用酚钠易溶于水,使之与苯分开。
欲除去Na2CO3中的NaHCO3可用加热的方法。
(2)吸收洗涤法欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠的溶液后,再通过浓硫酸。
(3)沉淀过滤法欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入过量铁粉,待充分反应后,过滤除去不溶物,达到目的。
(4)加热升华法欲除去碘中的沙子,可采用此法。
(5)溶剂萃取法。
欲除去水中含有的少量溴,可采用此法。
(6)溶液结晶法(结晶和重结晶)欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,得到硝酸钠纯品。
(7)分馏蒸馏法欲除去乙醚中少量的酒精,可采用多次蒸馏的方法。
(8)分馏法欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离。
(9)渗析法欲除去胶体中的离子,可采用此法。
如除去氢氧化铁胶体中的氯离子。
(10)综合法。
欲除去某物质中的杂质,可采用以上各种方法或多种方法综合运用。
另:物质中杂质的一般去除方法1.把杂质转化为沉淀除去,如NaN03(NaCl)加入硝酸银溶液2.把杂质转化为气体除去,如NaCl (NaN03)加入稀盐酸3.加热法:如CaO(CaC03)4.吸收法:如CO(C02)通过澄清石灰水而除去C02N2(02)通过灼热的铜网而除去025.置换法:FeS04(CuS0) 4 加入铁粉与(CuS0) 4反应而除去。
Ag粉(Cu粉) 中加AgN0 3溶液与Cu反应而除去。
6.溶解法:如Mn02(KCl03 )溶于水,过滤,得较纯的Mn02固体练习1、除去下列各组物质中的杂质,A、Na2C03溶液NaOH通入适量二氧化碳B、CO气体C02通过灼热的氧化铜C、HN03溶液HClAgN0 3溶液,过滤D、Cu(OH) 2固体CuCl 2加入适量稀盐酸2、用方程式表示除去下列物质中的杂质(括号里的物质是杂质)(1)KN03 (KCl)(2)NaOH(Na2C03)(3)NaCl(NH4 Cl)(4)HN03(H2SO4)二、常见物质分离提纯的10种方法(1)结晶和重结晶利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3。
混合物的化学分离和提纯方法归纳混合物的化学分离和提纯方法归纳物质的分离是指将混合物中的不同物质分开,而且各物质还要保持原来的化学成分和物理状态;物质的提纯是指将混合物净化除去其杂质,得到混合物中的主体物质,提纯后的杂质不必考虑其化学成分和物理状态。
混合物的分离方法有许多种,但根据其分离的本质可分为两大类,一类是化学分离法,另一类就是物理法,一般情况下,利用物理方法无法分离的混合物,就考虑利用化学方法分离,下面就混合物的化学分离和提纯方法归纳如下:一、分离和提纯的原则:1.引入的试剂一般只跟杂质反应。
2.后续的试剂应除去过量的前加的试剂。
3.不能引进新物质。
4.杂质与试剂反应生成的物质易与被提纯物质分离。
5.过程简单,现象明显,纯度要高。
6.尽可能将杂质转化为所需物质。
7.除去多种杂质时要考虑加入试剂的合理顺序。
8.如遇到极易溶于水的气体时,要防止倒吸现象的发生。
二、分离和提纯常用的化学方法:1.加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。
如NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。
2.沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。
使用该方法一定要注意不能引入新的杂质。
若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂的过量部分除去,最后加的试剂不引入新的杂质。
如加适量的BaCl2溶液可除去NaCl中混有的Na2SO4;再如NaCl溶液中混有MgCl2、CaCl2杂质,可先加入过量的NaOH,使Mg2+转化为Mg(OH)2沉淀而除去(同时引入了OH-杂质);然后加入过量的Na2CO3,使Ca2+转化为CaCO3沉淀而除去(同时引入了CO32-杂质);最后加入足量的盐酸,并加热除去OH-及CO32-(加热的目的是赶走溶液中存在的CO2及HCl),并调节溶液的pH至中性。
3.酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。
2016年第12期
文献摘要
乙醛醋酸化工
合成气制烷醇的方法
本发明关注制烷醇的过程,尤其是甲醇包含
CO 和H 2的混合物反应,压力大约3.45MPa 或更大、温度至少150℃,含有钌化合物和铑或锰化合
物,季磷盐或氨碱或盐,含氧溶剂的惰性条件。
LIN JIANG-JEN (TW )
US42733482A
醋酸、醋酸甲酯和醋酸酐的联产方法一种由甲醇和一氧化羰基制备醋酸、醋酸甲酯和醋酸酐,或者选择其中一种产品的联产方法。
有
H2、铑催化剂和含卤助催化剂时,在第一个羰基化
反应器中甲醇气相羰基化生产醋酸和醋酸甲酯。
从反应混合物中收集醋酸,同时分离出醋酸甲酯和助催化剂。
经过冷凝分离器回收分离出的甲醇,然后和助催化剂、一氧化碳一起进入第二个羰基化反应器;
用工业冰醋酸生产药用冰醋酸的方法本发明公开了一种用工业冰醋酸生产药用冰醋酸的方法,包括以下步骤:(i)过滤;(ⅱ)精馏;(ⅲ)收集轻物质;(ⅳ)收集冰醋酸;(ⅴ)收集重物质;本发明所提供的方法利用塔板理论将原料中的轻物质、重物质和产品同时实现分离,通过原料泵将经过过滤的工业冰醋酸加入到精馏塔中,在不同的塔板数值处,分别设置产品采集口和原料添加口。
本发明工艺简单,操作方便,在一个塔体中完成了原料添加、轻物质收集、产品收集、重物质收集四个工序,实现了连续化生产,提高了工作效率。
CN102746137A
国外文献摘要
含能助燃催化剂及其应用
本发明涉及一种含能助燃催化剂。
所述含能助燃催化剂主要由以下质量份数比的组分构成:杂醇油25-28份、乙醇14-18份、四氢化萘16-20份、环戊醇14-16份、巴豆醛18-22份、2-吡咯烷酮1-2份、纳米氧化稀土1.5-3份和含能笼型硼化物或其衍生物2-3份。
本发明的含能助燃催化剂可以应用在液体、气体的烷烃燃料中,形成含能复合燃料,提升燃料的热效能,有效替代乙炔,用于金属火焰焊割,提高燃气锅炉、窑炉的热利用率。
本发明节能效率明显,在金属火焰焊割工艺上,节约燃料达到30%以上,节约氧气达到20%以上;而且使用安全,与乙炔相比,不易回火,使用安全可靠。
CN102585936A
一种甲酸和醋酸联产的生产方法
本发明涉及一种甲酸和醋酸联产的生产方法。
该方法是在甲醇羰化法合成醋酸的基础上,引入原料甲酸甲酯,在含有液体组合物的羰基化反应釜中通过酯交换和羰基化反应实现甲酸和醋酸的联产。
所述的液体反应组合物包括:铑或铱羰基化主催化剂或两者的混和物、碘甲烷助催化剂、醋酸、甲酸、甲酸甲酯、醋酸甲酯、水、以及金属盐促进剂。
本发明
从含乙醇混合物中分离乙醛的方法从乙酸加氢得到的粗乙醇产物中纯化和/或回收乙醇。
粗乙醇进行分离和纯化回收乙醇,同时除去杂质。
具体地,在高于大气压的压力下操作,乙醛去除塔中分离轻馏分返回到反应器中,降低乙酸乙酯流中的乙醛浓度。
WARNER JAY R?;?WEINER HEIKO;BOWER
NATHAN;etc
PCT/US2011/035577
将甲酸甲酯和甲醇一起引入到羰基化反应釜中来生成甲酸和醋酸,并且通过调变甲酸甲酯和甲醇的加入量,来调节甲酸和醋酸的产量,从而省去了原有甲酸甲酯水解制甲酸工艺中的水解单元和后续甲醇分离回收工艺单元。
CN102001929A
53-
-。