物质的分类及转化(2课时)
- 格式:doc
- 大小:43.00 KB
- 文档页数:6


《物质的分类及转化》教案核心素养宏观辨识与微观探析:从宏观上学习对物质的分类,从微观上辨析酸碱性的本质证据推理与模型认知:建立物质分类的基本模型,理解通过对物质的分类来研究物质性质的基本方法科学探究与创新意识:掌握分类的方法,初步建立物质分类的科学思想,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对物质分类过程和分类应用的理解,体会掌握科学方法就能够有效提高学习效率和效果,建立高效学习的科学精神。
过重点难点酸、碱、盐的化学性质;物质转化的规律。
教学过程一、导入新课【教师】上节课我们学习了物质的分类。
自然界的物质可分为混合物和纯净物。
纯净物又可根据元素的数量可分为单质和化合物。
单质可以分为金属单质和非金属单质;化合物可以分为氧化物、酸、碱和盐。
【投影】【教师】根据物质的分类,可以认识物质的性质以及物质之间的转化关系,从而制备人类生活和生产需要的新物质。
二、讲授新课(一)酸、碱、盐的性质【教师】有句成语,物以类聚,人以群分。
有句俗话,不是一家人不进一家门。
同类物质就是一家人,具有许多共性。
因此可以通过物质所属类别,推测其具有的性质,举一反三。
例如SO2和CO2同为酸性氧化物,可根据CO2的性质,推测SO2具有的性质【板书】1、酸性氧化物的性质【投影】①与水反应SO2+H2O===H2SO3;②与碱性氧化物反应SO2+Na2O===Na2SO3;③与碱性反应SO2+2NaOH===Na2SO3+H2O。
【互动】推断碱性氧化物CaO的主要化学性质,并举反应实例【提示】CaO为碱性氧化物,与酸性氧化物对应【教师】同类物质之所以同类,是因为具有一些相同的性质,如盐酸、硫酸等酸具有一些酸的通性。
【板书】2.酸的通性【投影】①酸可以与活泼金属反应②酸可以与碱性氧化物反应③酸可以与碱反应④酸可以与某些盐反应注意:“酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物。
【互动】根据酸的主要化学性质,举些反应实例【投影】酸的分类【教师】同样,碱类物质也具有一些通性 【板书】3.碱的通性【投影】①碱可以与非金属氧化物反应②碱可以与酸反应 ③碱可以与某些盐反应④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应注意:“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物。


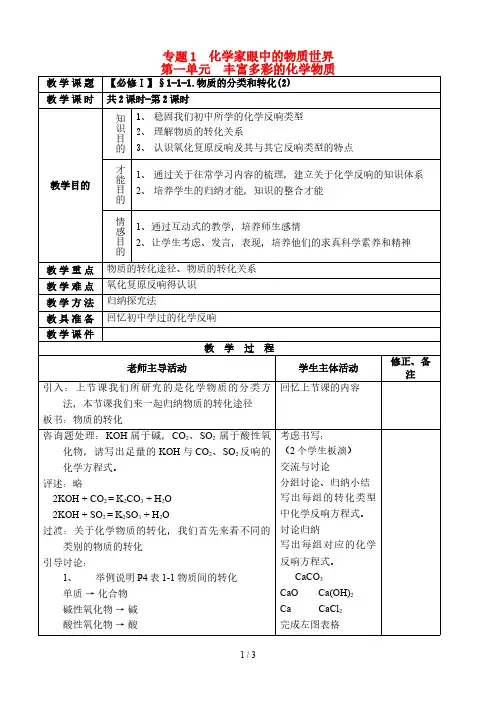
专题1 化学家眼中的物质世界第一单元 丰富多彩的化学物质教学课题【必修Ⅰ】§1-1-1.物质的分类和转化(2)教学课时共2课时-第2课时教学目的知识目的1、稳固我们初中所学的化学反响类型2、理解物质的转化关系3、认识氧化复原反响及其与其它反响类型的特点才能目的1、通过关于往常学习内容的梳理,建立关于化学反响的知识体系2、培养学生的归纳才能,知识的整合才能情感目的1、通过互动式的教学,培养师生感情2、让学生考虑、发言,表现,培养他们的求真科学素养和精神教学重点物质的转化途径、物质的转化关系教学难点氧化复原反响得认识教学方法归纳探究法教具准备回忆初中学过的化学反响教学课件教学过程老师主导活动学生主体活动修正、备注引入:上节课我们所研究的是化学物质的分类方法,本节课我们来一起归纳物质的转化途径板书:物质的转化回忆上节课的内容咨询题处理:KOH属于碱,CO2、SO2属于酸性氧化物,请写出足量的KOH与CO2、SO2反响的化学方程式。
评述:略2KOH + CO2 = K2CO3 + H2O2KOH + SO2 = K2SO3 + H2O过渡:关于化学物质的转化,我们首先来看不同的类别的物质的转化引导讨论:1、举例说明P4表1-1物质间的转化单质→化合物碱性氧化物→碱酸性氧化物→酸考虑书写:(2个学生板演)交流与讨论分组讨论、归纳小结写出每组的转化类型中化学反响方程式。
讨论归纳写出每组对应的化学反响方程式。
CaCO3CaO Ca(OH)2Ca CaCl2完成左图表格Fe + CuSO4 = Cu + FeSO4请大家分析,该反响中哪些元素的化合价发生了变化。
给出:二、氧化复原反响:但凡有元素的化合价发生变化的反响即为氧化复原反响。
非氧化复原反响:但凡化学反响中元素的化合价没有发生变化的化学反响即为非氧化复原反响。
组织交流讨论:教材P6 交流与讨论归纳:氧化复原反响:1、2非氧化复原反响:3、4氧化复原反响与四类根本反响类型的关系:阅读介绍:化学史话---无机化合物转化为有机化合物给的化学反响哪些属于氧化复原反响,哪些是非氧化复原反响。

(2)与碱反应生成新盐与新碱。
如氯化铜溶液与氢氧化钠溶液反应的化学方程式为CuCl 2+2NaOH===2NaCl +Cu(OH)2↓(3)与盐反应,如氯化钠溶液与硝酸银溶液反应的化学方程式为NaCl +AgNO 3===AgCl↓+NaNO 3 【易错提醒】(1)盐的构成中不一定仅有金属阳离子和酸根阴离子,如NH 4Cl ,非金属元素可形成阳离子NH +4。
(2)酸根离子中不一定只有非金属元素,如MnO -4。
二、物质的转化根据物质的组成和性质,通过化学变化可以实现物质之间的转化。
在化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化时最基本的依据。
单质、氧化物、酸、碱、盐之间的相互转化1.单质及其化合物的转化(1)金属单质及其化合物的转化:如:Na ――→O 2 Na 2O ――→H 2O NaOH ――→H 2SO 4Na 2SO 4 Ca ――→O 2 CaO ――→H 2O Ca(OH)2 ――→H 2SO 4CaSO 4 试写出Ca 的相关反应方程式并注明反应类型:2Ca +O 2===2CaO ; 化合反应 CaO +H 2O===Ca(OH)2; 化合反应 Ca(OH)2+Na 2CO 3===CaCO 3↓+2NaOH ; 复分解反应 【归纳总结】金属单质 ――→O 2 碱性氧化物 ――→H 2O 碱 ————————→酸或酸性氧化物盐符合上述转化关系的常见金属有Na 、K 、Ba 、Ca 等,但Mg 、Fe 、Al 、Cu 不符合上述转化关系。
(2)非金属单质及其化合物的转化:如:C ――→O 2 CO 2 ――→H 2O H 2CO 3 ――→NaOHNa 2CO 3 S ――→O 2 SO 2 ――→H 2O H 2SO 3 ――→NaOHNa 2SO 3 试写出C 的相关反应方程式并注明反应类型:C +O 2=====点燃CO 2; 化合反应 CO 2+H 2O===H 2CO 3; 化合反应 H 2CO 3+Ca(OH)2===CaCO 3↓+2H 2O ; 复分解反应 【归纳总结】(1)非金属单质 ――→O 2 酸性氧化物 ――→H 2O 酸 ————————→碱或碱性氧化物盐 符合上述转化关系的常见非金属有C 、S 、P 等,但N 、Si 等不符合上述转化关系。




《物质的分类及转化》教案核心素养宏观辨识与微观探析:从宏观上学习对物质的分类,从微观上辨析酸碱性的本质证据推理与模型认知:建立物质分类的基本模型,理解通过对物质的分类来研究物质性质的基本方法科学探究与创新意识:掌握分类的方法,初步建立物质分类的科学思想,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对物质分类过程和分类应用的理解,体会掌握科学方法就能够有效提高学习效率和效果,建立高效学习的科学精神。
过重点难点酸、碱、盐的化学性质;物质转化的规律。
教学过程一、导入新课【教师】上节课我们学习了物质的分类。
自然界的物质可分为混合物和纯净物。
纯净物又可根据元素的数量可分为单质和化合物。
单质可以分为金属单质和非金属单质;化合物可以分为氧化物、酸、碱和盐。
【投影】【教师】根据物质的分类,可以认识物质的性质以及物质之间的转化关系,从而制备人类生活和生产需要的新物质。
二、讲授新课(一)酸、碱、盐的性质【教师】有句成语,物以类聚,人以群分。
有句俗话,不是一家人不进一家门。
同类物质就是一家人,具有许多共性。
因此可以通过物质所属类别,推测其具有的性质,举一反三。
例如SO2和CO2同为酸性氧化物,可根据CO2的性质,推测SO2具有的性质【板书】1、酸性氧化物的性质【投影】①与水反应SO2+H2O===H2SO3;②与碱性氧化物反应SO2+Na2O===Na2SO3;③与碱性反应SO2+2NaOH===Na2SO3+H2O。
【互动】推断碱性氧化物CaO的主要化学性质,并举反应实例【提示】CaO为碱性氧化物,与酸性氧化物对应【教师】同类物质之所以同类,是因为具有一些相同的性质,如盐酸、硫酸等酸具有一些酸的通性。
【板书】2.酸的通性【投影】①酸可以与活泼金属反应②酸可以与碱性氧化物反应③酸可以与碱反应④酸可以与某些盐反应注意:“酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物。
【互动】根据酸的主要化学性质,举些反应实例【投影】酸的分类【教师】同样,碱类物质也具有一些通性 【板书】3.碱的通性【投影】①碱可以与非金属氧化物反应②碱可以与酸反应 ③碱可以与某些盐反应④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应注意:“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物。
高中化学第一节物质的分类及转化(二)题目及参考答案1.下列各组物质中,按化合物、单质、混合物顺序排列的一组是()A.烧碱、液氯、Fe(OH)3胶体B.生铁、纯碱、熟石灰C.干冰、铁、氯化氢D.空气、氮气、苏打2.下列物质分类正确的是()酸碱盐碱性氧化物酸性氧化物A 硫酸烧碱氯化钠氧化镁干冰B 硝酸熟石灰硫酸铜一氧化碳二氧化硫C 醋酸氢氧化钾纯碱生石灰氧化铜D 乙醇氢氧化钠氯化铜氨气氧化钠3.酸式盐是盐的一种,可看作多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。
已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是()A.H3PO2属于二元酸B.H3PO2属于三元酸C.NaH2PO2属于酸式盐D.NaH2PO2属于正盐4.医学上对血液中毒最常用的净化手段是血液透析。
透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。
血液中的蛋白质和血细胞不能通过透析膜,血液内的毒性物质则可以透过,由此可以判断()A.蛋白质、血细胞不溶于水,毒性物质可溶于水B.蛋白质以分子形式存在,毒性物质以离子形式存在C.蛋白质、血细胞不能透过滤纸,毒性物质能透过滤纸D.蛋白质、血细胞的粒子直径大于毒性物质的粒子直径5.科学家用某有机分子和球形笼状分子C60制成了“纳米车”,每辆“纳米车”由一个有机分子和4个C60分子构成,直径约为9纳米。
“纳米车”可以用来运输单个有机分子。
下列说法正确的是()A.人们用肉眼可以清晰看到“纳米车”的运动B.C60是一种新型的化合物C.用激光笔照射该物质分散在蒸馏水中形成的分散系,光线通过时出现明亮的光路D.“纳米车”是胶体6.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m、分子式为C32H16N8Co)恢复了磁性。
“钴酞菁”的分子结构和性质与人体的血红素、植物体内的叶绿素非常相似。
第一章物质及其变化
第一节物质的分类及转化教学设计
杨宇
Ca→CaO→Ca(OH)2→CaSO4
C→CO2→H2CO3→CaCO3
【总结】
金属单质碱性氧化物碱
盐
非金属单质酸性氧化物酸
盐
【拓展】以钠元素和硫元素为例完成下图的转化关系。
三、物质间转化的应用
1)物质的制备:从上述转化关系我们可以找到制备某种物质的可能方法。
①酸的制备:酸性氧化物与水反应、盐与另一种酸反应
②碱的制备:碱性氧化物与水反应、盐与另一种碱反应
③盐的制备:金属单质与非金属单质反应、酸性氧化物与碱性氧化物反应、盐与盐反应、酸与盐反应、碱与盐反应
2)工业上物质的制备方法选择因素:要从反应的可此图是物质转化规律的集中体现,也是重要的工具,可用于深入理解物质类别与各类物质之间转化的关系,也可用于设计物质转化的路径。
第1节物质的分类及转化(第二课时)本节教学内容是人教版高中化学必修第一册第一章《化学物质及其变化》第一节《物质的分类及转化》的第二课时。
该部分的教学内容是该节第一课时——物质的分类的进一步延续,学生在第一课时中已经掌握了物质分类的基本思路和方法,能够利用基本分类法对化学物质进行科学分类。
第二课时将在学生掌握的分类方法的基础上,从分类的角度出发,研究物质转化之间的关系和内在规律,梳理初中化学知识,将初中的元素化合物知识规律化系统化,为高中的化学学习打下坚实的基础。
宏观辨识与微观探析:从宏观上复习物质的分类,理解同一类物质的化学性质的相似性;从微观上体会同一类别物质的化学性质的相似性是由其含有相同微观粒子决定的。
科学探究与创新意识:通过学习探究,先对物质进行分类,再统一研究同一类物质的化学性质的相似性,体会物质之间的转化规律,理解化学研究过程中的科学方法。
科学精神与社会责任:通过对物质分类与转化的理解,体会在化学学习中掌握科学方法的重要性,建立高效学习的科学精神。
掌握酸碱盐等物质的基本转化规律,建立物质转化的基本思想。
学生复习初中化学中元素化合物的知识,预习本课内容;教师准备多媒体课件。
【引入】在上一节课中同学们已经学习了一种重要的科学方法——分类,同学们已经掌握了如何对化学物质进行分类,这节课我们要来体会一下,分类的优点到底是什么,在高中化学的学习中我们应该如何应用分类来促进自己的学习。
【板书】物质的转化【讲解】在上一节课的学习中,同学们学习了按照一定的标准对化学物质进行分类,尤其按照物质的组成和性质进行分类时,同一类的化学物质在性质上应该具有一定的相似性。
例如,按照氧化物的性质我们可以分出的类别是:酸性氧化物和碱性氧化物。
【设疑】酸性氧化物和碱性氧化物各自应该具有什么性质呢?【学生回答】酸性氧化物与碱反应只生成盐和水,碱性氧化物与酸反应只生成盐和水。
【讲解】这样我们就可以得出只要是酸性氧化物或者碱性氧化物就可以与碱或者酸反应生成盐和水的结论,对于我们不熟悉的酸性或者碱性氧化物,我们也可以判断其与碱或者酸反应的化学反应方程式。