高三化学(苏教版)总复习 专题4 专题概括整合
- 格式:ppt
- 大小:1.65 MB
- 文档页数:20


第四单元 金属的冶炼、铜及其化合物1.合金提醒:(1)常温下,多数合金是固体,但钠钾合金是液体;(2)成分金属与合金的物理性质相比有所改变,但合金中各成分金属的化学性质仍然不变;(3)并非所有的金属都能形成合金。
因为两种金属必须熔合在一起才能形成合金。
如果一种金属还未熔化时,另一种金属已经汽化,则一般不能熔合在一起,如Cu 与Na 、Fe 与Na 等不能形成合金。
2.铜的制备与精炼工业上主要采用高温冶炼黄铜矿(主要成分是CuFeS 2)的方法获得铜。
用这种方法冶炼得到的铜,含铜量为99.5%~99.7%,还含有Ag 、Au 、Fe 、Zn 等杂质。
要达到电气工业生产用铜的要求,这种由黄铜矿高温冶炼得到的铜还必须经过电解精炼,电解精炼得到的铜,含铜量高达99.95%~99.98%。
3.金属的冶炼(1)金属冶炼的实质 使金属化合物中的金属离子得电子被还原为金属单质的过程:M n ++n e -===M 。
(2)常见冶炼方法①电解法——K ~AlNa :2NaCl(熔融)=====通电2Na +Cl 2↑;Mg :MgCl 2(熔融)=====通电Mg +Cl 2↑;Al :2Al 2O 3(熔融)=====通电4Al +3O 2↑。
②热还原法——Zn ~Cu高炉炼铁:3CO +Fe 2O 3=====△2Fe +3CO 2;铝热反应制铬:2Al +Cr 2O 3=====高温2Cr +Al 2O 3;焦炭还原铜:C +2CuO=====△2Cu +CO 2↑。
③热分解法——Hg 、AgHg :2HgO=====△2Hg +O 2↑;Ag :2Ag 2O=====△4Ag +O 2↑。
注意:有些活动性很强的金属也可以用还原法来冶炼,如Na +KCl =====850 ℃K ↑+NaCl 、2RbCl +Mg =====700~800 ℃MgCl 2+2Rb ↑等,在此主要运用了化学平衡移动原理,利用K 、Rb 沸点低,汽化离开反应体系,使化学反应得以向正反应方向进行。




高三化学知识点总结苏教版高三化学知识点总结(苏教版)化学是一门关于物质的科学,它研究的是物质的组成、结构、性质、变化规律等。
高中化学是学生对中学化学知识的巩固和拓展,也是进一步培养学生科学思维和实验能力的重要阶段。
本文将针对苏教版高三化学教材中的重点知识点进行总结。
一、物质的构成和分类1. 元素和化合物元素是指由相同类型的原子组成的物质,化合物是由两个或多个不同元素的原子化学组合而成的物质。
2. 原子结构原子由质子、中子和电子组成,其中质子和中子位于原子核中,电子围绕原子核运动。
3. 元素周期表元素周期表是对元素按照原子序数递增的顺序进行排列,按照化学性质的不同分为周期和族。
4. 化学键的形成化学键是原子之间由于电子的共享或转移而形成的。
二、化学方程式和化学计量1. 化学方程式化学方程式用化学符号和化学式表示化学反应的过程和物质的变化。
2. 化学计量化学计量是研究反应物和生成物在化学反应中的质量和量之间的关系。
三、化学反应原理1. 化学反应速率化学反应速率是指单位时间内反应物消失或生成物形成的量。
2. 化学平衡化学平衡是指在封闭容器中反应物与生成物的浓度保持不变的状态。
3. 平衡常数和平衡常数表达式平衡常数描述了反应物和生成物之间的浓度关系,在不同温度下具有不同的数值。
四、物质的组成和性质1. 氧化还原反应氧化还原反应是通过电子的转移而引起的化学反应,其中氧化剂接受电子,还原剂给出电子。
2. 酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
3. 可溶性和溶解度可溶性是指物质在特定条件下能否与溶剂形成均匀混合物的性质,溶解度是指在一定温度下能溶解在溶剂中的最大量物质。
五、化学能与化学反应1. 化学反应的焓变化学反应的焓变描述了反应过程中放出或吸收的热量变化。
2. 反应熵变和自由能变反应熵变和自由能变是描述了反应过程中熵的变化和系统能量利用情况的指标。
3. 电化学反应电化学反应是指通过电子转移产生电流的化学反应,包括电解和电池反应。

苏教版高三化学知识点化学是一门研究物质组成、结构、性质以及变化规律的科学。
作为一门基础学科,化学为其他学科的发展和应用做出了巨大贡献。
在高三化学学习中,苏教版是一种常用的教材版本。
本文将介绍苏教版高三化学中的几个重要知识点。
一、化学方程式和化学计量法化学方程式是用来描述化学反应的符号表示法。
它由反应物和生成物之间的化学式以及反应条件组成。
化学方程式能够提供有关反应物质的种类和物质数量的信息。
在配平化学方程式时,要遵循质量守恒和电荷守恒的原则,保证反应物和生成物的种类和数量相等。
化学计量法是一种用来确定反应中物质的相对数量的方法。
通过化学方程式中物质的化学式系数,可以推导出物质的摩尔比、质量比以及体积比。
在计量实验中,常用的计量单位包括摩尔、克和升。
二、元素周期表元素周期表是化学元素按照不同性质和特征进行排列的表格型工具。
它按照原子序数的增加顺序,将元素分为周期和组。
周期表的主要作用是提供元素的基本信息,如元素符号、原子序数、原子质量和电子组态等。
通过元素周期表,可以发现元素之间的周期性规律,如周期性的原子半径、电离能、电负性和金属与非金属的性质等。
三、氧化还原反应氧化还原反应是指物质在反应中发生氧化或还原的化学反应。
在氧化还原反应中,氧化剂接受电子,而还原剂失去电子。
氧化还原反应常常伴随着能量的释放或吸收,因此在生活和工业中应用广泛。
氧化还原反应可以通过化学方程式描述,并且可以根据反应物和生成物的氧化态来判断氧化还原反应的发生。
四、有机化学基础有机化学是研究碳元素化合物及其衍生物的化学学科。
有机化合物是由碳和氢以及其他元素构成的一类物质,它们在自然界和人类生活中具有重要的地位。
有机化学基础知识包括有机化合物的命名法、结构特点和基本反应类型等。
有机化合物的化学性质和结构有着密切的关系,通过对有机化合物的研究,人们可以设计和合成出更多的有机化合物,为人类社会的发展做出贡献。
总结:苏教版高三化学教材中的知识点涵盖了化学方程式和化学计量法、元素周期表、氧化还原反应以及有机化学基础等内容。



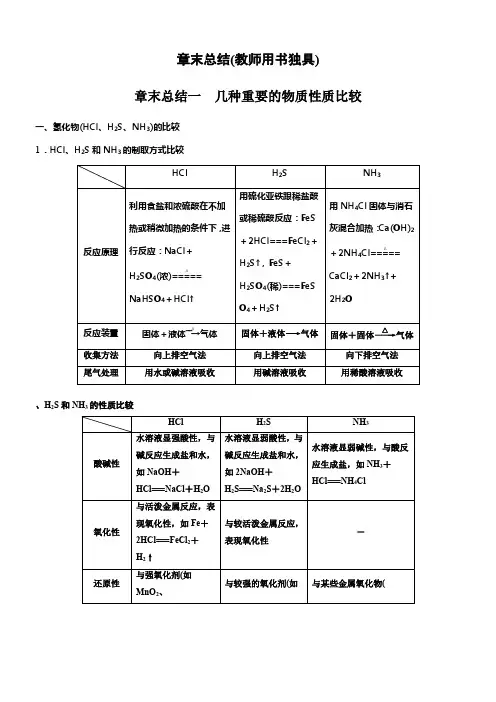
章末总结(教师用书独具)章末总结一几种重要的物质性质比较一、氢化物(HCl、H2S、NH3)的比较1.HCl、H2S和NH3的制取方式比较、H2S和NH3的性质比较二、氧化物(CO2、SO2和SiO2)的比较1.CO2、SO2和SiO2的物理性质比较、SO2和SiO2的化学性质比较CO2+H2O H2CO3SO2+H2O H2SO3三、三大强酸(盐酸、硫酸和硝酸)的比较 1.HCl 、H 2SO 4和HNO 3的物理性质比较、H 2SO 4和HNO 3的化学性质比较 (1)不稳固性浓硝酸具有不稳固性,见光或受热易发生分解,化学方程式为4HNO 3(浓)=====光照或△4NO 2↑+O 2↑+2H 2O ,而盐酸、硫酸那么不易分解。
注意 久置浓硝酸呈黄色,是因为溶解了HNO 3分解生成的NO 2。
因此,实验室中寄存浓硝酸时,应放在棕色试剂瓶中,并置于冷暗处。
向变黄的浓硝酸中通入足量空气(或氧气)能使其变成无色,发生反映的化学方程式为4NO 2+O 2+2H 2O===4HNO 3。
(2)强酸性盐酸、硫酸、硝酸均为强酸,具有酸的通性,能使酸碱指示剂变色,能与金属、碱、碱性氧化物、弱酸盐等发生反映。
①与酸碱指示剂的显色反映盐酸、稀H 2SO 4、稀HNO 3均能使紫色石蕊溶液显红色。
注意 浓HNO 3具有强酸性和强氧化性,能使紫色石蕊溶液先显红色(表现强酸性),后褪色(表现强氧化性、漂白性)。
②与金属的反映盐酸、稀H 2SO 4与金属活动性顺序表中位于H 之前的金属单质发生置换反映,反映通式:活泼金属+酸(盐酸或稀H 2SO 4)―→相应的盐+H 2↑。
例如:Zn+2HCl===ZnCl2+H2↑Fe+H2SO4===FeSO4+H2↑HNO3为氧化性酸,与金属活动性顺序表中除Pt、Au之外的金属都能发生氧化还原反映,HNO3中的氮元素被还原。
其中Fe、Cu、Hg、Ag等别离与稀HNO3、浓HNO3反映的通式:金属+稀HNO3―→硝酸盐+NO↑+H2O。
2019-2020年高中化学专题4 专题复习课教案苏教版选修3编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019-2020年高中化学专题4 专题复习课教案苏教版选修3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019-2020年高中化学专题4 专题复习课教案苏教版选修3的全部内容。
专题复习课杂化轨道类型的判断方法1根据杂化轨道理论,中心原子轨道采取一定的杂化方式后,其空间构型和键角如下:杂化轨道类型杂化轨道空间构型键角sp直线形180°sp2平面三角形120°故可按图索骥、简单判断.2466为sp2。
2.根据价电子对互斥理论判断根据价电子对互斥理论能够比较容易而准确地判断AB m型共价分子或离子的空间构型和中心原子杂化轨道类型,其关系如下表。
型.(1)GeCl4中Ge的杂化轨道类型为__________________,分子空间构型为________________.(2)AsCl3中As的杂化轨道类型为__________________,分子空间构型为________________.(3)SeO2-,4中Se的杂化轨道类型为__________________,离子空间构型为________________。
[解析](1)GeCl4:Ge的价电子对数=4+错误!×[4-4×(8-7)]=4+0=4,Ge采用sp3杂化,因为中心原子上没有孤对电子,故分子空间构型为正四面体形。
(2)AsCl3:As的价电子对数=3+错误!×[5-3×(8-7)]=3+1=4,As采用sp3杂化,因为中心原子上有1对孤对电子,故分子空间构型为三角锥形.(3)SeO错误!:Se的价电子对数=4+错误!×[6+2-4×(8-6)]=4+0=4,Se采用sp3杂化,因为中心原子上没有孤对电子,故离子空间构型为正四面体形。
化学选修4化学反应与原理专题1 化学反应与能量变化第一单元化学反应中的热效应一、化学反应的焓变1、反应热与焓变(1)反应热:化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
(2)焓变(ΔH):在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为化学反应的焓变。
符号:△H,单位:kJ/mol2、放热反应和吸热反应:(1)放热反应:在化学反应过程中,放出热量的反应称为放热反应(反应物的总能量大于生成物的总能量)(2)吸热反应:在化学反应过程中,吸收热量的反应称为吸热反应(反应物的总能量小于生成物的总能量)化学反应过程中的能量变化如图:放热反应ΔH为“—”或ΔH<0 吸热反应ΔH为“+”或ΔH >0∆H=E(生成物的总能量)-E(反应物的总能量)∆H=E(反应物的键能)-E(生成物的键能)(3)常见的放热反应:1)所有的燃烧反应2)酸碱中和反应3)大多数的化合反应4)金属与酸的反应5)生石灰和水反应 6)浓硫酸稀释、氢氧化钠固体溶解等常见的吸热反应:1)晶体Ba(OH)·8H2O与NH4Cl 2)大多数的分解反应23)以H2、CO、C为还原剂的氧化还原反应 4)铵盐溶解等注意:1)化学反应时放热反应还是吸热反应只取决于反应物和生成物总能量的相对大小,与反应条件(如点燃、加热、高温、光照等)和反应类型无关;2)物质的溶解过程也伴随着能量变化:NaOH固体溶于水明显放热;硝酸铵晶体溶于水明显吸热,NaCl溶于水热量变化不明显。
3、化学反应过程中能量变化的本质原因:化学键断裂——吸热化学键形成——放热4、热化学方程式(1)定义:能够表示反应热的化学方程式叫做热化学方程式。
(2)意义:既能表示化学反应过程中的物质变化,又能表示化学反应的热量变化。
(3) 书写化学方程式注意要点:1)热化学方程式必须标出能量变化。
2)热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s 分别表示固态,液态,气态,水溶液中溶质用aq 表示)3)热化学反应方程式要指明反应时的温度和压强。