高中化学必修一蒸馏和萃取
- 格式:pdf
- 大小:112.18 KB
- 文档页数:5

高中化学蒸馏和萃取的教案
实验名称:蒸馏和萃取
实验目的:通过蒸馏和萃取实验掌握这两种分离技术的原理和操作方法。
实验材料:
1. 水,甲醇,氯仿等实验用溶液
2. 蒸馏器,试管,冷凝器等实验仪器
实验步骤:
1. 蒸馏实验
(1)将实验溶液置于蒸馏瓶中。
(2)将蒸馏瓶与冷却水冷凝器连接好。
(3)加热蒸馏瓶中的溶液,控制火力,观察溶液的沸腾情况。
(4)收集蒸馏液,观察收集管中的液体。
2. 萃取实验
(1)将两种不相溶的溶液放入漏斗中。
(2)将萃取剂滴加入漏斗中的溶液中。
(3)轻轻地摇动漏斗,使两种溶液充分接触混合。
(4)将漏斗静置一段时间,待两种溶液分层后,打开下部阀门放出底层的溶液。
实验原理:
1. 蒸馏:利用液体的沸点不同,将液体混合物加热至液体沸腾,然后再以气体形式冷凝回液体的分离方法。
2. 萃取:利用萃取剂选择性溶解其中一种物质,达到物质的分离目的。
实验注意事项:
1. 实验操作时要小心谨慎,注意安全。
2. 蒸馏瓶与冷凝器连接处要严密,避免蒸气外泄。
3. 萃取剂的选择要根据实际情况确定,注意可溶性和选择性。
实验总结:
通过本次蒸馏和萃取实验,我们掌握了这两种分离技术的原理和操作方法,同时也了解了不同条件下的溶液分离效果的差异。
在今后的实验中,我们将进一步运用这两种技术,提高我们的实验技能和分析能力。

第一节化学实验基本方法第3课时蒸馏和萃取知识点一:蒸馏1. 原理:利用互溶的液体混合物中各组分的沸点不同,用蒸馏的方法除去易挥发、难挥发或不挥发的杂质。
2. 实验仪器①蒸馏烧瓶:蒸馏烧瓶属于烧瓶类。
蒸馏烧瓶与普通烧瓶不同的地方,在于瓶颈部位有一略向下的支管,它是专门用来蒸馏液体的容器。
蒸馏烧瓶有减压蒸馏烧瓶及常压蒸馏烧瓶2类。
常压蒸榴烧瓶也分支管在瓶颈上都、中部和下部的3种,蒸馏沸点较高的液体,选用支管在瓶颈下部的蒸馏烧瓶,沸点较低的则用支管在上都的蒸馏烧瓶。
而支管位于瓶颈中部者,常用来蒸馏一般沸点的液体。
蒸馏烧瓶的规格以容积大小区别,常用为150mL和250mL 2种。
②冷凝器:冷凝器又叫冷凝管,是用来将蒸气冷凝为液体的仪器。
冷凝器根据不同使用要求有多种结构不同的类型。
内管有直型(如图1-3中所示)、蛇形和球形3种。
直型冷凝器构造简单,常用于冷凝沸点较高的液体,蛇形冷凝管特别适用于沸点低、易挥发的有机溶剂的蒸馏回收。
而球形者两种情况都适用。
冷凝管的规格以外套管长度表示,常用为200 mm、300 mm、400 mm、500 mm和600 mm等几种。
直形冷凝器使用时,既可倾斜安装,又可直立使用,而球形或蛇形冷凝器只能直立使用,否则因球内积液或冷凝液形成断续液柱而造成局部液封,致使冷凝液不能从下口流出。
③应接管:也叫尾接管或称接受器又名牛角管。
它与冷凝器配套使用,将蒸馏液导入承接容器。
应接管的弯角约为105°,便于和蒸馏烧瓶支管75"角相配,安装后二者保持平行。
应接管的规格以上口外径和长度表示,常用为18×l50mm、25×180mm和30×200mm 3种)。
使用时,应接管的上口通过单孔橡胶塞与冷凝器的下端管口相连。
应接管的下口直接伸入承接容器内。
④温度计:温度计是用于测量温度的仪器。
其种类很多,有数码式温度计,热敏式温度计等。
而实验室中常用为玻璃液体温度计,简称温度计。

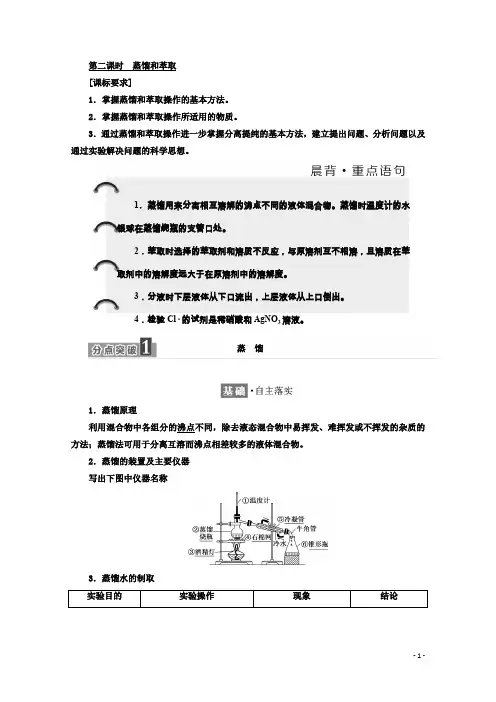
第二课时 蒸馏和萃取[课标要求]1.掌握蒸馏和萃取操作的基本方法。
2.掌握蒸馏和萃取操作所适用的物质。
3.通过蒸馏和萃取操作进一步掌握分离提纯的基本方法,建立提出问题、分析问题以及通过实验解决问题的科学思想。
1.蒸馏原理 利用混合物中各组分的沸点不同,除去液态混合物中易挥发、难挥发或不挥发的杂质的方法;蒸馏法可用于分离互溶而沸点相差较多的液体混合物。
2.蒸馏的装置及主要仪器写出下图中仪器名称3.蒸馏水的制取1.蒸馏用来分离相互溶解的沸点不同的液体混合物。
蒸馏时温度计的水银球在蒸馏烧瓶的支管口处。
2.萃取时选择的萃取剂和溶质不反应,与原溶剂互不相溶,且溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
3.分液时下层液体从下口流出,上层液体从上口倒出。
4.检验Cl -的试剂是稀硝酸和AgNO 3溶液。
蒸 馏[特别提醒] 用AgNO 3溶液检验自来水中的Cl -时要用稀HNO 3酸化而不能使用盐酸和硫酸酸化。
1.(1)实验室制取蒸馏水的装置与常用蒸馏装置相比,少了温度计。
是什么原因呢?(2)为什么冷却水通入方向与被冷凝蒸气流向相反?提示:(1)温度计的作用是控温和显示加热范围。
因为制蒸馏水是除去溶解在水中的难挥发性杂质,蒸馏出水,水的沸点恒定为100 ℃,故不需要温度计。
(2)冷却水通入方向与被冷凝蒸气流向相反,是为了使馏出物充分冷却。
2.蒸馏实验中,为什么要使用温度计?应如何放置温度计?提示:在蒸馏实验中,温度计用来测量蒸气的温度,所以温度计的水银球应位于蒸馏烧瓶支管口处。
3.某溶液中加入AgNO 3溶液产生白色沉淀,原溶液中一定含有Cl -吗?提示:不一定;原溶液中也可能含有CO 2-3等杂质离子。
1.蒸馏实验的操作步骤(1)检查蒸馏装置的气密性。
(2)向蒸馏烧瓶中加入待分离或提纯的液体混合物,并加入几粒碎瓷片。
(3)向冷凝管中通入冷却水。
(4)给蒸馏烧瓶加热。
(5)收集馏分。
(6)停止加热,拆卸装置。



必修I 第一章从实验学化学第一节化学实验基本方法第3课时混合物的分离和提纯——蒸馏和萃取一、教材分析:蒸馏和萃取是在实际生产生活中有着广泛应用的分离和提纯技术,海水淡化问题是目前解决全球淡水日益紧缺问题的重要途径,这为选修《化学与技术》奠定了一定的知识基础。
萃取对于学生来说是全新的分离和提纯技术,它是对溶解性规律的一个应用,其原理也在今后卤族元素和有机物的学习中多次体现,在生活中也有多方面的应用。
本节课教学内容主要包括两个方面:(一)、复习蒸馏的原理,掌握实验室规范的蒸馏装置。
这部分内容只作复习和简单的扩充;(二)、介绍萃取的原理和装置,特别是实验操作中的细节。
这部分知识为新知识,应采用灵活多样的教学手段由浅入深地让学生理解和掌握。
蒸馏和萃取是高中阶段的两个基本实验操作,学生对于相关内容及部分仪器还比较陌生,本节课的主要目的就是让学生了解蒸馏和萃取的操作及过程,学习一些仪器的使用方法,并进一步丰富分离提纯物质的方法和手段。
二、教学目标:1.知识与技能(1)体验科学探究的过程,学习运用以实验为基础的实证研究方法。
(2)知道液体混合物分离和提纯的常用方法—蒸馏和萃取,能根据常见物质的性质设计分离和提纯物质的方案,并初步掌握其操作技能。
2.过程和方法通过实际操作,来学会对混合物分离和提纯的操作。
3.情感态度与价值观(1)树立绿色化学思想,形成环境保护的意识。
(2)能发现学习和生产、生活中有意义的化学问题,并进行实验探究。
三、教学重点难点:重点:蒸馏和萃取的掌握和应用难点:蒸馏和萃取的掌握和应用四、学情分析:(1)在初中阶段学生已经学习了简易的蒸馏操作方法,本节课将在此基础上对规范装置和实验原理做深入的探讨,使学生更容易接受。
已经初步了解了粗盐提纯的方法,蒸馏的简易装置。
蒸馏则是在初中简易操作的基础上引入使用冷凝管这一较正规的操作。
(2)萃取的引入采用学生回家做西红柿汤并进行观察积极调动学生学习的主观能动性。

(人教版必修1)第一章《从实验学化学》教学设计第一节《化学实验基本方法》(第三课时:蒸馏、萃取和分液)【引入】在海滨浴场嬉戏,偶尔喝上一二口海水,你会感到又咸又苦;用海水浇灌普通的农作物,不用多久农作物就会被“腌死”。
这又是什么原因呢?【讲解】海水中溶解了大量的盐类。
海水的平均含盐量可达35‰左右,也就是说,在1立方千米的海水里大约含有3500万吨的盐类物质。
人们日常的饮用水的含盐量仅在0.5‰左右,而工农业用水的含盐量也不能超过3‰。
人类面对着浩瀚无比的海洋,难道就不能把海水变成淡水吗?【过渡】神话中的观音菩萨有一种高超的本领:只要把手中的杨柳枝条轻轻一甩,就可以把海水变成甘露。
那么,在现实生活中能不能把海水变成淡水呢?千百年来人们一直在寻找把海水变成淡水的“法宝”。
【讲解】亚里士多德的实验【投影】早在公元前4世纪,古希腊哲学家、自然科学家——亚里士多德曾做过一个当时看起来十分有趣的实验:他把咸水放在半封闭的容器里,然后加热将咸水烧开。
随之,他惊奇地发现,水蒸气中已不再含有盐分,凝结成的水珠也不再有咸味。
亚里士多德曾在实验记录中写到“通过蒸馏,先使水变成蒸汽继而使之变成液体状,可使海水变成可饮用水”。
这个实验是世界上最早的一次海水淡化试验,亚里士多德所采用的方法就是人们现在所说的——蒸馏法。
【投影】海水淡化工厂【思考】大家想一想蒸馏是不是一种分离混合物的方法?如果是,那么是分离什么样的混合物?【过渡】混合物的分离和提纯除了过滤、蒸发外,还有其他很多方法,这节课,我们来学习另外两种新方法:蒸馏和萃取【板书】第一节化学实验基本方法:蒸馏和萃取(distillation and extraction)【板书】活动一、认识蒸馏【交流】蒸馏的原理:对于液态混合物,利用液体—液体(或液体-固体)中各组分沸点不同,给液体混合物加热,使其中的某一低沸点组分蒸发再冷凝成液体,以除去易挥发、难挥发或不挥发的杂质的操作过程。



高中化学必修一知识点归纳一、化学实验基本方法1. 混合物的分离和提纯-过滤:用于分离固体和液体。
-蒸发:用于分离可溶性固体和液体。
-蒸馏:用于分离沸点不同的液体混合物。
-萃取和分液:利用溶质在两种互不相溶的溶剂中的溶解度不同,将溶质从一种溶剂转移到另一种溶剂中。
2. 化学计量在实验中的应用-物质的量(n):表示含有一定数目粒子的集合体。
单位为摩尔(mol)。
-摩尔质量(M):单位物质的量的物质所具有的质量。
单位为克/摩尔(g/mol)。
-气体摩尔体积(Vm):单位物质的量的气体所占的体积。
标准状况下,Vm = 22.4L/mol。
-物质的量浓度(c):单位体积溶液中所含溶质的物质的量。
单位为摩尔/升(mol/L)。
二、化学物质及其变化1. 物质的分类-混合物和纯净物。
-单质和化合物。
-氧化物、酸、碱、盐。
2. 离子反应-电解质:在水溶液里或熔融状态下能够导电的化合物。
-非电解质:在水溶液里和熔融状态下都不能导电的化合物。
-离子方程式:用实际参加反应的离子符号来表示反应的式子。
3. 氧化还原反应-氧化剂和还原剂。
-氧化还原反应的本质是电子的转移。
三、金属及其化合物1. 金属的化学性质-金属与氧气的反应。
-金属与水的反应。
-金属与酸的反应。
2. 几种重要的金属化合物-氧化物:如氧化钠、氧化铝等。
-氢氧化物:如氢氧化钠、氢氧化铝等。
-盐:如碳酸钠、碳酸氢钠、硫酸亚铁、硫酸铁等。
3. 用途广泛的金属材料-合金:由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
四、非金属及其化合物1. 无机非金属材料的主角——硅-硅的存在和性质。
-二氧化硅的性质和用途。
-硅酸盐的性质和用途。
2. 富集在海水中的元素——氯-氯气的性质。
-氯离子的检验。
3. 硫和氮的氧化物-二氧化硫的性质。
-三氧化硫的性质。
-氮的氧化物的性质。
4. 氨硝酸硫酸-氨的性质和用途。
-硝酸的性质和用途。
-硫酸的性质和用途。
高中化学蒸馏与萃取教案
教案标题:蒸馏与萃取
教学目标:
1. 了解蒸馏与萃取的原理和应用;
2. 掌握蒸馏和萃取的实验操作方法;
3. 能够分析实验中的问题并提出解决方案。
教学重点:
1. 蒸馏的原理和应用;
2. 萃取的原理和应用;
3. 实验操作方法。
教学难点:
1. 萃取中的选择溶剂和萃取方法;
2. 实验操作中的注意事项。
教学准备:
1. 实验室设备:蒸馏烧瓶、冷凝器、蒸馏接头、烧瓶、漏斗等;
2. 实验材料:水、酒精、食盐、植物油等。
教学内容及安排:
一、蒸馏的原理和应用(30分钟)
1. 讲解蒸馏的原理和适用范围;
2. 展示蒸馏的实验操作方法。
二、萃取的原理和应用(30分钟)
1. 讲解萃取的原理和常用溶剂;
2. 演示萃取的实验操作方法。
三、实验操作(60分钟)
1. 分组进行蒸馏实验;
2. 分组进行萃取实验。
四、总结与讨论(20分钟)
1. 总结蒸馏和萃取的实验结果;
2. 讨论实验中遇到的问题及解决方法。
教学反馈:
1. 老师进行实验结果的评价和指导;
2. 学生对实验中的问题及操作方法进行讨论和总结。
扩展阅读:
1. 深入了解蒸馏和萃取在化学实验和工业生产中的应用;
2. 阅读相关文献,了解蒸馏和萃取的新技术和发展趋势。
教学结束。
人教版高中化学必修一《混合物的分离和提纯——蒸馏和萃取》教案必修I第一章从实验学化学第一节化学实验基本方法(第3课时)一、教材分析:蒸馏和萃取是在实际生产生活中有着广泛应用的分离和提纯技术,海水淡化问题是目前解决全球淡水日益紧缺问题的重要途径,这为选修《化学与技术》奠定了一定的知识基础。
萃取对于学生来说是全新的分离和提纯技术,它是对溶解性规律的一个应用,其原理也在今后卤族元素和有机物的学习中多次体现,在生活中也有多方面的应用。
本节课教学内容主要包括两个方面:(一)、复习蒸馏的原理,掌握实验室规范的蒸馏装置。
这部分内容只作复习和简单的扩充;(二)、介绍萃取的原理和装置,特别是实验操作中的细节。
这部分知识为新知识,应采用灵活多样的教学手段由浅入深地让学生理解和掌握。
蒸馏和萃取是高中阶段的两个基本实验操作,学生对于相关内容及部分仪器还比较陌生,本节课的主要目的就是让学生了解蒸馏和萃取的操作及过程,学习一些仪器的使用方法,并进一步丰富分离提纯物质的方法和手段。
二、教学目标:1.知识与技能(1)体验科学探究的过程,学习运用以实验为基础的实证研究方法。
(2)知道液体混合物分离和提纯的常用方法—蒸馏和萃取,能根据常见物质的性质设计分离和提纯物质的方案,并初步掌握其操作技能。
2.过程和方法通过实际操作,来学会对混合物分离和提纯的操作。
3.情感态度与价值观(1)树立绿色化学思想,形成环境保护的意识。
(2)能发现学习和生产、生活中有意义的化学问题,并进行实验探究。
三、教学重点难点:重点:蒸馏和萃取的掌握和应用难点:蒸馏和萃取的掌握和应用四、学情分析:(1)在初中阶段学生已经学习了简易的蒸馏操作方法,本节课将在此基础上对规范装置和实验原理做深入的探讨,使学生更容易接受。
已经初步了解了粗盐提纯的方法,蒸馏的简易装置。
蒸馏则是在初中简易操作的基础上引入使用冷凝管这一较正规的操作。
(2)萃取的引入采用学生回家做西红柿汤并进行观察积极调动学生学习的主观能动性。
一、选择题
1.下列符合化学实验“绿色化学”的有()
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水②在铜与浓硫酸反应的实
验中,将铜片改为可调节高度的铜丝③将实验室的废酸液与废碱液中和后再排放
A.①②B.①③
C.②③D.①②③
解析:①溴水易挥发,污染环境;②利用铜丝可节省原料;③酸碱中和,避免污染。
答案: D
2.将体积比为1∶2的四氯化碳和碘水在试管中充分混合后静置。
下列图示现象正确的是()
解析:四氯化碳和水互不相溶,且密度比水大,则四氯化碳与碘水按体积比为1∶2充分混合后,四氯化碳层在试管下层。
答案: D
3.下列混合物的分离方法不可行的是()
A.沸点不同的液态混合物可用蒸馏方法分离
B.互不相溶的液态混合物可用分液方法分离
C.互溶的液态混合物可用萃取的方法分离
D.可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
解析:萃取是指用一种溶剂把物质从它与另一种溶剂所组成的溶液中提取出来的方法,C错误。
答案: C
4.如果你家里的食用花生油不小心混入了部分水,根据你所学过的知识,最简便的分离方法是
()
解析:油和水是互不相溶的两种液体,本着方便易操作的原则,可用分液法分离。
答案: B
5.下列关于蒸馏操作的有关叙述不正确的是()
A.蒸馏操作主要仪器是:蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、温度计等
B.蒸馏操作使用的温度计的水银球应插入到液面下
C.在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸
D.冷凝管进出水的方向是下进上出
解析:蒸馏时,温度计的水银球应放在蒸馏烧瓶的支管口处。
答案: B
6.用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是()
A.实验使用的主要仪器是分液漏斗
B.碘在四氯化碳中的溶解度比在水中的溶解度大
C.碘的四氯化碳溶液呈紫红色
D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
解析:水的密度比CCl4小,水层在上层,应从漏斗上口倒出,碘的CCl4溶液在下层,应从下口流出。
答案: D
7.不用任何试剂鉴别下列五种物质的溶液:①NaOH
②MgSO4③Ba(NO3)2④Cu(NO3)2⑤KNO3
被鉴别出来的正确顺序是()
A.⑤④③②①B.④③①②⑤
C.④①②③⑤D.②③①④⑤
解析:各取五种溶液少量,观察颜色,蓝色溶液为Cu(NO3)2溶液,然后分别将其他四种无色
溶液与之混合,产生蓝色沉淀的为NaOH溶液,再用NaOH溶液检出MgSO4溶液,用MgSO4溶液检出Ba(NO3)2溶液和KNO3溶液。
答案: C
8.现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示:
物质熔点/℃沸点/℃密度/(g·c m-3) 溶解性
甲-68 115 0.93 易溶于乙
乙-84 77 0.90 易溶于甲[来源学*
科*网Z*X*X*K]
据此,将甲和乙相互分离的最佳方法是()
A.过滤法B.蒸发法
C.萃取法D.蒸馏法
解析:对于两种互溶的液体混合物,宜利用沸点不同采用蒸馏方法分离。
答案: D
9.现有三组溶液:
①汽油和氯化钠溶液②39%的乙醇溶液③氯化钠和单质溴的水溶液,分离以上各混合液的
正确方法依次是()
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
解析:汽油不溶于水,采用分液法;乙醇和水互溶,只能采用蒸馏法;单质溴易溶于有机溶
剂中,采用萃取法。
答案: C
10.某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、
酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、锥形瓶。
从缺少仪器的角度来看,不能进行的
实验操作是()
A.蒸发B.萃取
C.过滤D.蒸馏
解析:蒸发需要酒精灯、蒸发皿、玻璃棒、铁架台,A可进行;萃取需要分液漏斗、铁架台、烧杯,B可进行;过滤需要铁架台、铁圈、漏斗、玻璃棒、烧杯,C可进行;蒸馏缺少冷凝管、牛角管,不能进行。
答案: D
二、非选择题
11.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.过滤法B.分液法
C.蒸馏法D.结晶法
(1)________分离水和豆油的混合物;
(2)________从含有硝酸钾和少量氯化钾的混合溶液中获得硝酸钾;
(3)________分离饱和食盐水和沙子的混合物;
(4)________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃),已知四氯化碳和甲苯互溶。
解析:水和豆油互不相溶,利用分液法分离;硝酸钾的溶解度受温度影响较显著,可以用结
晶法分离;沙子难溶于水,可用过滤法除去;四氯化碳和甲苯互溶且沸点相差较大,可用蒸馏法分
离。
答案:(1)B(2)D(3)A(4)C
12.将所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,可以得到汽油和煤油。
(1)写出A、B、C所代表仪器的名称:A________;B________;C________。
(2)写出A仪器的进水口________,出水口________。
(3)用字母表示装置的连接顺序:
________________________________________________________________________。
(4)在B中注入石油后,加入几片碎瓷片的目的是
________________________________________________________________________ ________________________________________________________________________。
[来源学科网ZXXK]解析:(1)仪器的名称A为冷凝管;B为蒸馏烧瓶;C为锥形瓶。
(2)冷凝管的进出水方向一般是下进上出,所以冷却水应该从c进入,从d流出。
(3)装置的连接顺序应是从下到上,从左到右。
(4)在蒸馏过程中,向蒸馏烧瓶中加入少许碎瓷片的目的是防止液体暴沸。
答案:(1)冷凝管蒸馏烧瓶锥形瓶
(2)c d
(3)e—i—h—a—b—w
(4)防止液体受热时暴沸
13.某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,
回答:
检测次数溶液中检测出的物质
第一次KCl、K2SO4、Na2CO3、NaCl[来源学科网
ZXXK]
第二次KCl、BaCl2、Na2SO4、K2CO3
第三次Na2SO4、KCl、K2CO3、NaCl
(1)三次检测结果中第________次检测结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
第一步:向溶液中滴加过量的________溶液(填化学式),其目的是检验CO2-3并将其除去;
第二步:加入________溶液(填化学式),其目的是________;
第三步:过滤,再向滤液中加入________溶液(填化学式),其目的是________。
解析:(1)第二次检测结果不正确,溶液中的BaCl2与Na2SO4、K2CO3能发生化学反应分别生成BaSO4、BaCO3沉淀,而不能共存,故不正确。
(2)检验并除去CO2-3应选择HNO3溶液,这样不会影响其他两种离子的检验;检验SO2-4,需用Ba(NO3)2溶液,检验Cl-需用AgNO3溶液;由于Ag2SO4微溶于水,会干扰SO2-4的检验,因而应先检验SO2-4,然后检验Cl-。
答案:(1)二
(2)HNO3Ba(NO3)2检验SO2-4AgNO3检验Cl-
14.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。
请回答下列问题:
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入 1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是________。
(注:如下图试管中深色区为紫红色溶液)
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误
之处。
(加热装置中烧杯底部已垫有石棉网)
①________________________________________________________________________;
②________________________________________________________________________。
解析:(1)将海藻灰的悬浊液分离成残渣和溶液是通过过滤的实验操作来实现的;含碘的水溶
液转化成含碘的有机溶液则需要先萃取再分液来完成。
(2)四氯化碳的密度大于水,分层后位于下层,结合碘水和CCl4的体积分别为 3 mL和1 mL可以判断D正确。
(3)由蒸馏的基本实验装置图和原理可知,温度计下端的水银球应位于蒸馏烧瓶的支管口处,冷凝管中水流方向应为下进上出。
答案:(1)过滤萃取、分液
(2)D
(3)①温度计下端的水银球不能插入溶液中,应位于支管口
②冷凝管(或冷凝器)中水流方向反了。