3-2(1)分子晶体
- 格式:doc
- 大小:215.50 KB
- 文档页数:2


第二节分子晶体与共价晶体第1课时分子晶体[核心素养发展目标] 1.能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。
2.能利用分子晶体的通性推断常见的分子晶体,理解分子晶体中微粒的堆积模型,并能用均摊法对晶胞进行分析。
一、分子晶体的概念和性质1.分子晶体的概念只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
2.分子晶体中的粒子及粒子间的相互作用3.常见的典型分子晶体(1)所有非金属氢化物:如H2O、H2S、NH3、CH4、HX(卤化氢)等。
(2)部分非金属单质:如X2(卤素单质)、O2、H2、S8、P4、C60、稀有气体等。
(3)部分非金属氧化物:如CO2、SO2、NO2、P4O6、P4O10等。
(4)几乎所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物:如苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
4.分子晶体的物理性质(1)分子晶体熔、沸点较低,硬度很小。
(2)分子晶体不导电。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力()(2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键()(3)分子晶体熔化或溶于水均不导电()(4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大()(5)水分子间存在着氢键,故水分子较稳定()(6)NH3极易溶于水的原因一是NH3、H2O均为极性分子,二是NH3和H2O之间形成分子间氢键()答案(1)×(2)√(3)×(4)×(5)×(6)√1.下列各组物质各自形成晶体,均属于分子晶体的化合物是()A.NH3、HD、C10H18B.PCl3、CO2、H2SO4C.SO2、C60、P2O5D.CCl4、Na2S、H2O2答案B解析分子晶体的构成微粒为分子,分子内部以共价键结合。

姓名,年级:时间:第一课时分子晶体学习目标:1。
了解分子晶体的概念及结构特点。
掌握分子晶体的性质。
2. 能够通过分析分子晶体的组成微粒、结构模型及分子晶体中的作用力解释分子晶体的一些物理性质。
3。
知道一些常见的属于分子晶体的物质类别。
[知识回顾]什么是范德华力和氢键?存在于什么微粒间?主要影响物质的什么性质?答:范德华力是分子与分子之间存在的一种把分子聚集在一起的作用力。
它是分子之间普遍存在的相互作用力,它使得许多物质能以一定的聚集态(固态和液态)存在。
氢键:是由已经与电负性很强的原子(如N、F、O)形成共价键的氢原子与另一个分子中或同一分子中电负性很强的原子之间的作用力。
范德华力和氢键主要存在于分子之间,主要影响物质的物理性质。
[要点梳理]1.分子晶体的概念及结构特点(1)分子晶体中存在的微粒:分子.(2)分子间以分子间作用力相结合形成的晶体叫分子晶体.(3)相邻分子间靠分子间作用力相互吸引。
①若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12个紧邻的分子。
②分子间含有其他作用力,如氢键,则每个分子周围紧邻的分子要少于12个。
如冰中每个水分子周围只有4个紧邻的水分子。
2.常见的分子晶体(1)所有非金属氢化物,如H2O、NH3、CH4等.(2)部分非金属单质,如卤素(X2)、氧气O2、氮N2、白磷(P4)、硫(S8)等。
(3)部分非金属氧化物,如CO2、P4O10、SO2、SO3等。
(4)几乎所有的酸,如HNO3、H2SO4、H3PO4、H2SiO3等。
(5)绝大多数有机物的晶体,如苯、乙醇、乙酸、乙酸乙酯等.3.典型的分子晶体(如图)(1)冰①水分子之间的主要作用力是氢键,当然也存在范德华力.②氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子互相吸引。
(2)干冰①在常压下极易升华。
②干冰中的CO2分子间只存在范德华力而不存在氢键,一个CO2分子周围等距紧邻的CO2分子有12个.知识点一分子晶体的性质1.分子晶体的构成微粒是真实存在的小分子或大分子。





第11讲分子晶体考点导航知识精讲知识点一:一、分子晶体及其结构特点1.概念只含分子的晶体。
2.粒子间的作用分子晶体中相邻的分子间以相互吸引。
【答案】分子间作用力3.常见分子晶体及物质类别物质种类实例所有H2O、NH3、CH4等部分卤素(X2)、O2、N2、白磷(P4)、硫(S8)等部分CO2、P4O10、SO2、SO3等几乎所有的HNO3、H2SO4、H3PO4、H2SiO3等绝大多数苯、乙醇、乙酸、乙酸乙酯等【答案】非金属氢化物非金属单质非金属氧化物酸有机物4.分子晶体的常见堆积方式分子间作用力堆积方式实例范德华力分子采用,如C60、干冰、I2、O2每个分子周围有 个紧邻的分子范德华 力、分子不采用 ,每个分子周围紧邻的分子少于12个如HF 、NH 3、冰【答案】密堆积 12 氢键 密堆积 【即学即练1】1.晶胞是晶体结构中可重复出现的最小的结构单元,C 60晶胞结构如下图所示,下列说法正确的是A .C 60摩尔质量是720B .C 60与苯互为同素异形体 C .C 60晶体中仅存在范德华力D .每个C 60分子周围与它距离最近且等距离的C 60分子有12个 【答案】D【解析】A .C 60的摩尔质量为720g/mol ,A 错误;B .由同种元素形成的不同种单质互为同素异形体,而苯是碳氢形成的化合物,B 错误;C .C 60属于分子晶体,晶体中不仅存在范德华力,还存在碳与碳之间的共价键,C 错误;D .根据晶胞的结构可知,以晶胞中顶点上的C 60分子为研究对象,与它距离最近等距离的C 60分子分布在立方体的面心上,每个C 60分子被8个立方体共用,有12个面与之相连,所以每个C 60分子周围与它距离最近等距离的C 60分子有12个,D 正确; 答案选D 。
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是 A .3NH 、HD 、108C H B .3PCl 、2CO 、24H SO C .2SO 、2SiO 、25P O D .4CCl 、2Na S 、22H O【答案】B【解析】A .该组物质均属于分子晶体,NH 3、C 10H 8属于化合物,HD 属于单质,A 不符合题意; B .该组物质均是属于分子晶体的化合物,B 符合题意;C .SO 2、P 2O 5是属于分子晶体的化合物,SiO 2是属于共价晶体的化合物,C 不符合题意;D.CCl4、H2O2是属于分子晶体的化合物,Na2S是属于离子晶体的化合物,D不符合题意;故选B。

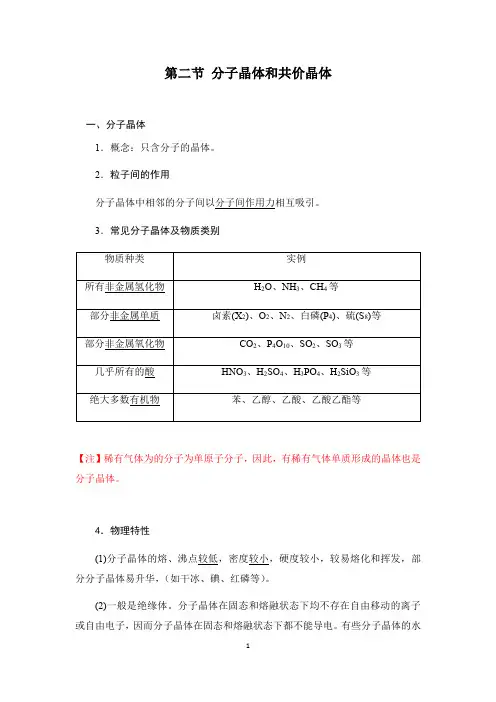
第二节分子晶体和共价晶体一、分子晶体1.概念:只含分子的晶体。
2.粒子间的作用分子晶体中相邻的分子间以分子间作用力相互吸引。
3.常见分子晶体及物质类别【注】稀有气体为的分子为单原子分子,因此,有稀有气体单质形成的晶体也是分子晶体。
4.物理特性(1)分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发,部分分子晶体易升华,(如干冰、碘、红磷等)。
(2)一般是绝缘体。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)溶解性符合“相似相溶规律”。
【注】分子晶体熔、沸点高低的比较规律①分子晶体中分子间作用力越大,物质熔、沸点越高,反之越低。
②具有氢键的分子晶体,熔、沸点反常高。
5.分子晶体的常见堆积方式6.常见分子晶体的结构分析(1)冰①水分子之间的主要作用力是氢键,当然也存在范德华力。
②氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子互相吸引。
(2)干冰①干冰中的CO 2分子间只存在范德华力,不存在氢键。
②每个晶胞中有4个CO 2分子,12个原子。
每个CO 2分子周围等距离紧邻的CO 2分子数为12个。
【注】冰晶体中,每个水分子与其他4个水分子形成氢键,每个水分子平均形成2个氢键(每个氢键由2个水分子均摊,故4×21=2)二、共价晶体1.定义:所有原子都以共价键相互结合形成共价键三维骨架结构的晶体叫共价晶体。
2.构成微粒及微粒间的作用力共价晶体⎩⎨⎧ 构成粒子:原子粒子间作用力:共价键【注】①共价晶体中不存在单个分子,因此,共价晶体的化学式不代表其实际组成,只表示其组成的原子个数比。
①共价晶体融化时被破坏的作用力是共价键。
①共价晶体中只有共价键,但含有共价键的晶体不一定是共价晶体。
如CO2、H2O等分子晶体中也含有共价键。
3.常见的共价晶体4.共价晶体的物理性质(1)熔点很高。
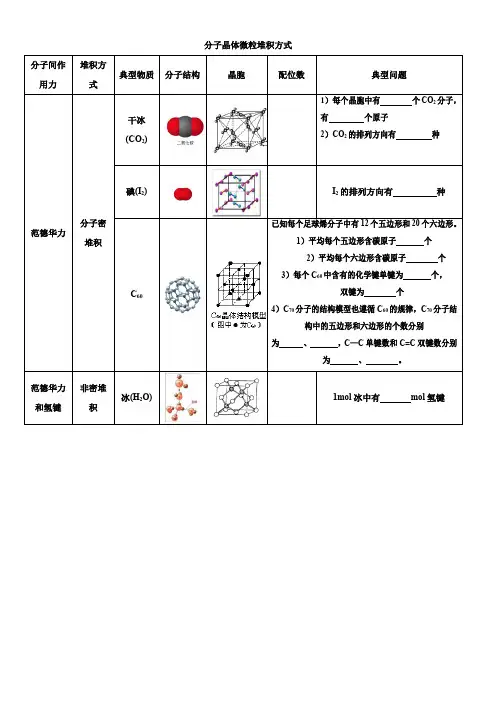
第二节分子晶体与原子晶体第1课时分子晶体一、分子晶体及其结构特点1.概念分子间通过分子间作用力相结合形成的晶体。
2.微粒间作用分子晶体中相邻的分子间以分子间作用力相互吸引。
3.常见分子晶体及物质类别物质类别实例所有非金属氢化物H2O、NH3、CH4等部分非金属单质卤素(X2)、O2、N2、白磷(P4)、硫(S8)等部分非金属氧化物CO2、P4O10、SO2、SO3等几乎所有的酸HNO3、H2SO4、H3PO4、H2SiO3等绝大多数有机物的晶体苯、乙醇、乙酸、乙酸乙酯等4.两种典型分子晶体的组成与结构(1)干冰①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子数为12个。
(2)冰①水分子之间的作用力有范德华力和氢键,但主要是氢键。
②由于氢键的方向性,使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
判断正误(1)分子晶体中,一定存在共价键和分子间作用力() (2)分子晶体中只存在分子间作用力() (3)共价化合物一定属于分子晶体() (4)干冰晶胞中含有4个CO2分子()(5)分子晶体中一定含有分子间作用力,不一定含有化学键()答案(1)×(2)×(3)×(4)√(5)√1.下列物质中,属于分子晶体的是________。
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸答案 ②④⑤解析 由常见分子晶体对应的物质类别可知:碘、蔗糖、磷酸都属于分子晶体。
2.甲烷晶体的晶胞结构如图所示(1)晶胞中的球只代表1个__________。
(2)晶体中1个CH 4分子有______个紧邻的CH 4分子。
(3)甲烷晶体熔化时需克服______。
(4)1个CH 4晶胞中含有______个CH 4分子。
答案 (1)甲烷分子 (2)12 (3)范德华力 (4)4解析 (1)题图所示的甲烷晶胞中的球代表的是1个甲烷分子。
(2)由甲烷晶胞分析,位于晶胞顶点的某一个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在晶胞的面上,因此每个都被2个晶胞共用,故与1个甲烷分子紧邻的甲烷分子数目为3×8×12=12。
2023年高考化学试卷(湖南卷)一、单选题1.中华文化源远流长,化学与文化传承密不可分。
下列说法错误的是A.青铜器“四羊方尊”的主要材质为合金B.长沙走马楼出土的竹木简牍主要成分是纤维素C.蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化D.铜官窑彩瓷是以黏土为主要原料,经高温烧结而成2.下列化学用语表述错误的是A.HClO的电子式:B.中子数为10的氧原子:818OC.NH3分子的VSEPR模型:D.基态N原子的价层电子排布图:3.下列玻璃仪器在相应实验中选用不合理的是A.重结晶法提纯苯甲酸:①②③B.蒸馏法分离CH2Cl2和CCl4:③⑤⑥C.浓硫酸催化乙醇制备乙烯:③⑤D.酸碱滴定法测定NaOH溶液浓度:④⑥4.下列有关物质结构和性质的说法错误的是A.含有手性碳原子的分子叫做手性分子B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点C.酰胺在酸或碱存在并加热的条件下可发生水解反应D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子5.下列有关电极方程式或离子方程式错误的是A.碱性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH-B.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓D.TiCl4加入水中:TiCl4+(x+2)H2O=TiO2·xH2O↓+4H++4Cl-6.日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。
已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。
基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。
下列说法正确的是A.电负性:X>Y>Z>WB.原子半径:X<Y<Z<WC.Y和W的单质都能与水反应生成气体D.Z元素最高价氧化物对应的水化物具有强氧化性7.取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1mol⋅L−1),反应现象没有明显差别的是A.A B.B C.C D.D8.葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:下列说法错误的是A .溴化钠起催化和导电作用B .每生成1mol 葡萄糖酸钙,理论上电路中转移了2mol 电子C .葡萄糖酸能通过分子内反应生成含有六元环状结构的产物D .葡萄糖能发生氧化、还原、取代、加成和消去反应9.处理某铜冶金污水(含Cu 2+、Fe 3+、Zn 2+、Al 3+)的部分流程如下:已知:①溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:②K sp (CuS)=6.4×10−36,K sp (ZnS)=1.6×10−24。
双河中学高一化学选修3学案
3-2(1)分子晶体
自主学习课本P65 -67,完成下列任务:
一、分子晶体:1、分子晶体:①概念:只含___________的晶体,称为分子晶体。
②构成晶体的微粒是___________③晶体内微粒间的作用:分子内原子间__________,相邻分子之间____________④分子晶体的物理性质是:熔点和沸点较______,硬度_______,一般都是绝缘体,熔融态__导电。
2、常见的分子晶体:①所有____________________,如水、硫化氢、氨、氯化氢、甲烷等。
②部分____________________,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60)、稀有气体等。
③部分____________________,如CO2、P4O6、P4O10、SO2等。
④几乎所有的________,如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
⑤绝大多数____________________,如苯、乙醇、乙酸、葡萄糖等。
3、分子晶体的结构特征:
(1) :意思是微粒间的作用力使微粒间尽可能地相互接近,使他们占有最小的空间。
(2) 如果分子间作用力只是
晶体中分子堆积方式为_________,即以一个分子为中心,其周围通常可以有___个紧邻的分子。
如干冰的晶胞结构(如图)。
干冰的结构模型(晶胞)
①每个晶胞中有______个原子。
②每个CO2分子周围等距紧邻的CO2分子有_____个。
(3) 分子间还有其他作用力:①水分子之间的主要作用力是__________,当然也存在_____________。
②氢键有_______性,氢键的存在迫使在___________的每个水分子与____________方向的___个相邻水分子互相吸引。
这一排列使冰晶体中的水分子的空间利用率_______。
水分子中的氢键
【思考与交流】:为什么冰的密度比水的密度小?
二、分子晶体熔沸点高低的判断:
1、分子晶体熔沸点的特点:分子晶体是分子在分子间作用力的作用下形成的晶体,熔化时,只破坏不破坏。
分子晶体的熔、沸点的高低只由分子间作用力决定,而分子间作用力与化学键相比是一种比较弱的作用,所以分子晶体在熔、沸点均。
2、分子晶体熔沸点的判断
(1)少数以氢键作用形成的分子晶体,比一般的分子晶体的熔点,如含有H-F、H-O、H-N等共价键的分子间可以形成,所以HF、H2O、NH3等物质的熔点相对较高。
(2)组成和结构相似,分子之间不含氢键而利用范德华力形成的分子晶体,随着越大,分子间作用力越,物质的熔、沸点就越,如熔、沸点:CH4SiH4GeH4SnH4。
(3)组成和结构不相似的物质(相对分子质量相近或相近),分子极性越,其熔、沸点就越,如熔、沸点:CO N2,CH3OH CH3CH3。
(4)组成和结构相似且不存在氢键的同分异构体所形成的分子晶体,相对分子质量相同,一般支链越,分子间作用力越,熔、沸点,如熔、沸点正戊烷异戊烷新戊烷。
【思考】1、干冰晶体是面心立方结构,如图所示,若干冰晶体的晶胞
棱长为a,则在每个CO2分子周围与其相距2a的CO2分子有()
A、4个
B、8个
C、12个
D、6个
2、下列分子晶体,关于熔沸点高低叙述中,正确的是()
A、Cl2>I2
B、SiCl4>CCl4
C、NH3<PH3
D、C(CH3)4>CH3(CH2)3CH3 【巩固练习】:1、下列叙述不正确的是()
A.由分子构成的物质其熔点一般较低B.分子晶体在熔化时,共价键没有被破坏C.分子晶体中一定存在共价键D.分子晶体中分子间作用力越大,其熔沸点越高
2、分子晶体具有某些特征的本质原因是()
A、组成晶体的基本粒子是分子
B、熔融时不导电
C、晶体内微粒间以分子间作用力相结合
D、熔点一般比比较低
3、下列属于分子晶体的是()
A、熔点1070°C ,易溶于水,水溶液能导电
B、能溶于CS2,熔点112.8°C ,沸点444.6°C
C、熔点1400°C,可做半导体材料
D、熔点97.81°C,质软,导电,密度0.97g·cm-3
4、下列物质的变化过程中,化学键没有被破坏的是()
A、I2升华
B、HCl溶于水得到盐酸
C、从NH4HCO3中闻到了刺激性的气味
D、NaCl固体加热融化
5、干冰熔点很低是由于()
A、CO2是非极性分子
B、C=O键的键能很小
C、CO2化学性质不活泼
D、CO2分子间的作用力较弱
6、下列各组物质中各自形成的晶体,均属于分子晶体的化合物的是()
A、NH3HD C10H8
B、PCl3CO2H2SO4
C、SO2SO3 C60
D、CCl4Na2 S H2O2
7、下列分子晶体:①H2O ②HCl ③HBr ④HI ⑤CO ⑥N2 ⑦H2熔沸点由高到低的顺序是( )
A.①②③④⑤⑥⑦
B.④③②①⑤⑥⑦
C.①④③②⑤⑥⑦
D.⑦⑥⑤④③②①
8、四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是、;杂化轨道分别是、_;a分子的立体结构是。
(2)Y的最高价氧化物的晶体类型分别是晶体
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)。
(4)Y与Z比较,电负性较大的,其+2价离子的核外电子排布式是。