四种晶体类型的比较
- 格式:doc
- 大小:42.50 KB
- 文档页数:3

晶体的四种基本类型和特点晶体是由于原子、分子或离子排列有序而形成的固态物质。
根据晶体的结构特点,晶体可以分为四种基本类型:离子晶体、共价晶体、金属晶体和分子晶体。
1. 离子晶体离子晶体由正离子和负离子通过离子键结合而成。
正负离子之间的电荷吸引力使得离子晶体具有高熔点和脆性。
离子晶体的晶格结构稳定,形成高度有序的排列。
常见的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
离子晶体在溶液中能够导电,但在固态下通常是绝缘体。
2. 共价晶体共价晶体由共价键连接的原子或分子组成。
共价键是由原子间的电子共享形成的,因此共价晶体具有很高的熔点和硬度。
共价晶体的晶格结构复杂多样,具有很高的化学稳定性。
典型的共价晶体包括金刚石(C)和硅(Si)。
共价晶体通常是绝缘体或半导体,由于共价键的稳定性,其导电性较弱。
3. 金属晶体金属晶体由金属原子通过金属键结合而成。
金属键是由金属原子间的电子云形成的,因此金属晶体具有良好的导电性和热传导性。
金属晶体的晶格结构常为紧密堆积或面心立方等紧密排列。
金属晶体的熔点通常较低,而且具有良好的延展性和韧性。
典型的金属晶体有铁(Fe)、铜(Cu)等。
4. 分子晶体分子晶体由分子通过弱相互作用力(如范德华力)结合而成。
分子晶体的晶格结构不规则,分子间的距离和角度较大。
由于分子间的相互作用力较弱,分子晶体通常具有较低的熔点和软硬度。
典型的分子晶体有水(H2O)、冰、石英(SiO2)等。
分子晶体在固态下通常是绝缘体,但某些分子晶体在溶液中能够导电。
总结起来,离子晶体由正负离子通过离子键结合,具有高熔点和脆性;共价晶体由共价键连接,具有高熔点和硬度;金属晶体由金属原子通过金属键结合,具有良好的导电性和热传导性;分子晶体由分子通过弱相互作用力结合,具有较低的熔点和软硬度。
这四种基本类型的晶体在结构、性质和应用上都有明显的差异。
研究晶体的类型和特点对于理解物质的性质和应用具有重要意义。
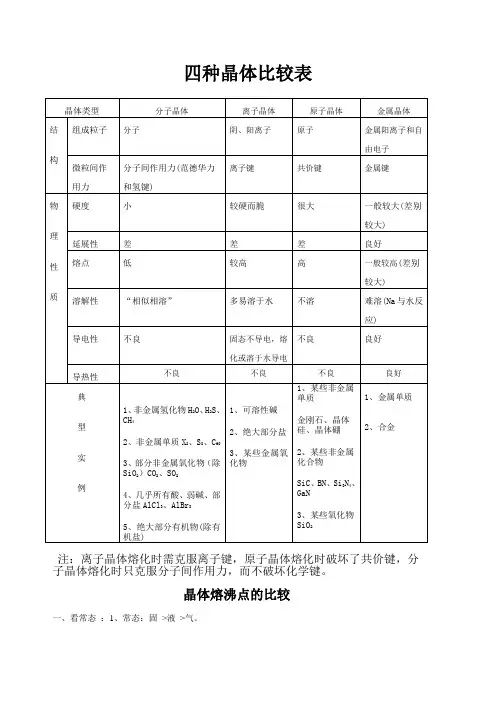
四种晶体比较表注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较一、看常态:1、常态:固>液>气。
2、一般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。
3、原子晶体:共价键(取决于原子半径)。
4、离子晶体:离子键(取决于离子半径和离子电荷)5、金属晶体:金属键(取决于金属原子半径和价电子数)6、分子晶体:①结构相似,分子量越大,熔沸点越高。
②分子量相等,正>异>新。
③氢键反常二、看类型三、分类比较18.请完成下列各题:(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为。
在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。

四种晶体性质比较1.晶体⑴晶体与非晶体⑵得到晶体的途径①熔融态物质凝固。
②气态物质冷却不经液态直接___________________ 。
③溶质从溶液中析出。
⑶晶胞①概念描述晶体结构的基本单元。
②晶体中晶胞的排列一一无隙并置a. _______________________________ 无隙:相邻晶胞之间没有。
b•并置:所有晶胞________ 卡列、取向相同。
⑷晶格能①定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位:__________________ 。
②影响因素a.离子所带电荷数:离子所带电荷数越多,晶格能越大。
一b. ____________________________ 离子的半径:离子的半径晶格能越大。
③与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度_________________ 。
2.四种晶体类型的比较3•晶体熔沸点的比较⑴不同类型晶体熔、沸点的比较①不同类型晶体的熔、沸点高低的一般规律:______________________________ >离子晶体〉_____________________________________ 0②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
⑵同种晶体类型熔、沸点的比较①原子晶体:原子半径越小」—>1键长越短②离子晶体:a•—般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO ____ MgCI 2 ______ N aCl _____ CsCI。
b.衡量离子晶体稳定性的物理量是晶格能。
晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
③分子晶体:a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。
女口H20> H2Te> H2Se> H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,女口Sn H4> GeH4 > SiH4> CH4。

四种晶体的熔沸点
晶体是一种具有有序排列的分子、原子或离子结构的固体。
它们具有一定的熔沸点,也就是在一定的温度下能够融化或沸腾。
以下是四种常见晶体的熔沸点。
1. 钠氯化物晶体:钠氯化物晶体是一种由钠离子和氯离子组成的离子化合物。
它的熔点约为801℃,沸点约为1413℃。
2. 碳晶体:碳晶体是由碳原子组成的晶体,包括金刚石和石墨。
金刚石的熔点非常高,约为3927℃,而石墨的熔点相对较低,约为3730℃。
3. 冰晶体:冰晶体是由水分子组成的晶体。
它的熔点在标准大气压下约为0℃,沸点约为100℃。
4. 硫晶体:硫晶体是由硫原子组成的晶体。
它的熔点约为115℃,沸点约为444℃。
这些晶体的熔沸点与它们的化学结构、分子大小、相互作用力等有关。
熔沸点的知识在材料科学、化学工程等领域中有着广泛的应用。
- 1 -。

高中化学四种晶体熔沸点比较在化学的世界里,晶体的熔点和沸点可真是个有趣的话题,嘿,咱们今天就来聊聊高中化学里那四种晶体的熔沸点比较,听起来是不是很有意思?想象一下,咱们的晶体就像各个性格各异的朋友,有的热情似火,有的冷漠孤傲,有的则温和如水。
好啦,先从离子晶体说起吧。
这种晶体的熔点通常很高,就像不轻易被感动的老顽固,离子之间的静电吸引力可不是盖的。
想象一下,钠和氯一见面就火花四溅,合成了美味的盐,熔点高得让人咋舌,一般得超过800度呢,这可不是一般的朋友关系,真是让人佩服。
咱们再来看看分子晶体,哎呀,这一类就有趣了。
分子晶体像是朋友圈里那种温柔善良的姑娘,平时可爱得不得了,熔点嘛,通常就低得多,像冰淇淋在阳光下融化,唰唰的变得越来越软。
比如说冰,想想看,零下几度就能化成水,真是个容易感动的家伙。
不过,别看她熔点低,分子间的弱相互作用也有她的独特魅力,让人忍不住想要多了解她。
然后,咱们说说金属晶体,这个可真是大块头,铸铁般的坚硬,熔点可高得很,真是威风凛凛。
金属晶体就像个在沙滩上晃荡的大汉,越热越兴奋,熔点动辄就几百度,铁、铜都在其中,热情得让人无可奈何。
金属原子们团结得紧紧的,像兄弟一样,彼此之间的金属键牢不可破,真是让人羡慕的友情。
别忘了网络的主角,晶体管的化学朋友们,网络中的共价晶体。
它们就像一群极为聪明的书呆子,熔点超高,像钻石一样耀眼,硬得让人无从下手。
碳的同素异形体,嘿,真是牛得不要不要的,熔点高得惊人,达到几千度,简直像天上掉下来的明星,闪闪发光。
共价晶体的强大,让人想要一探究竟,真是难得一见的奇珍异宝。
所以说,四种晶体熔沸点的比较就像是一次聚会,大家各显风采,有的高冷、有的温柔、有的热情,还有的闪耀。
每种晶体都有自己的特色,就像每个人都有自己的个性。
这不禁让人思考,化学其实就是这样一个奇妙的世界,各种元素和分子在这里交织碰撞,构成了我们眼前的一切,真是美妙啊!相信只要咱们深入探索,就能发现更多的奥秘和乐趣,化学的魅力无穷无尽,真是让人乐此不疲。


第38讲晶体结构与性质1.晶体和晶胞(1)晶体与非晶体(2)获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
(3)晶胞①概念:描述晶体结构的□11基本单元。
②晶体与晶胞的关系:数量巨大的晶胞“□12无隙并置”构成晶体。
③晶胞中粒子数目的计算——均摊法:如某个粒子为n个晶胞所共有,则该粒子有□131n属于这个晶胞。
2.四种类型晶体的比较3.离子晶体的晶格能(1)定义:气态离子形成1摩尔离子晶体释放的能量,通常取正值,单位:□31kJ·mol -1。
(2)影响因素①离子所带电荷数:离子所带电荷数越□32多,晶格能越□33大。
②离子的半径:离子的半径越□34小,晶格能越□35大。
(3)与离子晶体性质的关系晶格能越大,形成的离子晶体越□36稳定,且熔点越□37高,硬度越□38大。
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)具有规则几何外形的固体一定是晶体。
(×)错因:自发地呈现多面体外形的才是晶体,人为制造出的具有规则几何外形的固体如玻璃、木材、陶瓷等均不是晶体。
(2)冰中包含的作用力有范德华力、氢键和共价键。
(√)错因:__________________________________________________________(3)区分晶体和非晶体最可靠的方法是测定其有无固定熔点。
(×)错因:区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验。
(4)1 mol金刚石和SiO2中含有的共价键数目均为4N A。
(×)错因:1_mol金刚石含有的共价键数目为2N A。
(5)金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子。
(√)错因:__________________________________________________________(6)分子晶体的熔点一定比金属晶体的低。

晶体的五种类型晶体是由原子、分子或离子排列成有序的3D结构所形成的固体物质。
晶体在自然界中广泛存在,并且具有多种不同的类型。
根据晶体的结构和组成,可以将晶体分为五种主要类型,包括离子晶体、共价晶体、金属晶体、分子晶体和纳米晶体。
离子晶体是由正负电荷的离子所组成的晶体结构。
这种类型的晶体通常具有高熔点和硬度,因为离子之间的强静电作用力将离子结合在一起。
离子晶体还具有良好的电导性和光学性能,因此常用于制备电子元件、光学材料和陶瓷材料。
共价晶体是由共价键连接的原子所组成的晶体结构。
共价键是原子之间通过共享电子形成的一种强力化学键。
共价晶体通常具有较高的硬度和熔点,因为共价键的强度和稳定性。
这种类型的晶体在自然界中广泛存在,如钻石、石英和硅等,也用于制备半导体材料和高分子材料。
金属晶体是由金属原子排列而成的晶体结构。
金属晶体具有良好的导电性和导热性,因为金属原子之间通过“海洋模型”形成了自由移动的电子。
金属晶体还具有良好的韧性和延展性,因此广泛应用于制备各种金属制品和合金材料。
分子晶体是由分子之间的分子间力所连接的晶体结构。
这种类型的晶体通常具有较低的熔点和硬度,因为分子间力较弱,并且易于熔化或分解。
分子晶体在自然界中广泛存在,如冰、石蜡和有机化合物等,也用于制备药品、颜料和香料等。
纳米晶体是由纳米尺度的颗粒所组成的晶体结构。
纳米晶体通常具有特殊的物理化学性质,如量子大小效应、表面效应和量子隧穿效应等。
纳米晶体在材料科学和纳米技术中具有重要的应用价值,如纳米材料、纳米传感器和纳米催化剂等。
总结起来,晶体可以分为离子晶体、共价晶体、金属晶体、分子晶体和纳米晶体五种类型。
每种类型的晶体都具有独特的结构和性质,广泛应用于材料科学、化学工程、电子工程和生物医学等领域。
随着科学技术的不断发展,晶体的研究和应用将会得到进一步的推进和拓展。

晶体的五种类型晶体是一种具有有序排列的固体物质,其内部分子或原子以规则的方式排列,并形成具有特定结构和性质的晶格。
根据其结构特点和排列方式的不同,晶体可以分为五种类型:离散晶体、共价晶体、离子晶体、分子晶体和金属晶体。
离散晶体是由小的分子或离子聚集形成的晶体结构,例如硫、碘、氧化镁等。
这类晶体中的分子或离子之间通过范德华力或氢键等弱相互作用力结合在一起,晶体结构相对较松散。
离散晶体通常具有较低的熔点和较低的硬度,且易溶于水或其他溶剂,在常温下大多呈固体状态。
共价晶体是由共价键连接的原子构成的晶体,例如金刚石、石英、硼化硅等。
这类晶体中的原子通过共价键稳定地相互连接,形成密实的晶体结构。
共价晶体通常具有高的硬度和高的熔点,耐腐蚀性强,且具有优良的光学性能和导电性能。
离子晶体是由正负离子构成的晶体,例如氯化钠、氯化钾、氧化镁等。
这类晶体中的正负离子通过电静力相互作用力结合在一起,形成密实的晶体结构。
离子晶体通常具有高的熔点和脆性,且易溶于水或其他极性溶剂,在常温下大多呈固体状态。
分子晶体是由分子构成的晶体,例如冰、硫脲、苯酚等。
这类晶体中的分子通过范德华力或氢键等弱相互作用力结合在一起,形成密实的晶体结构。
分子晶体通常具有较低的熔点和较低的硬度,易溶于非极性溶剂,在常温下大多呈固体状态。
金属晶体是由金属原子构成的晶体,例如铁、铜、铝等。
这类晶体中的金属原子通过金属键相互连接,形成密实的晶体结构。
金属晶体通常具有高的导电性和热传导性,而且具有良好的可塑性和延展性,适用于各种加工成形工艺。
在实际应用中,不同类型的晶体具有不同的物理性质和化学性质,因此也具有不同的用途。
离散晶体常用于化妆品、颜料等工业产品中;共价晶体常用于光学、电子器件等领域;离子晶体常用于药品、冶金等领域;分子晶体常用于农药、染料等领域;金属晶体常用于制造、建筑等领域。
因此,了解晶体的类型和性质对于科学研究和生产应用都具有重要意义。
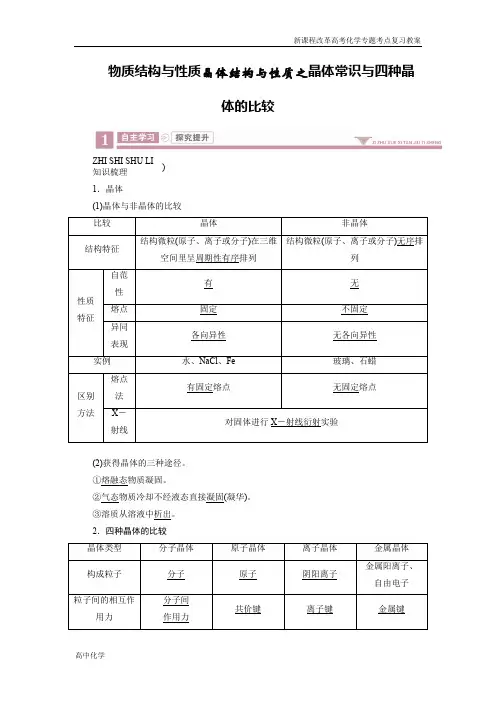
物质结构与性质晶体结构与性质之晶体常识与四种晶体的比较ZHI SHI SHU LI知识梳理 )1.晶体(1)晶体与非晶体的比较(2)获得晶体的三种途径。
①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
2.四种晶体的比较3.晶体类型的5种判断方法(1)依据构成晶体的微粒和微粒间的作用判断。
①离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
②原子晶体的构成微粒是原子,微粒间的作用是共价键。
③分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
④金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
(2)依据物质的分类判断。
①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合物类原子晶体有碳化硅、二氧化硅等。
④金属单质是金属晶体。
(3)依据晶体的熔点判断。
①离子晶体的熔点较高。
②原子晶体的熔点很高。
③分子晶体的熔点低。
④金属晶体多数熔点高,但也有少数熔点相当低。
(4)依据导电性判断。
①离子晶体溶于水及熔融状态时能导电。
②原子晶体一般为非导体。
③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(5)依据硬度和机械性能判断。
①离子晶体硬度较大、硬而脆。
②原子晶体硬度大。
③分子晶体硬度小且较脆。
④金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
4.晶体熔、沸点的比较(1)不同类型晶体熔、沸点的比较。
①不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
四种晶体比较表注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较一、看常态:1、常态:固>液>气.2、一般情况下,原子晶体〉离子晶体(金属晶体)〉分子晶体。
3、原子晶体:共价键(取决于原子半径).4、离子晶体:离子键(取决于离子半径和离子电荷)5、金属晶体:金属键(取决于金属原子半径和价电子数)6、分子晶体:①结构相似,分子量越大, 熔沸点越高。
②分子量相等,正>异〉新。
③氢键反常二、看类型三、分类比较18.请完成下列各题:(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为。
在GaN晶体中,每个Ga 原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体.(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为.。
化学中四种典型晶体的判断
在化学中,晶体是一种具有高度有序排列的结构,其中原子、分子或离子按照特定的规律排列成固体。
常见的晶体有四种类型,分别为离子晶体、共价晶体、分子晶体和金属晶体。
如何判断这四种晶体的类型呢?
一、离子晶体
离子晶体的特点是由阳离子和阴离子通过离子键结合而成。
在晶体中,阳离子和阴离子的比例是固定的,且通常具有高熔点和硬度。
判断离子晶体的方法是观察其化学组成:如果晶体中含有金属和非金属元素,一般可以判断为离子晶体。
二、共价晶体
共价晶体的特点是共用电子对将原子或分子结合在一起。
在共价晶体中,原子或分子的排列方式受到共用电子对的影响,具有高熔点和硬度。
判断共价晶体的方法是观察其化学键类型:如果晶体中含有共价键,一般可以判断为共价晶体。
三、分子晶体
分子晶体的特点是由分子通过范德华力或氢键结合而成。
在晶体中,分子的排列方式是无序的,通常具有较低的熔点和硬度。
判断分子晶体的方法是观察其分子结构:如果晶体中含有分子,一般可以判断为分子晶体。
四、金属晶体
金属晶体的特点是由金属离子通过金属键结合而成。
在晶体中,
金属离子的排列方式是无序的,通常具有高电导率和良好的延展性。
判断金属晶体的方法是观察其化学组成:如果晶体中含有金属元素,一般可以判断为金属晶体。
总之,四种典型晶体的类型可以通过观察其化学组成、化学键类型和分子结构来进行判断。
熟练掌握这些方法,可以更好地理解和应用化学知识。
四种晶体类型的比较
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:
1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。
例如:NaBr(固)>Br2>HBr(气)。
2、不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰
3、同种类型晶体的比较规律
A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价
键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C —C<C —Si< Si —Si ,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B 、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。
KF >KCl >KBr >KI ,CaO >KCl 。
C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na <Mg <Al ,Li>Na>K 。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。
如铝硅合金<纯铝(或纯硅)。
D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。
分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
(具有氢键的分子晶体,熔沸点反常地高)
如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH 4<SiH 4<GeH 4<SnH 4。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸
点升高,如C 2H 6>CH 4, C 2H 5Cl >CH 3Cl ,CH 3COOH >HCOOH 。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。
如:
CH 3(CH 2)3CH 3 (正)>CH 3CH 2CH(CH 3)2(异)>(CH 3)4C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低)
针对性训练
一、选择题
1.下列性质中,可以证明某化合物内一定存在离子键的是( )
(A )溶于水 (B )有较高的熔点 (C )水溶液能导电 (D )熔融状态能导电 2.下列物质中,含有极性键的离子化合是( )
(A )CaCl 2 (B )Na 2O 2 (C )NaOH (D )K 2S
3.Cs 是IA 族元素,F 是VIIA 族元素,估计Cs 和F 形成的化合物可能是( ) (A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体 4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( )
(A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3
6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( )
(A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体
7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( )
(A )3
8a N m A g·cm -3
(B )A
N Ma 83
g·cm -3
(C )3
a N M A g·cm -3
(D )A
N Ma 3
g·cm -3。