实验十 钙镁离子浓度测定实验
- 格式:doc
- 大小:46.00 KB
- 文档页数:3

钙镁离子的测定一、前言钙镁离子在很多领域中都有着重要的应用,如农业中的土壤肥料、医学中的补钙镁剂以及家庭中的饮用水等。
因此对钙和镁离子的测定具有重要意义。
本文将阐述钙镁离子的测定方法及其原理。
二、钙镁离子的分析方法分析方法包括标准曲线法、滴定法、络合滴定法、原子吸收光谱法、离子选择性电极法、荧光光度法等多种方法。
1、标准曲线法标准曲线法是一种常用的分析方法,它的原理是建立钙镁离子浓度与测得的吸收光强(或荧光强度)之间的线性关系,并以标准曲线的方式来计算未知样品的浓度。
该方法精度高、灵敏度好、准确性高、操作简便。
2、滴定法滴定法是利用定量滴加标准试剂使被测样品与试剂发生反应,从而测定被测物质的数量。
对于钙镁离子的测定,可以使用酸碱滴定法、络合滴定法等。
这种方法主要是适用于含钙镁离子浓度较高的样品中的测定。
络合滴定法是利用配体与金属离子形成稳定的络合物的原理测定金属离子浓度的一种方法。
它与滴定法的不同之处是滴加的试剂是一种配体,滴加过程中反应生成的络合物与遗留下的金属离子达到平衡,在一定条件下会使反应体系达到最大吸光度或最大荧光强度。
通过比较标准系列标准溶液与样品的最大反应值以及受测样品中络合物的数量,即可计算出样品中钙镁离子的浓度。
4、离子选择性电极法离子选择性电极法是利用选择性离子电极与特定离子间的选择性作用,测定样品中指定离子的浓度的一种方法。
反应体系最后通过电动势(电压)来表示,因此该方法极为准确。
常见用于钙镁离子测定的是阳离子选择性电极法。
5、原子吸收光谱法原子吸收光谱法是一种测定样品中某些金属元素含量的方法,该方法的原理是利用吸收特定波长的光后,原子重新排列,同时释放出吸收光的能量。
该方法不仅适用于分析钙、镁等元素,还适用于分析其他元素浓度的测定。
6、荧光光度法荧光光度法是一种通过荧光强度来间接推算出样品中某些物质浓度的方法。
该方法广泛用于测定含镁的生物分子。
其原理是利用激光或者其他光源使样品激发,使样品中的分子从激发态向基态跃迁放出特定波长的光,测定出单元分子中某些结构组分的荧光强度,以此计算出样品中钙镁离子的浓度。

MM_FS_CNG_0303制盐工业钙镁离子容量法光度法〈适用于微量钙、镁离子的测定)MM_FS_CNG_0303制盐工业通用实验方法钙和镁离子的测定1.适用范围本方法适用于制盐工业中工业盐、食用盐(海盐、湖盐、矿盐、精制盐)、氯化钾、工业氯化镁试样中钙、镁离子含量的测定。
b5E2RGbCAP 2.容量法1.1.镁离子含量的测定1.1.1.原理概要样品溶液调至碱性<pH^10),用EDTA标准溶液滴定,测定钙离子和镁离子的总量,然后从总量中减去钙离子量即为镁离子量。
p1EanqFDPw 2.1.2.主要试剂和仪器1.1.1.1.试剂氨-氯化铵缓冲溶液<pH' 10)称取20g氯化铵,以无二氧化碳水溶解,加入100mL25%氨水,用水稀释至1L。
铭黑T: 0.2%溶液称取0.2g铭黑T和2g盐酸羟胺,溶于无水乙醇中,用无水乙醇稀释至100mL,贮于棕色瓶内;三乙醇胺:10%溶液;氧化锌:标准溶液称取0.8139g 于800±2℃灼烧恒重的氧化锌,置于150mL 烧杯中,用 少量水润湿,滴加盐酸<1 : 2)至全部溶解,移入500mL 容量瓶,加水稀 释至刻度,摇匀;DXDiTa9E3d乙二胺四乙酸二钠代口1人):0.02mol/L 标准溶液配制:称取40g 二水合乙二胺四乙酸二钠,溶于不含二氧化碳水中, 稀释至5L,混匀,贮于棕色瓶中备用;标定:吸取20.00mL 氧化锌标准溶液,置于150mL 烧杯中,加入5mL 氨性缓冲溶液,4滴铭黑T 指示剂,然后用0.02mol/L EDTA 标准溶液滴 定至溶液由酒红色变为亮蓝色为止。
RTCrpUDGiT计算:EDTA 标准溶液对镁离子的滴定度按式<1)计算。
式中:TEDTA / Mg2 + ——EDTA 标准溶液对镁离子的滴定度,g / mL ;V ——EDTA 标准溶液的用量,mL ;W ——称取氧化锌的质量,g ;0.2987——氧化锌换算为镁离子的系数。

自来水总硬度及钙镁离子含量的测定一、实验目的1、练习移液管、滴定管的使用;2、学会EDTA 法测定水的总硬度的原理和方法;3、掌握铬黑T 指示剂及钙指示剂的应用及指示剂终点的原理;4、了解金属指示剂的特点5、掌握配位滴定过程,突跃范围及指示剂的选择原理。
二、实验原理滴定前:Mg 2+ + HIn 2-←→ [MgIn]- + H +纯蓝色酒红色化学计量点前:Ca 2+ + H 2Y 2-←→[CaY]2- + 2H +Mg 2+ + H 2Y 2-←→[MgY]2- + 2H +化学计量点时: [MgIn]- + H2Y 2-←→ [MgY]2- + HIn - + H+酒红色纯蓝色根据消耗的EDTA 标准溶液的体积V 1 计算水的总硬度。
三、实验用品:四、实验步骤1. 水的总硬度测定用移液管移取水样, 置于250ml 锥形瓶中, 加5ml pH=10的NH 3·H 20-NH 4Cl 缓冲溶液, 加铅黑T 指示剂约( 或溶液 5 滴), 用EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色, 记下EDTA 用量V 1。
平行测定3 次。
计算水的总硬度。
101100010Vs CaOM EDTA V EDTA C d (备注:一升水中含有10mg 氧化钙为1度—德国度)3. 钙和镁含量的测定另取取水样, 置于锥形瓶,加10%氢氧化钠5ml,加钙指示剂少许( 约, 用EDTA 标准溶液滴定至溶液由红色变为纯蓝色, 记录EDTA 用量V 2。
平行测定 3 次。
计算水中钙和镁的质量浓度。
VsCaM V EDTA c Ca 2(g/L )Vs Mg M V V EDTA c Mg 21(g/L )。

实验10 建筑材料石灰中钙镁含量测定教学目的与要求:1.学习盐酸直接滴定法测定钙镁含量的原理和方法;2.了解络合滴定法测定钙镁含量的原理和方法;3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;4.进一步熟练掌握滴定操作;5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:重点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.培养学生的动手操作能力及创新意识。
难点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.盐酸直接滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:898℃问题1:石灰有哪些用途?首先,概括一下在建筑、农业、工业上的用途,其中的熟石灰功不可没。
建筑:三合土、石灰浆(Ca(OH)2+CO2=CaCO3↓+H2O)。
农业:配制波尔多液作为农药(Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓)。
将适量的熟石灰加入土壤,可以中和酸性,改变土壤的酸碱性。
工业:制氢氧化钠(Ca(OH)2+Na2CO3=CaCO3↓+2NaOH)。
配制价格低廉的漂白粉(Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O)。
问题2:石灰的主要成分有哪些?石灰的主要成分是氧化钙(CaO),其次为氧化镁(MgO)。
问题3:建筑用石灰有哪些?建筑用石灰有:生石灰(块灰),生石灰粉,熟石灰粉(又称建筑消石灰粉、消解石灰粉、水化石灰)和石灰膏等几种形态。
问题4:测定石灰中钙镁含量的意义?根据石灰中钙、镁含量的高低,可以判断石灰的质量等级,并根据其含量计算其参加量,有效地利用资源。
问题5:测定石灰中钙镁含量的方法有哪些?测钙的方法:配位滴定法、酸碱滴定法(返滴定法和直接滴定法)、间接滴定法。
配位滴定法:酸碱滴定法:1、返滴定法:用过量的盐酸标准溶液直接滴在碳酸钙样品上,剩余的盐酸用标准氢氧化钠溶液滴定;2、直接滴定法:T0811-1994.(p35)间接滴定法:将CaCO3转化为CaC2CO4后,用H2SO4溶解,再用KMnO4标准溶液滴定,把C2O42-氧化为CO2,当把C2O42-氧化完全后,滴入的KMnO4溶液不再褪色。

仪器分析实验报告
实验名称:利用原子吸收测量水中的钙、镁含量
一、实验内容
1、学习标准曲线的绘制,并测定未知溶液
2、学习原子吸收仪器的使用和注意事项
二、实验步骤
实验一:水中Ca浓度的测定
用浓度为100mg/L的钙标准溶液配制浓度分别为2.0、4.0、6.0、8.0、10.0mg/L 的溶液,即分别取1、2、3、4、5ml的标准液定容至50ml。
再取自来水3-4ml定
容至50ml测钙的浓度
实验二:水中Mg浓度的测定
用浓度为50,mg/L的镁标准溶液配制浓度分别为0.1、0.2、0.3、0.4、0.5mg/L 的溶液,即分别取0.1、0.2、0.3、0.4、0.5ml的标准溶液定容至50mL。
再取自
来水0.4ml定容至50ml测量水中镁的浓度
三、数据统计
标准曲线:
计算数据:
表一 Ca、Mg含量
项目浓度/mg/L 项目浓度/mg/L
水中Ca 52.8039 水中Mg 19.5750
未知Ca溶液 4.1935 未知Mg溶液 0.3353 四、数据分析
绘制标准曲线的关键是溶液的配制,在定容和取标准溶液时要尽量准确、精密。
定容过程应由同一人完成,尽量减小误差。

水中钙镁离子含量的测定
水中钙镁离子含量的测定可以通过以下步骤进行:
1. 采集水样:在需要测试的地方采集水样,将其放入干净的容器中。
2. 准备试剂:准备一定量的硝酸铵(NH4NO3)、乙二胺四乙酸(EDTA)和卡钠(Calcein Na)试剂。
3. 样品前处理:将采集到的水样用玻璃棒充分搅拌,以保证样品均匀。
根据所需样品量,取少量水样置于锥形瓶中。
4. 钙镁离子络合反应:分别取两个锥形瓶,其中一个加入所需量的硝酸铵溶液,另一个加入乙二胺四乙酸(EDTA)溶液。
然后将两个瓶中溶液混合均匀。
5. 添加指示剂:将卡钠试剂溶解于适量去离子水中,然后滴加到混合溶液中。
搅拌均匀,使溶液发生橙黄色变化。
6. 加标法测定:取一定量的钙标准溶液,加入到产生橙黄色的溶液中。
继续滴加卡钠试剂,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
7. 测定样品:将步骤6中记录的钙标准溶液体积作为参考,再分别对未加标样品和标准样品进行滴定,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
8. 计算钙镁离子含量:根据滴定过程中钙标准溶液的使用量,以及水样中的滴定用量,通过计算可以得到水样中钙镁离子的含量。
9. 结果分析:根据计算结果,可以得出水中钙镁离子含量的浓度。

——EDTA滴定法9.4.1.1 方法原理EDTA能与许多金属离子Mn、Cu、Zn、Ni、Co、Ba、Sr、Ca、Mg、Fe、Al等起配合反应,形成微离解的无色稳定性配合物。
但在土壤水溶液中除Ca2+和Mg2+外,能与EDTA配合的其它金属离子的数量极少,可不考虑。
因而可用EDTA在pH10时直接测定Ca2+和Mg2+的数量。
干忧离子加掩蔽剂消除,待测液中Mn、Fe、Al等金属含量多时,可加三乙醇胺掩蔽。
1:5的三乙醇胺溶液2mL能掩蔽5~10mgFe、10mgAl、4mgMn。
当待测液中含有大量CO2-3或HCO-3时,应预先酸化,加热除去CO2,否则用NaOH溶液调节待测溶液pH到12以上时会有CaCO3沉淀形成,用EDTA滴定时,由于CaCO3逐渐离解而使滴定终点拖长。
当单独测定Ca时,如果待测液含Mg2+超过Ca2+的5倍,用EDTA滴Ca2+时应先稍加过量的EDTA,使Ca2+先和EDTA配合,防止碱化时形成的Mg(OH)2沉淀对Ca2+吸附。
最后再用CaCl2标准溶液回滴过量EDTA。
单独测定Ca时,使用的指示剂有紫尿酸铵,钙指示剂(NN)或酸性铬蓝K等。
测定Ca、Mg含量时使用的指示剂有铬黑T,酸性铬蓝K等。
9.4.1.2 主要仪器 磁搅拌器 10mL半微量滴定管9.4.1.3 试剂(1) 4 mol·L-1的氢氧化钠溶液:溶解氢氧化钠40g于水中,稀释至250mL,贮塑料瓶中备用。
(2) 铬黑T指示剂:溶解铬黑T 0.2g于50mL甲醇中,贮于棕色瓶中备用,此液每月配制一次。
或者溶解铬黑T 0.2g于50mL二乙醇胺中,贮于棕色瓶,这样配制的溶液比较稳定,可用数月。
或者称铬黑T 0.5g与干燥分析纯NaCl 100g共同研细,贮于棕色瓶中,用毕即刻盖好,可长期使用。
(3) 酸性铬蓝K+萘酚绿B混合指示剂(K-B指示剂):称取酸性铬蓝K 0.5g和萘酚绿B 1g与干燥分析纯NaCl 100g共同研磨成细粉,贮于棕色瓶中或塑料瓶中,用毕即刻盖好。

钙镁离子的测定
本文应用海能T890自动电位滴定仪,采用直接连续滴定钙镁离子。
1仪器与试剂
海能T890自动电位滴定仪;
钙离子选择性电极;212参比电极
0.0504mol/L EDTA标准溶液
辅助配位试剂溶液溶液:0.035mol/L三羟基氨基甲烷(TRIS)—0.055mol/L 乙酰丙酮(HAA)溶液。
2滴定原理
EDTA滴定ca+、mg2+离子混合溶液时,可分别得到钙、镁的滴定终点。
由于络合中平衡常数的不同在辅助配位溶液条件下,钙、镁离子可以被分别滴定出来。
滴定开始时,mg2+首先与HAA络合生成mg(AA)2,当加入EDTA时,ca2+首先与EDTA反应,当ca2+反应完时,出现第一个电位突越点(ep1)。
继续添加EDTA则EDTA将与mg(AA)2中的mg2+反应,当反应完全时,将出现第二个电位突越点。
其中第一个突越点对应的是钙的含量,第二个电位突越点与第一个电位突越点的差值对应的是镁的含量,从而实现混合溶液中Ca2+、Mg2+离子的连续滴定。
2实验方法
称取一定质量(由于样品中含有的钙镁浓度未知,所以推荐配置几种不同浓度的溶液进行测量看试验效果)的样品用去离子水稀释定容到500ml 用移液管准确量取50ml待测液于滴定杯中,加入20ml辅助配位溶液,将电极插入到溶液中,连接到T890电位滴定仪,设定好参数开始滴定。
做实验空白。
电位滴定曲线。

FCLHSTKSHCaMg004铁矿─ 钙镁含量的测定─ EDTA滴定法 1 范围 本推荐方法用三乙醇胺半胱氨酸等将干扰元素掩蔽镁含量铁精矿镁含量的测定氢氟酸分解分取部分溶液镁用三乙醇胺及L将铁锰等干扰元素掩蔽14用EDTA标准溶液滴定钙量加酒石酸用氨水调节pH8放置待沉淀出现后再用氨水调至pH10萘酚绿为指示剂镁合量镁合量消耗的EDTA标准溶液的体积求得镁量1+13.3 三乙醇胺 3.4 氢氧化钠溶液 3.5 硫酸镁溶液 3.6 三氯甲烷羟基(24磺酸与100g预先在1052h的氯化钠研细贮存在棕色瓶中并置于干燥器中保存萘酚绿B指示剂 称取1g酸性铬蓝K和1g萘酚绿B烘干1 ̄2h的硫酸钾研细贮存在磨口瓶中烘干1 ̄2h的氯化钠研细 3.10 L10g/L 称取1g半胱氨酸溶于100mL水中混匀pH10 称取54g氯化铵溶于水中用水稀释至1000mL0.01000mol/L 称取0.6538g金属锌[99.9%(m/m)以上]于烧杯中取下冷至室温用水稀释至刻度中国分析网3.13 EDTA标准溶液O)用适量水溶解2H2用水稀释至1000mL 3.13.2 标定 分取10.00mL锌标准溶液三份用水稀释至100mL10mL氨性缓冲溶液用EDTA标准溶液滴定至溶液由红色变为亮蓝色为终点 c1mol/L c1分取锌标准溶液的体积 VmL2滴定试剂空白消耗EDTA标准溶液的体积 4 操作步骤 4.1 称样 称取0.50g试样 4.2 空白试验 随同试样做空白试验于玻璃烧杯中加盐酸溶解即可)加热溶解继续加热至试样完全溶解10mL高氯酸3min移入玻璃杯中5min加10mL盐酸(1+1)加热溶解盐类移入250mL容量瓶中混匀分别置于500mL维形瓶中 于一份溶液中1514半胱氨酸溶液(10g/L)(每加一种试剂都要搅拌均匀后加0.1g钙指示剂用EDTA标准溶液滴定至溶液由红色变为亮兰色为终点 于另一份溶液中4g酒石酸钾钠加10mL三乙醇胺(1+1)加5mL氢氧化钠(200g/L)调至pH8充分摇动时30沉淀形成后振动20待分层后20mL氨水调至PH10萘酚绿B记下读数(V)若试样中锰含量小于1%(m/m)此时5可不加三氯甲烷萃取若含锰高时在300mL左右进行以质量分数表示(V3-V03) 40.081000 wCa = ─────────── V4 式中EDTA标准溶液的浓度 V3mL滴定试剂空白中钙消耗EDTA标准溶液的体积 V4mL试样溶液的总体积 mg钙的摩尔质量 按下式计算镁含量 cV 100 m cmol/L滴定钙mL滴定钙mL滴定试样中钙消耗EDTA标准溶液的体积 V03mL分取试样溶液的体积 VmL称取试样的质量,g镁的摩尔质量中国分析网。

工业用水中钙镁含量的测定实验结论工业用水中钙镁含量的测定是广大工业生产中的一项重要工作。
钙和镁是地壳中的两种常见金属元素,它们广泛存在于水体和土壤中。
工业用水中钙镁含量的测定可以帮助工业生产单位掌握水质情况,合理配置水资源,保证生产顺利进行。
本文将围绕工业用水中钙镁含量的测定实验进行讨论,探究其实验结论。
测定钙镁含量的方法主要有多种,如滴定法、分光光度法、原子吸收光谱法等。
其中滴定法是较常用的一种方法,下面将以滴定法为例进行实验讨论。
在实验中,我们通常采用EDTA容量法测定钙镁含量。
滴定前首先需要用硬度指示剂进行判定,该指示剂会与镁离子和钙离子相结合,形成稳定的络合物。
然后用标准EDTA溶液进行滴定,直至指示剂颜色转变,这时滴定到了等量点。
等量点时,EDTA与钙离子和镁离子形成稳定的络合物,指示剂的颜色会发生变化,由红色变为蓝色。
通过记录滴定所耗EDTA溶液的体积,可以计算出钙镁含量。
实验结论包括以下几个方面:1.实验过程中需要注意的事项:实验过程中,应严格控制实验条件以提高实验的准确性和可重复性。
首先要注意水样的取样方法和保存方式,避免水样受外界污染。
其次,应选择合适的硬度指示剂和EDTA滴定剂,同时应保证所有试剂的纯度和浓度。
另外,滴定时需要准确记录所耗EDTA溶液的体积,避免出现误差。
2.钙镁含量的测定结果:通过实验的滴定过程,可以得到钙镁含量的测定结果。
测定结果一般以mg/L的形式表示。
不同的工业生产单位对钙镁含量的要求不同,一般来说,高纯水要求钙镁含量较低,一般都在数十mg/L以下。
而一些特殊工业用水,如电力、造纸等,可能对钙镁含量有更高的要求。
3.钙镁的溶解性对工业生产的影响:钙镁是地壳中的两种常见金属元素,它们的存在会对水质产生一定的影响。
如果工业用水中钙镁含量过高,会引起水垢的生成,堵塞管道和设备,导致设备的积垢和堵塞,降低生产效率,增加维护成本。
此外,高钙镁含量的水对一些工业生产过程也有一定影响,如造纸过程中容易形成浆石和显像石,影响造纸品质。
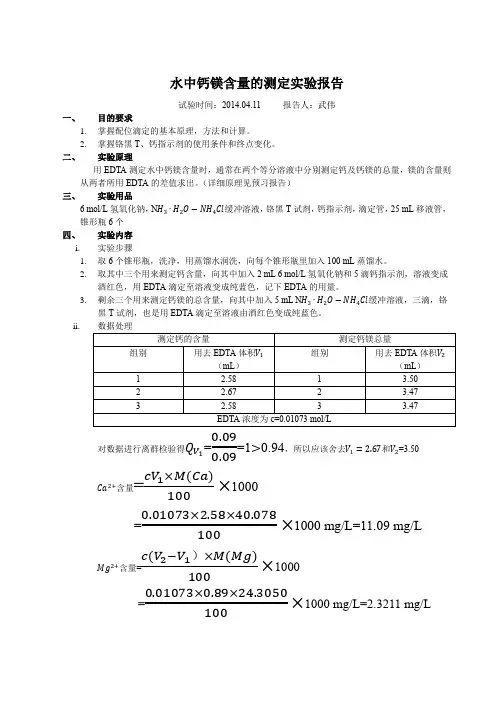
实验十水中钙镁离子含量的测定一、目的:1、掌握EDTA法测定水中钙镁离子含量的原理和方法。
2、熟悉EBT和钙指示剂的应用。
二、原理:1、总硬度测定原理在PH=10的溶液中以EBT为指示剂,用EDTA滴定,EDTA首先与Ca2+离子配合,然后与Mg2+配合,方程式如下:H2Y2-+Ca2+←→CaY2-+2H+H2Y2-+Mg2+←→MgY2-+2H+到达终点时,由于lgK MgY>lgK MgIn稍微过量的EDTA就会从MgIn-中夺取Mg2+,反应式如下:MgIn-+H2Y2-←→MgY2-+HIn2-+H+(EDTA滴定Mg2+允许的最小PH值为:logαY(H)=8.63-8=0.63 PH9.5~10.0lgαY(H)=10.69-8=2.69 PH7.5~8.0)2、钙硬度测定原理:用NaOH调节水样PH=12.5,使Mg2+→Mg(OH)2↓,以钙指示剂确定终点,用EDTA滴定至由红→蓝。
Ca2++HIn2-=CaIn-+H+(红色)Ca2++H2Y2-=CaY2-+2H+终点时: CaIn-+H2Y2-=CaY2-+HIn2-+H+红蓝三、试剂:EDTA标溶液(稀释至约0.005mol·L-1)、氨性缓冲液(PH=10.0)、10%的NaOH(或2mol·L-NaOH)EBT、钙指示剂四、步骤:1、Ca2+、Mg2+总含量的测定。
100ml水样+5ml缓冲液,滴加EBT 2~3滴用EDTA滴定,到终点时溶液由酒红色变为蓝色,记下V EDTA平行三次(如果水样中Mg2+的含量很低,可事先在EDTA中加入少量Mg2+提高变色点的敏锐性)2、Ca2+含量的测定100mL水样+10%NaOH 8~10mL+钙指示剂(摇匀后再加)由酒红色滴定至蓝色,平行三次。
五、数据及结果计算:计算公式:总硬度(相当于CaO的含量)1L水中含CaO10mg相当于1度。
M CaO=0.056g·mmol-1总硬度=[(V1EDTA·C EDTA)M CaO/(V水样×10)]×1000×1000毫摩尔硬度换算 1000ml 换算成mg钙硬度=[(C EDTA V EDTA M CaO)/(V水样×10)]×1000×1000六、讨论:1、水样中含有Ca、Mg离子时测定Ca2+的含量为什么要加入NaOH溶液?能用EBT作指示剂吗、为什么?2、分析个人的操作误差。
钙、镁离子浓度滴定镁离子浓度滴定法一、所需试剂与配制:1、钙黄绿素-酚酞混合指示剂:1)0.2g钙绿黄素+0.07g酚酞置于玻璃研钵2)加20克氯化钾研细摇匀,贮于磨口瓶中。
2、1+3三乙醇胺:25ml三乙醇胺+75ml UP水,混合均匀后倒入100ml容量瓶。
3、0.01M氢氧化钠溶液:0.04g NaOH粉末溶于100ml UP水4、0.5M氢氧化钠溶液:2g NaOH粉末溶于100ml UP水5、0.0125M EDTA溶液:1)称取4.65克分析纯EDTA粉末溶于100ml UP水2)加入24mL 0.5M氢氧化钠溶液(调节溶液的PH=7)3)加UP水,稀释至1L,此时浓度为0.0125mol/L6、CaCl2标准液(Ca2+ 1mg/ml) :称取1.39g无水CaCl2,溶于500ml UP水,此时Ca2+浓度为1.0018mg/ml。
二、标准液标定:1、取10ml CaCl2标准液于250ml的锥形瓶内。
2、向锥形瓶内加入50ml UP水。
3、加入3mL 0.5M氢氧化钠(调节PH值到12.4)。
4、加入约0.02g钙黄绿素—酚酞混合指示剂5、用50mL滴定管在黑色背景下用EDTA标准溶液滴定6、溶液的黄绿色荧光突然消失并出现红色时即为终点。
记录标液消耗的体积V0。
三、样品溶液滴定:3.1钙、镁离子总量滴定1、估算待测液钙离子浓度,将其浓度稀释到2.5g/L之内。
并记录稀释比例K2、取10ml待测溶液于250ml的锥形瓶内。
3、向锥形瓶内加入50ml UP水。
4、加入5ml三乙醇胺溶液,摇匀。
5、加入0.6mL 0.01M氢氧化钠(调节PH值到10)6、加入0.02g钙黄绿素—酚酞混合指示剂7、用50mL滴定管在黑色背景下用EDTA标准溶液滴定8、溶液的黄绿色荧光突然消失并出现红色时即为终点。
记录此时消耗的体积V1 3.2钙离子总量滴定1、估算待测液钙离子浓度,将其浓度稀释到2.5g/L之内。
大庆石油学院学生实验报告2012 年 10 月 11日 学 院 化学化工学院班级 化学10-2班 姓名 范建伟 学号 100302240215 实验名称油田采收液中钙,镁离子含量的测定 一 实验目的1了解油田水中+2Ca ,+2Mg 的测定方法。
2了解水硬度的概念。
二 实验原理+2Mg +铬黑T →Mg-铬黑T (酒红色)Mg-铬黑T+EDTA →Mg-EDTA+铬黑T (纯蓝色)+2Ca +铬黑T →Ca-铬黑T(酒红色)Ca-铬黑T+EDTA →Ca-EDTA+铬黑T (纯蓝色)+2Ca +钙指示剂→Ca-钙指示剂(酒红色)Ca-钙指示剂+EDTA →Ca-EDTA+钙指示剂(纯蓝色)三 实验步骤1 EDTA 溶液的标定称取MgO 0.10-0.12g 至小烧杯中,滴61-∙L moL HCl 至溶解,定量转移至250moL 容量瓶,稀释定 容摇匀备用。
移取该溶液25.00mL 至250mL 锥形瓶,加甲基红1滴,用6M 氨水调节至黄色,加入PH=10缓冲10mL,加入铬黑T3滴,用EDTA 溶液滴定溶液至纯蓝色。
2 水样中总硬度的测定(1)移取上述EDTA 溶液25.00mL 至100mL 容量瓶,稀释定容备用。
(2)移取水样(干过滤后)50.00mL 至250mL 容量瓶,加入PH=10缓冲溶液5mL ,加入铬黑T 3滴, 用稀释后的EDTA 溶液滴定溶液至纯蓝色。
3水样中Ca 硬度的测定移取水样(干过滤后)50.00mL 至250mL 容量瓶,加入10%NaOH 溶液5mL ,加入钙指示剂少量,用稀释后溶液滴定溶液至纯蓝色。
四 结果与讨论1数据记录m MgO 1003.0= EDTA 标定10.08mL 10.06mL第一次组 第二组 Ca 2+、Mg 2+总量测定V0 = 5.02 ml V1 =5.00 ml Ca 2+含量测定 V2 = 2.55ml V3 = 2.50 ml2计算公式molg M molg M CaO MgO /0778.56/303.40==1000101⨯⨯=EDTA MgO MgOEDTA V M m c1000c 41))mg a a 1⨯⨯⨯⨯=∙-水样(硬度(V M V L O C O C EDTA EDTA 结果计算: =EDTA c 0.02471-∙L moL水样中总硬度=34.711-∙L mg水样中Ca 硬度=17.501-∙L mg3讨论1滴定结束时锥形瓶内所呈现的颜色不一致,导致所读数据有误差 2明确操作步骤,注意操作范围,注意一些试剂的滴加顺序和范围。
水的总硬度及钙镁含量的测定【定义】水的硬度最初是指钙、镁离子沉淀肥皂的能力。
水的总硬度指水中钙、镁离子的总浓度,其中包括碳酸盐硬度(即通过加热能以碳酸盐形式沉淀下来的钙、镁离子,故又叫暂时硬度)和非碳酸盐硬度(即加热后不能沉淀下来的那部分钙、镁离子,又称永久硬度)。
硬度的表示方法硬度的表示方法尚未统一,目前我国使用较多的表示方法有两种:一种是将所测得的钙、镁折算成CaO的质量,即每升水中含有CaO的毫克数表示,单位为mg·L—1;另一种以度(°)计:1硬度单位表示10万份水中含1份CaO(即每升水中含10mgCaO),1°=10ppm CaO。
这种硬度的表示方法称作德国度.【工业用水和生活饮用水对水的硬度的要求】我国生活饮用水卫生标准规定以CaCO3计的硬度不得超过450mg·L-1。
钙镁总量的测定方法在一份水样中加入pH=10。
0的氨性缓冲溶液和少许铬黑T指示剂,溶液呈红色;用EDTA标准溶液滴定时,EDTA先与游离的Ca2+配位,再与Mg2+配位;在计量点时,EDTA从MgIn-中夺取Mg2+,从而使指示剂游离出来,溶液的颜色由红变为纯蓝,即为终点。
注意:当水样中Mg2+极少时,由于CaIn-比MgIn—的显色灵敏度要差很多,往往得不到敏锐的终点。
为了提高终点变色的敏锐性,可在EDTA标准溶液中加入适量的Mg2+(在EDTA标定前加入,这样就不影响EDTA与被测离子之间的滴定定量关系),或在缓冲溶液中加入一定量的Mg—EDTA盐。
水的总硬度可由EDTA标准溶液的浓度cEDTA和消耗体积V1(ml)来计算。
以CaO计,单位为mg/L.ρCaO=cEDTA*V1*MCaO/Vs*1000水中钙含量的测定另取一份水样,用NaOH调至pH=12.0,此时Mg2+生成Mg(OH)2沉淀,不干扰Ca2+的测定。
加入少量钙指示剂,溶液呈红色;用EDTA标准溶液滴定至溶液由红色变为蓝色即为终点,所消耗的EDTA的体积为V2(EDTA),则Ca2+的质量浓度(mg·L—1 )可用下式计算:ρCaO=cEDTA*V2*MCaO/Vs*1000镁含量=总硬度—钙含量水中溶解氧的测定碘量法一、实验原理水中溶解氧的测定,一般用碘量法。
配位滴定法测定钙、镁配位滴定法测定钙、镁一、方法原理EDTA滴定,Ca2 ,Mg2 的方法很多,通常根据被测物质复杂程度的不同而采用不同的分析方法。
本实验采用直接滴定法。
调节试液的pH≈10,用EDTA滴定Ca2 ,Mg2 总量,此时Ca2 ,Mg2 均与EDTA形式1:1配合物。
H2Y2- Ca2 == CaY2- 2HH2Y2- Mg2 == MgY2- 2H滴定时以铬黑T为指示剂,在pH≈10的缓冲溶液中,指示剂与Ca2 ,Mg2 生成紫红色配合物,当用EDTA滴定到化学计量点时,游离出指示剂溶液显蓝色。
另取一份试液,调节pH≈12,此时Mg2 生成Mg(OH)2沉淀,故可以用EDTA单独滴定Ca2 。
当试液中Mg2 的含量较高时,形成大量的Mg(OH)2沉淀吸附钙,从而使钙的结果偏低,镁的结果偏高,加入糊精可基本消除吸附现象。
滴定时溶液中Fe3 ,Al3 等干扰测定,可用三乙醇胺掩蔽。
Cu2 ,Zn2 ,Pb2 等的干扰可用Na2S 或KCN掩蔽。
二、主要试剂⒈EDTA溶液:0.02mol/L。
称取EDTA二钠盐(Na2H2Y·2H2O)4g于250mL烧杯中,用50mL水微热溶解后稀释至500mL。
如溶液需久置,最好将溶液存于聚乙烯瓶中。
⒉氨—氯化铵缓冲溶液:称取固体氯化铵67g,溶于少量水中,加浓氨水570mL,用水稀释至1L。
⒊盐酸溶液:1:1。
⒋氢氧化钠溶液:20%。
⒌铬黑T指示剂:0.5g铬黑T和50g氯化钠研细混匀。
⒍钙指示剂:0.5g钙指示剂和50g氯化钠研细混匀。
三、分析步骤⒈0.02mol/L EDTA溶液的标定。
标定EDTA溶液的基准物质很多,为了减少方法误差,故选用基准CaCO3进行标定,其方法如下:准确称取基准CaCO3(110℃烘2小时)0.5~0.6g(准确到0.1mg)于250mL烧杯中,用少量水润湿,盖上表皿,由烧杯口慢慢加入10mL1:1盐酸溶液溶解后,将溶液定量转入250mL容量瓶中,用水稀至刻度,摇匀。
实验十水中钙镁离子含量的测定
一、目的:
1、掌握EDTA法测定水中钙镁离子含量的原理和方法。
2、熟悉EBT和钙指示剂的应用。
二、原理:
1、总硬度测定原理
在PH=10的溶液中以EBT为指示剂,用EDTA滴定,EDTA首先与Ca2+离子配合,然后与Mg2+配合,方程式如下:
H2Y2-+Ca2+←→CaY2-+2H+
H2Y2-+Mg2+←→MgY2-+2H+
到达终点时,由于lgK MgY>lgK MgIn稍微过量的EDTA就会从MgIn-中夺取Mg2+,反应式如下:
MgIn-+H2Y2-←→MgY2-+HIn2-+H+
(EDTA滴定Mg2+允许的最小PH值为:logαY(H)=8.63-8=0.63 PH9.5~10.0
lgαY(H)=10.69-8=2.69 PH7.5~8.0)
2、钙硬度测定原理:用NaOH调节水样PH=12.5,使Mg2+→Mg(OH)2↓,以钙指示剂确定终点,用EDTA滴定至由红→蓝。
Ca2++HIn2-=CaIn-+H+
(红色)
Ca2++H2Y2-=CaY2-+2H+
终点时: CaIn-+H2Y2-=CaY2-+HIn2-+H+
红蓝
三、试剂:
EDTA标溶液(稀释至约0.005mol·L-1)、氨性缓冲液(PH=10.0)、10%
的NaOH(或2mol·L-NaOH)
EBT、钙指示剂
四、步骤:
1、Ca2+、Mg2+总含量的测定。
100ml水样+5ml缓冲液,滴加EBT 2~3滴用EDTA滴定,到终点时溶液由酒红色变为蓝色,记下V EDTA平行三次
(如果水样中Mg2+的含量很低,可事先在EDTA中加入少量Mg2+提高变色点的敏锐性)
2、Ca2+含量的测定
100mL水样+10%NaOH 8~10mL+钙指示剂(摇匀后再加)由酒红色滴定至蓝色,平行三次。
五、数据及结果计算:
计算公式:总硬度(相当于CaO的含量)
1L水中含CaO10mg相当于1度。
M CaO=0.056g·mmol-1
总硬度=[(V1EDTA·C EDTA)M CaO/(V水样×10)]×1000×1000
毫摩尔硬度换算 1000ml 换算成mg
钙硬度=[(C EDTA V EDTA M CaO)/(V水样×10)]×1000×1000
六、讨论:1、水样中含有Ca、Mg离子时测定Ca2+的含量为什么要加入NaOH
溶液?能用EBT作指示剂吗、为什么?
2、分析个人的操作误差。