无机化学第十章++配位化合物
- 格式:ppt
- 大小:6.85 MB
- 文档页数:90

无机化学中的重要离子与配位化合物无机化学是研究无机物质的性质、合成方法和应用的领域。
在无机化学中,重要离子和配位化合物发挥着关键作用,它们在化学反应和实际应用中具有广泛的影响。
本文将探讨无机化学中的重要离子和配位化合物的特性和应用。
一、重要离子1. 钠离子(Na+)钠离子是一种常见的阳离子,在化合物中通常以Na+的形式存在。
它在生物体内维持体液平衡、神经传导和细胞功能中起着重要作用。
此外,钠离子还可以用于制备玻璃、肥皂和某些药物。
2. 铁离子(Fe)铁离子在生物体中是必需的,它参与体内的氧运输、呼吸和能量代谢过程。
在无机化学中,铁离子常见的氧化态有Fe2+和Fe3+,它们在多种配位化合物和催化剂中扮演着重要角色。
3. 锌离子(Zn2+)锌离子作为微量元素存在于人体中,并参与多种酶的催化反应。
在无机化学中,锌离子广泛应用于配位化合物、染料和催化剂的合成和应用中。
4. 铜离子(Cu2+)铜离子在生物体和无机化学中都具有重要的应用价值。
在生物体内,铜离子参与催化反应和电子传递。
在无机化学中,铜离子可用于制备催化剂、染料和超导材料等。
二、配位化合物1. 配位基配位基是能够通过配位键与中心金属离子形成配位化合物的分子或离子。
常见的配位基包括水、氨和氯等。
在配位化合物中,配位基通过共价键或配位键与中心金属离子结合。
2. 配位数配位数是指配位化合物中通过配位键与中心金属离子结合的配位基的个数。
常见的配位数包括2、4和6等。
配位数取决于中心金属离子的电子排布和配位基的性质。
3. 配位化合物的性质配位化合物具有多种特殊的性质。
例如,一些配位化合物具有特定的颜色,这是由于配体的能级分裂引起的。
此外,许多配位化合物在电子传递、磁性和催化反应等方面发挥重要作用。
4. 应用领域配位化合物在多个领域具有广泛的应用。
例如,在医药领域,一些铂配合物被用作铂类抗肿瘤药物,具有抑制癌细胞生长的能力。
在工业中,一些配位化合物被用作催化剂,促进化学反应的进行。


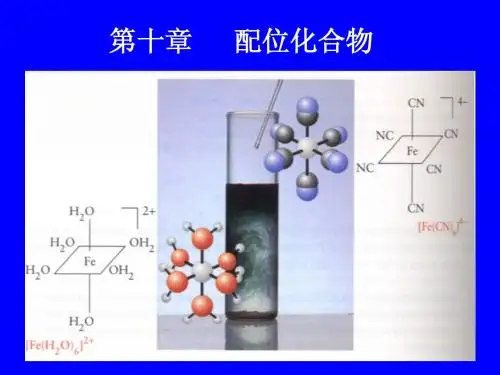
第十章配位化合物本章总目标:1:掌握配合物的基本概念和配位键的本质2:掌握配合物的价键理论的主要论点,并能用此解释一些实例3:配离子稳定常数的意义和应用4:配合物形成时性质的变化。
各小节目标:第一节:配位化合物的基本概念1:掌握中心原子、配体、配位原子、配位键、配位数、螯合物等概念,配位单元:由中心原子(或离子)和几个配位分子(或离子)以配位键向结合而形成的复杂分子或离子。
配位化合物:含有配位单元的化合物。
配位原子:配体中给出孤电子对与中心直接形成配位键的原子。
配位数:配位单元中与中心直接成键的配位原子的个数。
2:学会命名部分配合物,重点掌握命名配体的先后顺序:(1)先无机配体后有机配体(2)先阴离子配体,后分子类配体(3)同类配体中,先后顺序按配位原子的元素符号在英文字母表中的次序(4)配位原子相同时,配体中原子个数少的在前(5)配体中原子个数相同,则按和配位原子直接相连的其它原子的元素符号的英文字母表次序;3:了解配合物的结构异构和立体异构现象第二节:配位化合物的价键理论1:熟悉直线形、三角形、正方形、四面体、三角双锥、正八面体构型的中心杂化类型。
2:会分辨内轨型和外轨型配合物。
可以通过测定物质的磁矩来计算单电子数。
3:通过学习羰基配合物、氰配合物以及烯烃配合物的配键来熟悉价键理论中的能量问题。
第三节:配合物的晶体场理论1:掌握配合物的分裂能、稳定化能概念2:掌握配合物的晶体场理论。
3;了解影响分裂能大小的因素)晶体场的对称性中心离子的电荷数,中心离子的电荷高,与配体作用强,大。
中心原子所在的周期数,对于相同的配体,作为中心的过渡元素所在的周期数大,相对大些。
(4)配体的影响,配体中配位原子的电负性越小,给电子能力强,配体的配位能力强,分裂能大。
4:重点掌握(1)配合物颜色的原因之一——d-d跃迁以及颜色与分裂能大小的关系;(2)高自旋与低自旋以及与磁矩的大小的关系。
第五节:配位化合物的稳定性1:熟悉影响配位化合物稳定性的因素(1)中心与配体的关系(2)螯合效应(3)中心的影响(4)配体的影响(5)反位效应(6)18电子规则。

配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。

摘要配位化合物是一类广泛存在、组成较为复杂、在理论和应用上都十分重要的化合物。
目前对配位化合物的研究已远远超出了无机化学的范畴。
它涉及有机化学、分析化学、生物化学、催化动力学、电化学、量子化学等一系列学科。
随着科学的发展,在生物学和无机化学的边缘已形成了一门新兴的学科——生物无机化学。
新学科的发展表明,配位化合物在生命过程中起着重要的作用。
生物体内需要一定量的金属元素。
对于人来说,这些“生命金属”是一系列酶和蛋白质的活性中心的组成部分。
当生命金属过量或缺少、或污染金属元素在人体大量积累均将引起生理功能的紊乱而导致疾病,甚至死亡。
故配位化学在医学和药学领域有着重要的应用和广阔的前景。
本文从配合物作为药物、金属解毒剂、抗凝血剂和抑菌剂以及配合物在临床检验和生化实验中的应用等四个方面分别来阐述配位化学在医药工业中的应用。
关键词:配合物,解毒剂,抑菌剂,药物一、配位化合物配位化合物(coordination compound)简称配合物,也叫错合物、络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
如:K4[Fe(CN)6] [Cu(NH3)4]SO4[Ni(CO)4] [CoCl(NH3)3]按配位体分类,可有:①水合配合物。
为金属离子与水分子形成的配合物,几乎所有金属离子在水溶液中都可形成水合配合物,如〔Cu(H2O)4〕2+、〔Cr(H2O)6〕3+。
②卤合配合物。
金属离子与卤素(氟、氯、溴、碘)离子形成的配合物,绝大多数金属都可生成卤合配合物,如K2〔PtCl4〕、Na3〔AlF6〕。
③氨合配合物。
金属离子与氨分子形成的配合物,如〔Cu(NH3)4〕SO4。
④氰合配合物。
金属离子与氰离子形成的配合物,如K4〔Fe(CN)6〕。
⑤金属羰基合物。
金属与羰基(CO)形成的配合物。
如〔Ni(CO)4〕。
二、对人体生命活动的重要意义生物体中几乎所有的金属都是以配合物的形式存在的,现已证明对人体有特殊生理功能的微量元素有Mn,Fe,Co,Mo,Zn,Mg,V,Cr,Si,Cu,Sn,Se等,他们均以配合物的形式存在于人体中,并且有特殊的生理功能。


无机化学中的配位化合物无机化学是化学的一个重要分支,主要研究非有机化合物或元素的结构、性质及其间的相互作用。
而其中一个重要且常被人们忽略的分支,就是配位化学。
配位化学研究的是金属离子与一定数量的配体结合成的配位化合物,而这些化合物则在许多领域有着重要应用。
在本篇文章中,我们将进一步探讨无机化学中的配位化合物。
一、配位体的分子结构及分类在配位化学中,有机分子或无机离子集体被称为配位体。
它们的分子结构是由原子或原子团组成的。
根据杂化状态的不同,它们可以分为配位体I(线型)和配位体II(平面)。
此外,它们也可以由下列形式的单原子离子(如NO+、NH4+、SO4^-2等)、小分子(如CO、SO2、NH3、H2O等)或多原子离子(如[Fe(CN)6]^-4、[Co(NH3)6]3+、[CuCl4]^-2等)组成。
二、配位化合物的性质由于其特殊的结构,配位化合物表现出了一些独特的性质。
其中最重要的特征就是其对化学反应的影响。
例如,在生化学领域中,许多酶(大分子催化剂)都是由一定数量的金属离子(如Fe、Cu、Mg等)与配体结合而成,这些金属离子可以在催化反应中参与,并极大地影响反应动力学。
除了对生化学反应的影响外,配位化合物还有一些其他的性质。
例如,它们显示出的光学性质一直是该领域研究的一个热点。
有些金属离子和其所组成的配位体能发射出特定的荧光,因此在化学的分析和监测中得到了广泛应用。
此外,很多配位化合物也有着重要的电子学性质,如电导、磁性等等。
三、配位化合物在实际生活中的应用由于其独特性质,配位化合物已经广泛应用在现实生活中,例如:1.医学在医学领域中,针对疾病的药物中许多都是由一定数量的金属离子与配体结合而成。
这些化合物通常和受体相互作用,从而达到治疗目的。
同时,它们还有助于分析分子结构,并赋予了医学领域一些其他的创新。
2.钢铁产业铁氧体是一种常见的铁矿石,其结构由铁离子和氧离子相互作用形成晶体而成。
由于其结构相对稳定,这种矿石是制造钢铁的重要原料之一。

无机化学中的配位化合物的配位数和配位环境无机化学是研究无机物质及其性质、结构、合成和应用的学科。
其中,配位化合物是无机化学中的重要研究对象之一。
配位化合物是由一个或多个配体与一个中心金属离子形成的化合物。
在配位化合物中,配体以配位键的形式与中心金属离子相连,形成配位环境。
配位数和配位环境是决定配位化合物性质的重要因素。
配位数是指一个中心金属离子周围配位键的数量。
一般来说,配位数可以从1到12不等。
其中,配位数为1的配位化合物称为一配位化合物,如氯化银(AgCl);配位数为2的配位化合物称为二配位化合物,如二氯化铜(CuCl2);配位数为3的配位化合物称为三配位化合物,如三氯化铁(FeCl3);配位数为4的配位化合物称为四配位化合物,如四氯化钛(TiCl4);配位数为5的配位化合物称为五配位化合物,如五氯化钒(VCl5);配位数为6的配位化合物称为六配位化合物,如六氯合铜(CuCl6);配位数为7的配位化合物称为七配位化合物,如七氯化锆(ZrCl7);配位数为8的配位化合物称为八配位化合物,如八氯化铁(FeCl8);配位数为9的配位化合物称为九配位化合物,如九氯化铑(RhCl9);配位数为10的配位化合物称为十配位化合物,如十氯化铪(HfCl10);配位数为11的配位化合物称为十一配位化合物,如十一氯化钼(MoCl11);配位数为12的配位化合物称为十二配位化合物,如十二氯化铅(PbCl12)。
配位环境是指配体与中心金属离子之间的空间排布。
根据配位环境的不同,配位化合物可以分为线性、平面、四面体、八面体等不同的形态。
线性配位环境是指配体以直线排列与中心金属离子相连,形成线性形态。
平面配位环境是指配体以平面排列与中心金属离子相连,形成平面形态。
四面体配位环境是指配体以四面体的形态与中心金属离子相连。
八面体配位环境是指配体以八面体的形态与中心金属离子相连。
不同的配位环境会影响到配位化合物的稳定性和反应性。

无机化学氧化还原反应与配位化合物氧化还原反应是无机化学中的重要反应类型之一,它涉及原子的电子转移过程,其中一种物质的氧化态发生变化,而另一种物质的还原态也发生相应的变化。
氧化还原反应在自然界、生物体内和人类工业生产中都广泛存在,并对我们日常生活产生着深远的影响。
一、氧化还原反应的定义和基本概念在无机化学中,氧化还原反应是指电子在化学反应中的转移。
在这类反应中,一种物质丧失电子,被认为是被氧化的;而另一种物质得到这些电子,被认为是被还原的。
因此,氧化还原反应也可以简称为“氧化反应”和“还原反应”。
基本上,氧化还原反应涉及两种基本的化学变化:氧化和还原。
氧化是指物质失去电子,或增加氧原子的过程。
还原则是指物质获得电子,或减少氧原子的过程。
从电子角度来看,氧化实际上是电子的流失,而还原则是电子的得到。
这种电子转移是通过电子的传递或共享来实现的。
二、氧化还原反应的类型氧化还原反应的类型可以分为几种基本情况,包括金属与非金属的反应、氧化物与非氧化物的反应、还原性物质与氧化性物质的反应等。
1. 金属与非金属的反应在金属与非金属的反应中,金属通常容易失去电子而被氧化,而非金属则容易获得电子而被还原。
例如,钠和氯的反应产生氯化钠(NaCl),钠的氧化态由0增加为+1,氯的氧化态由0减少为-1。
2. 氧化物与非氧化物的反应在氧化物与非氧化物的反应中,氧化物通常是被还原的物质,而非氧化物则是氧化的物质。
例如,二氧化碳(CO2)与氢气(H2)反应生成甲酸(HCOOH)。
在这个反应中,二氧化碳的氧化态由+4减少为+2,氢气的氧化态由0增加为+1。
3. 还原性物质与氧化性物质的反应还原性物质指的是有能力失去电子的物质,即被氧化的物质;而氧化性物质指的是有能力获得电子的物质,即被还原的物质。
这类反应中,还原性物质失去电子,而氧化性物质获得电子。
例如,氧气(O2)与氢气(H2)反应生成水(H2O),氢气的氧化态由0增加为+1,氧气的氧化态由0减少为-2。