最简单的有机化合物甲烷
- 格式:pdf
- 大小:368.61 KB
- 文档页数:6


第三章有机化合物第一节最简单的有机化合物——甲烷一、甲烷的存在、结构1.存在甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
2.分子结构甲烷的分子式是CH 4;电子式是;结构式是。
实验证明,甲烷分子具有正四面体结构,其中四个C—H 键长度和强度相同,夹角相等。
提醒有机化合物必须含有碳元素,但含有碳元素的化合物不一定是有机化合物,如CO 、CO 2、碳酸及其盐等。
常见有机物结构的表示方法(以甲烷为例)表示方法含义分子式:CH 4用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目最简式(实验式):CH 4表示物质组成的各元素原子最简整数比的式子电子式:用小黑点等符号代替电子,表示原子最外层电子成键情况的式子结构式:①具有化学式所能表示的意义,能反映物质的结构;②表示分子中原子的结合或排列顺序的式子,但不表示空间构型球棍模型:小球表示原子,短棍表示价键(单键、双键或三键)比例模型:用不同体积的小球表示不同大小的原子二、甲烷的性质1.物理性质颜色状态气味密度(与空气相比)水溶性无色气体无味比空气小极难溶2、化学性质通常状况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但在特定的条件下,甲烷也会发生某些反应。
1.氧化反应(燃烧)(1)化学方程式:CH 4+2O 2――→点燃CO 2+2H 2O 。
(2)现象:甲烷在空气中安静地燃烧,火焰呈淡蓝色。
燃烧现象检验产物方法现象结论淡蓝色火焰在火焰上方罩一个干燥的烧杯烧杯内壁有水珠产生生成了H 2O 在火焰上方罩一个涂有澄清石灰水的烧杯烧杯内壁变浑浊生成了CO 22.取代反应(1)取代反应有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
(2)甲烷与氯气的取代反应①实验探究实验操作实验现象A 装置:a.试管内气体颜色逐渐变浅;b.试管内壁有油状液滴出现;c.试管中有少量白雾;d.试管内液面上升;e.水槽中有固体析出B 装置:无明显现象实验结论CH 4与Cl 2在光照时才能发生化学反应,有关化学方程式为②产物性质CH 3ClCH 2Cl 2CHCl 3CCl 4状态气体均为油状液体水溶性都难溶于水点拨无论CH 4和Cl 2的比例如何,发生取代反应的产物都是CH 3Cl 、CH 2Cl 2、CHCl 3、CCl 4和HCl 的混合物。




第一讲最简单的有机化合物甲烷子?新课标?高三化学〔人教版〕第一轮复习必修〔2〕单元讲座第三章有机化合物第一讲最简单的有机化合物一甲烷复习目标:1、了解甲烷在自然界存在和日常生活和化工生产中的应用;2、认识甲烷分子结构,学会书写甲烷的电子式和结构式;3、明白得典型的有机反应一一取代反应的特点,能辨认同系物和同分异构体。
复习重点:甲烷的结构特点和甲烷的取代反应;同分异构体和同系物。
复习难点:建立有机物立体结构模型,将甲烷和烷烃的结构特点、有机物的成键特点从实物模型转换为学生头脑中的思维模型,从化学键的层面认识甲烷的结构和性质。
课时安排:两课时。
教学过程:知识梳理一、甲烷分子组成与结构1、三式:分子式:_______ ;电子式:_______ 结构式:__________ 。
2、甲烷空间结构的描述:甲烷是_______ 结构,碳原子位于__________ ,顶点差不多上________ 。
3、甲烷分子结构的参数:键角差不多上________ ; 键长1.09X 10 T°m键能是413kJ/mol 。
二、甲烷的性质1、物理性质:__ 色___ 味___ 体,比空气___ , ___ 溶于水。
2、化学性质:一样情形下,性质_____ 稳固,跟强酸、强碱或强氧化剂等_____ 反应。
(1 )甲烷的氧化反应:有机方程式书写不用”=''而用—表示。
点燃CH4(g) + 20 2 (g) ' ► CQ(g)+2H 2。
(1)咨询题:①点燃甲烷前要进行什么操作?[ _____ ]②火焰的颜色是什么?[ —]③燃烧时火焰是淡蓝色的气体还有哪些?[ ____ 、__ 、____ ]④燃烧后的产物如何检验?[ ___________](2)甲烷的取代反应:取代反应:有机物分子里的某些原子或原子团 ___________________3、甲烷与氯气在光照条件下反应,现象:黄绿色逐步_______ ,瓶壁显现_______ ,讲明产生了不溶于水的物质。



常见有机物化学式有机化学是关于碳基化合物的化学科学,常见有机物可以通过化学式来表示其分子结构。
下面将介绍几种常见有机物及其化学式。
1. 甲烷(CH4)甲烷是最简单的有机化合物,也是天然气的主要成分之一。
其化学式为CH4,由一个碳原子与四个氢原子组成。
甲烷是一种无色、无味的气体,主要用作燃料和化工原料。
2. 乙醇(C2H5OH)乙醇是一种常见的醇类有机物,也称为酒精。
其化学式为C2H5OH,由两个碳原子、六个氢原子和一个氧原子组成。
乙醇是一种透明、无色的液体,在医药、化妆品和溶剂等方面有广泛的应用。
3. 甲醛(CH2O)甲醛是一种有机化合物,也是最简单的醛类化合物。
其化学式为CH2O,由一个碳原子、两个氢原子和一个氧原子组成。
甲醛是一种无色气体或液体,在工业中常用作防腐剂、消毒剂和纺织品整理剂。
4. 乙酸(CH3COOH)乙酸是一种酸性有机化合物,常见的有机酸之一。
其化学式为CH3COOH,由两个碳原子、四个氢原子和两个氧原子组成。
乙酸呈无色液体,在制药、化妆品和食品行业有广泛的应用。
5. 苯(C6H6)苯是一种芳香烃类有机化合物,由六个碳原子和六个氢原子组成。
其化学式为C6H6,苯是一种无色、有刺激性气味的液体,广泛用于制造塑料、橡胶和染料等工业领域。
6. 丙酮(C3H6O)丙酮是一种酮类有机化合物,其化学式为C3H6O,由三个碳原子、六个氢原子和一个氧原子组成。
丙酮是一种无色液体,在溶剂、化妆品和药物制剂等方面有广泛的应用。
7. 乙烯(C2H4)乙烯是一种烯烃类有机化合物,也称为乙烯烃。
其化学式为C2H4,由两个碳原子和四个氢原子组成。
乙烯是一种无色气体,是合成塑料和橡胶的重要原料。
以上是几种常见的有机物及其化学式,我们可以通过化学式来了解有机物的分子结构和化学性质。
有机化学在医药、化工、农业等领域有广泛的应用,对人类的生活产生了巨大影响。

最简单的有机化合物—甲烷知识点一.有机化合物和烃概念组成元素有机化合物大部分含有碳元素的化合物一定含有C,常含有H,O,有的还含有N,P,S,Cl等(写元素符号,下同)。
烃仅含有C,H的有机物有机化合物都含有碳元素,但含有碳元素的物质不一定都是有机物,如CO、CO2、碳酸盐、碳酸氢盐都属于无机物。
知识点二.甲烷1.存在和用途(1)存在:甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
(2)用途:天然气是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。
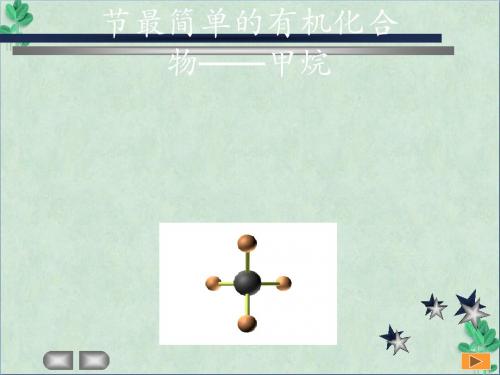
2.组成与结构(1)表示方法化学式电子式结构式分子结构示意图球棍模型比例模型CH4(2)结构特点甲烷分子是以碳原子为中心,氢原子为顶点的正四面体结构,其中C—H键的键长和键角相同。
3.物理性质颜色 状态 气味 密度(与空气相比) 水溶性 无色气态无味小极难溶4.化学性质通常状况下,甲烷比较稳定,与KMnO 4等强氧化剂不反应,与强酸、强碱也不反应。
但在特定的条件下,甲烷也能发生某些反应。
(1)氧化反应纯净的甲烷在空气中安静的燃烧,火焰呈淡蓝色,放出大量的热,反应的化学方程式为 CH 4+2O 2――→点燃CO 2+2H 2O 。
(2)取代反应①取代反应:有机化合物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
②甲烷与氯气的取代反应实验操作实验现象a.气体颜色变浅,最后消失b.试管内壁有油状液滴出现c.试管内液面逐渐上升d.试管中有少量白雾③取代产物水溶性:甲烷的四种氯代产物均不溶于水。
状态:常温下除一氯甲烷是气体,其余三种均为液体。
④取代反应和置换反应的区别。
知识点三.烷烃1.烷烃定义及通性:烃的分子里所有的碳原子均达到“饱和”的链烃即所有的碳原子间均以单键的形式连接叫做饱和链烃,也叫烷烃。
通式:C n H2n+2(n≥1),如乙烷、丙烷、丁烷等。
通性:①n≤4为气体,溶沸点、密度随碳原子数增大而增大②通常状况下,很稳定,与酸、碱和氧化剂都不发生反应,也难与其它物质化合。

甲烷是什么气体
甲烷是一种无色无味的气体。
分子式为CH4,其是化学结构中一种简单的碳氢化合物,属于一种气体燃料,是化工产品的重要组成原材料之一,是最简单的有机物化合物,通常情况下化学性质比较稳定。
甲烷是有毒的,其本身毒性较低,但是当浓度过高时,会导致空气中含氧量下降,导致人体缺氧室息。
甲烷俗称瓦斯,在自然界分布较广,是天然气、沼气、坑气的主要成分,能够作为制作氢气、炭黑、一氧化碳等物质的原料。
甲烷的化学性质一般情况下比较稳定,但是在某些环境下,甲烷也会发生某些反应,其基本的氧化反应就是燃烧。
甲烷主要是作为燃料,如天然气和煤气,广泛应用于民用和工业中。
作为化工原料,可以用来生产乙炔、氢气、合成氨、碳黑、二硫化碳、一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氢氰酸等。
甲烷是一种很重要的燃料,是天然气的主要成分,约占87%。
在标准压力的室温环境中,甲烷无色、无味。
家用天然气的特殊味道,是为了安全而添加的人工气味,通常是使用甲硫醇或乙硫醇。
甲烷高温分解可得炭黑,用作颜料、油墨、油漆以及橡胶的添加剂等。
氯仿和CCl4都是重要的溶剂。
甲烷在自然界分布很广,是天然气、沼气、坑气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料。
甲烷用作热水器、燃气炉热值测试标准燃料。
生产可燃气体报警器的标准气,校正气。
还可用作太阳能电池,非晶硅膜气相化学沉积的碳源。
以及甲烷用作医
药化工合成的生产原料。

甲烷的性质与应急处理措施甲烷简介CH4 是最简单的有机化合物,也是最简单的脂肪族烷烃。
自然界中分布很广,是沼气和天然气等的主要成分。
也存在于煤气(焦炉气)和石油裂化气等中。
无色、无味的可燃性气体。
密度0.7168。
相对密度0.554(空气=1)。
熔点-182.5℃。
沸点-161.5℃。
临界温度-82.1℃。
临界压力4.6兆帕(46.27大气压)。
燃烧热39.77兆焦/米3(9500千卡/米3)。
微溶于水。
性稳定。
可被液化和固化。
在适当条件下能发生氧化、卤代、热解等反应。
燃烧时呈青白色火焰。
与空气的混合气体在点燃时会发生爆炸。
爆炸极限5.3%-14.0%(体积)。
工业上主要用于制造乙炔以及经转化制成氢气或合成氨和有机合成的原料气。
也用于制备炭黑、硝基甲烷、一氯甲烷、二氯甲烷、三氯甲烷(氯仿)、二硫化碳、四氯化碳和氢氰酸等。
也可直接用作燃料。
工业上主要由天然气中获得。
实验室中可用无水乙酸纳和碱石灰共熔而得。
自然界中的甲烷据德国核物理研究所的科学家经过试验发现,植物和落叶都产生甲烷,而生成量随着温度和日照的增强而增加。
另外,植物产生的甲烷是腐烂植物的10到100倍。
他们经过估算认为,植物每年产生的甲烷占到世界甲烷生成量的10%到30%。
行星中发现甲烷据国外媒体报道,美国天文学家19日宣布,他们首次在太阳系外一颗行星的大气中发现了甲烷,这是科学家首次在太阳系外行星探测到有机分子,从而增加了确认太阳系外存在生命的希望。
该小组还证实了先前的猜测,即这颗名叫HD 189733b的行星的大气中有水。
甲烷是创造适合生命存在的条件中,扮演重要角色的有机分子。
美国宇航局喷气推进实验室的天文学家,利用绕轨运行的“哈勃”太空望远镜得到了一张HD 189733b行星大气的红外线分光镜图谱,并发现了其中的甲烷痕迹,相关发现刊登在3月20日出版的英国《自然》杂志上。
行星HD 189733b位于狐狸座,距地球63光年,是一类叫做“热木星”大行星,其表面灼热,不可能存在液态水。

最简单的有机化合物—甲烷要想做好实验,就要敏于观察。
——波义耳英国化学家In order to do the experiment, it is necessary to be sensitive to the observation.【知识要点】甲烷的结构与性质一、有机化合物绝大多数含碳的化合物称为。
一氧化碳、二氧化碳、碳酸、碳酸盐、氰酸盐、硫氰酸盐等物质,虽然含有碳元素,但它们的组成和性质跟无机物很近,一般把它们作为无机物。
二、甲烷1.存在和用途(1)存在:甲烷是________、________、油田气和煤矿坑道气的主要成分。
(2)用途:天然气是一种______、______、________的清洁能源,还是一种重要的__________。
2.组成与结构化学式电子式结构式分子结构示意图球棍模型比例模型(2)结构特点甲烷分子是以______为中心,________为顶点的__________结构,其中C—H键的______和______相同。
3.物理性质颜色状态气味密度(与空气相比) 水溶性4.化学性质通常状况下,甲烷比较稳定,与______等强氧化剂不反应,与______、______也不反应。
但在特定的条件下,甲烷也能发生某些反应。
(1)氧化反应纯净的甲烷在空气中安静的燃烧,火焰呈________,放出大量的热,反应的化学方程式为________________________________________________________________________。
(2)取代反应①取代反应:有机化合物分子里的某些________________被其他________________所代替的反应。
实验操作实验现象a.气体颜色________,最后________b.试管内壁有________出现c.试管内液面逐渐________d.试管中有少量白雾化学方程式③取代产物水溶性:甲烷的四种氯代产物均________状态:常温下除__________是气体,其余三种均为__________ 烷烃一、烷烃1.概念:分子中碳原子之间只以__________结合,剩余的价键全部跟__________结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫__________,也叫______。


有机化合物烃:只有碳氢两种元素组成的有机化合物。
有机物:碳氢化合物及其衍生物。
一、烷烃1. 最简单的有机化合物——甲烷(1) 物性:无色无味的气体,ρ=0.717g·L -1(标况下),极难溶于水。
(2) 化性:一般情况下,甲烷比较稳定,不与酸性KMnO 4等强氧化剂反应,也不与强酸、强碱反应。
但特定条件下,甲烷也会发生某些反应。
①氧化反应:火焰呈淡蓝色CH 4(g)+2O 2CO 2(g)+2H 2O(l) 氧化反应:加氧失氢的有机反应。
还原反应:加氢失氧的有机反应。
② 取代反应定义:。
CH 4+Cl 3Cl (气体)+HCl CH 32Cl 2(液体)+HClCH 2Cl 2 CHCl 3(液体,又名氯仿)+HCl CHCl 3CCl 4(液体,又名四氯化碳)+HCl此反应在光照条件下发生(也可以在一定温度下发生),现象为试管内气体颜色逐渐变浅,试管壁出现油状液滴,试管中有少量白雾,试管内有一段水柱形成。
注:a .书写有机反应方程式时,要用“→”而不用“===”;b .CH 4与其他卤素单质在光照条件下也能发生取代反应,但必须是纯卤素单质;c .有机物与卤素单质发生取代反应是一种连锁反应,即第一步反应一旦开始,后续反应立即进行。
其中生成HCl 的物质的量最多;d .1 mol 某有机物发生取代反应时,每取代一个H 原子,就消耗1 mol Cl 2,所以1 mol 某有机物发生取代反应完全反应时,有多少摩尔H 原子,就要消耗多少摩尔Cl 2 ;e .CH 4是正四面体结构,所以能证明此结论证正确的证据是CH 2Cl 2没有同分异构体。
或者说甲烷分子的取代物中有两组相同的原子就没有同分异构体。
2. 烷烃⑴ 定义:烃分子中碳原子之间均以碳碳单键结合,剩余价键均与氢原子结合,使每个碳原子都连有四根单键。
⑵ 结构式(碳氢之间的单键不可略去): 分子式(书写成C x H y 的形式): C 2H 6H —C —C —HH H H H结构简式(碳氢之间的单键可略去):CH 3CH 3,正丁烷可书写为CH 3(CH 2)2CH 3 电子式(根据结构式来书写,每根单键代表一对共用电子对): ⑶ 烷烃的相关性质① 分子通式:C n H 2n+2 ( n≥1 ),符合此通式的烃一定是烷烃。

简单的有机化合物——甲烷
1.天然气的主要成分是甲烷,其分子式为CH4,下列四位同学在讨论分子式CH4的意义,其中错误的是 ( )
2.甲烷分子的空间构型是正四面体,下列事实可以证明这一观点的是 ( )
A.CH3Cl没有同分异构体
B.CH2Cl2没有同分异构体
C.甲烷分子中C—H键键角均相等
D.甲烷分子可以发生取代反应
3. 1 mol甲烷和氯气在光照条件下反应生成物质的量相同的四种取代物,则消耗氯气的物质的量是( )
A.5mol
B.2.5mol
C.1.25mol
D.4mol
4. 对制冷剂氟利昂-12(CF2Cl2)的叙述正确的是( )
A.只有一种结构
B.有两种结构
C.有四种不同的结构
D.无法确定其结构
5. 下列各组物质不属于同分异构体的是( )
A.2,2-二甲基丙醇和2-甲基丁醇
B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
6. 2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是( )
A.分子中碳原子不在一条直线上
B.光照下能够发生取代反应
C.比丁烷更易液化
D.是石油分馏的一种产品
7.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目的
是( )
12345678
CH4C2H4C3H8C4H8C6H12C7H16C8H16
A.3
B.4
C.5
D.6
8.丁烷(化学式C4H10)燃烧时,火苗高且亮,在白天二百米以外也能清晰可见,下列关于丁烷叙述正确的是 ( )
①丁烷是由碳、氢两种元素组成的
②丁烷是由丁烷分子构成的
③丁烷常温下为气态
④丁烷有2种同分异构体
⑤丁烷分子只由共价键组成
A.①②③④⑤
B.①②⑤
C.②③④⑤
D.①②④⑤
9.某混合气体由两种气态烃组成。取2.24L该混合气体完全燃烧后得到
4.48L二氧化碳(气体已折算为标准状况)和3.6g水,则这两种气体可能是 ( )
A.CH4和C3H8
B.CH4和C3H4
C.C2H4和C3H4
D.C2H4和C2H6
10.1 mol某烃在氧气中充分燃烧,需要消耗氧气246.4L(标准准况下)。它在光照的条件下与氯气反应能生成4种不同的一氯取代物。该烃的结构简式是 ( )
11.某有机物分子中含n个—CH2—,m个CH、a个—OH,其余为甲基,则甲基的个数为 ( )
A.2n+3m-a
B.n+m+a
C.m+2-a
D.m+2n+2-a
12.一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g。原混合气体中CO2的质量为 ( )
A.12.5g
B.13.2g
C.19.7g
D.24.4g
13.某同学想设计实验探究甲烷与Cl2反应的反应条件以及反应类型。请完成下列问题:
(一)制取CH4和Cl2
(1)实验室通常用无水CH3COONa与碱石灰反应制取CH4,其制取装置还可以制取______、______等气体。
(2)实验室通常用MnO2与浓HCl反应制取Cl2,其反应方程式为
____________________________________,1molMnO2与含有146g HCl的
浓盐酸充分反应,制得Cl2在标准状况下的体积为____________。
(二)收集CH4与Cl2
取3支硬质大试管,通过排饱和食盐水的方法先后各收集半试管甲烷和半试管氯气。丁中的CH4与氯气是用排空气法收集后再混合。
(三)探究甲烷与氯气反应的反应条件及其反应类型
分别用铁架台固定好如图所示装置,其中甲试管用预先准备好的黑色纸套套上,丙、丁试管用点燃的镁条照射,乙试管放在自然光下。
(3)能否用蒸馏水代替饱和食盐水,理由是:
__________________________________________________。
(4)从__________现象推断Cl2与CH4开始了反应;从__________现象推断Cl2和CH4发生的是取代反应。
14.下列各组物质①O2和O3②1H、2H和3H③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3和
CH3CH2CH2CH(CH3)C2H5
根据题意填空(只填序号),互为同系物的是__________,互为同分异构体的是__________,互为同位素的是__________,互为同素异形体的是
__________,是同一物质的是__________。
15.将0.2mol某烷烃完全燃烧所生成的物质缓缓地全部通入0.5L2mol·L-1的NaOH溶液中,生成的Na2CO3和NaHCO3的物质的量之比是1:3。该烃的化学式是________。
16. 现有常见有机物A,在压强为1.01×105Pa、120 ℃时,取A气体20mL,与相同状况下xmLO2混合。
(1)如果A为烃,完全燃烧恢复到原状况后体积增至(x+40) mL,那么A在组成上应满足的条件是________________________。
(2)如果A是两种有机物组成的混合物,当x=25时恰好完全燃烧,恢复到原状况后,测得生成二氧化碳和水的总体积为50 mL,平均相对分子质量为
28.4。试回答:
①燃烧生成的二氧化碳和水蒸气的体积比是________。
②A的可能组成是_______________,______________(写出任意两组的分子式)。
答案:1D;2B;3B;4A;5D;6C;7A;8A;9B;10A;11C;12B;13(一)(1)O2;NH3;(2)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;小于22.4 L;(3)不能,因为Cl2能溶在蒸馏水中,使得混合气体的颜色变浅
;(4)试管壁上出现油状液滴、试管内液面上升、饱和食盐水中有少量
晶体析出、黄绿色变浅(至少要回答出2种)
丁中硝酸银溶液的液面上方有白雾同时硝酸银溶液中有白色沉淀生成14:⑤;④;②③;①;⑥
15C4H10
16(1)1个烃分子中氢原子数为8
(2)①2:3;②CH4、CH2O2;CH4O、CH2O。