(完整版)亨廷顿病诊疗指南
- 格式:doc
- 大小:191.01 KB
- 文档页数:7
亨廷顿病(Nature 综述)作者:幸福的味道亨廷顿病是一种临床表现复杂的运动障碍性疾病,主要依赖遗传学诊断。
对于这种比较少见的遗传性疾病,你了解多少?近期Nature 杂志发表了一篇综述,回顾了亨廷顿病遗传学和临床诊断要点,治疗方法以及未来研究前景,让我们对该病有了更加透彻的了解。
流行病学西方国家人群中亨廷顿病(HD)患病率约为10.6-13.7/10 万人。
基因诊断学技术大大提高了疾病的诊断率,特别是对老年人群中晚发型亨廷顿病的确诊,因为这些患者通常无家族史,且由于这些患者痴呆和其他神经变性疾病发生率高,临床诊断较为困难。
欧洲人群中亨廷顿病发病率更高。
日本、台湾地区其发生率仅为欧洲和北美的1/10。
这种差异是由于HTT 位点的基因异质性所致。
发病机制/ 病理生理学1. 遗传学或基因调节因素:HTT 负责编码亨廷顿蛋白,其内有一个PolyQ 的部分,而这一部分是由重复CAG 三核苷酸重复序列所编码。
正常人群中这一重复序列的长度为6-35 个重复,如果扩增超过40 个重复序列,则会导致发病,出现运动症状。
而如果在36-39 之间,一部分患者会发病,一些患者会继续保持无症状状态。
2. 亨廷顿蛋白结构和功能:亨廷顿蛋白可在全身广泛表达,但根据细胞类型不同表达水平不同,在细胞核和胞浆内均可存在。
亨廷顿蛋白的正常功能尚未完全明确,包括其对神经系统发育的影响,对脑源性神经生长因子(BDNF)的产生和转运的作用以及对细胞黏附的影响。
3. 亨廷顿病的病理生物学机制:大量研究数据显示亨廷顿蛋白片段化(fragmentation)可能是其发病的首个关键性步骤。
不同类型细胞间亨廷顿蛋白片段的相对浓度部分依赖于HTT 表达的水平;在神经元中表达高于胶质细胞。
亨廷顿蛋白具有多个修饰位点,其翻译后修饰过程可被扩增的PolyQ 片段所影响,从而反过来影响其毒性作用。
诊断、筛查及预防亨廷顿的诊断主要基于临床评估、家族史以及对CAG 重复扩增序列的基因学检测。

亨廷顿氏舞蹈症是一种家族显性遗传型疾病。
患者由于基因突变或者第四对染色体内 DNA(脱氧核糖核酸)基质之 CAG三核甘酸重复序列过度扩张,造成脑部神经细胞持续退化,机体细胞错误地制造一种名为“亨廷顿蛋白质”的有害物质。
这些异常蛋白质积聚成块,损坏部分脑细胞,特别是那些与肌肉控制有关的细胞,导致患者神经系统逐渐退化,神经冲动弥散,动作失调,出现不可控制的颤搐,并能发展成痴呆,甚至死亡。
亨廷顿氏舞蹈症(Huntington's Disease)病因主要是家族遗传或者基因受到外部刺激而发生突变。
只要自双亲任一方遗传缺陷的基因,皆会表现出病征。
病征主要表现为:1.情绪异常,变得冷漠、易怒或忧郁。
2.手指、腿部、脸部或身体出现不自主动作。
3.智力衰减,判断力、记忆力、认知能力减退。
一般来说,导致患者死亡的原因是因为突然跌倒或者感染其他并发症。
目前药物可以控制、减缓情绪波动和动作问题,但无法彻底根治该疾病。
一个跨国科研团体在经历了10年炼狱般艰难的研究探索后,声称已发现了引起亨廷顿氏舞蹈症的基因。
这10年里,他们曾有过方向错误的研究,品尝过因试验失败而痛心的滋味,终于发现了这一在分子生物学界众人追寻已久的目标。
研究人员说,他们现在已掌握了这种基因,可以着手研究这种由于神经系统衰退而引起的神精病了。
这种病通常总是侵袭30到40岁左右的人。
患者看似正常,实则身体已严重受损,在10年到20年间就会死去。
亨廷顿氏舞蹈症折磨着3万名左右的美国人,另有15万美国人处于染病的险境。
众所周知的民间歌手乌迪·古斯里便是它的牺牲品之一。
在20世纪80年代初,人们发现了引起亨廷顿氏舞蹈症的基因线索,当时正值新形态的分子遗传学的起步阶段,研究人员不久就遇到了一连串儿的麻烦,使这项研究变得更具有挑战性和令人无法抗拒的魅力,也因此吸引了许多杰出的生物学家。
令科学家们感兴趣的是,引起这种疾病的基因突变与他们不久前在引起其他疾病的基因中所见到的一样。



亨廷顿舞蹈病……亨廷顿舞蹈病(Huntington disease,HD)是由亨廷顿蛋白(huntingtin,Htt)N端多聚谷氨酰胺序列延长引起的神经退行性疾病.一组半胱氨酸蛋白酶(caspase)和钙蛋白酶(calpain)可剪切突变Htt,产生毒性较大的N端Htt片段.近年的研究表明,该剪切作用导致N端片段的产生是舞蹈病发病机制中的重要一步,阻断这一过程可能为这种目前无法治愈的疾病提供潜在的治疗方案.Huntington disease (HD) is a neurodegenerative disorder caused by an expansion of the polyglutamine tract in the N-terminal huntingtin (Htt). Htt is a substrate of caspases and calpains, the proteases involved in initiation and execution of neuronal apoptosis. Caspase- andcalpain-mediated cleavage of mutant Htt results in the production of toxic Nterminal Htt fragments. Recent studies suggest that Htt cleavage may be a crucial step in the pathogenesis of HD and may be a potential molecular target for HD therapy.发病机理美国和挪威科学家合作研究发现,细胞在进行DNA(脱氧核糖核酸)修复过程中出错,可能是触发亨廷顿舞蹈病的主要原因。
研究人员希望这一发现能帮助找到亨廷顿舞蹈病的疗法。
亨廷顿舞蹈病是一种遗传性脑病,症状表现为舞蹈性运动以及认知和行为障碍,目前尚无有效疗法。

M D S -1116-501International Parkinson and Movement Disorder Society555 East Well Street, Suite 1100 • Milwaukee, WI 53202 • +1 414-276-2145 • Copyright © 2016 International Parkinson and Movement Disorder Society (MDS). All rights reserved.什么是亨廷顿舞蹈病?亨廷顿舞蹈病(HD)是一种慢性神经退行性脑部疾病,这个词的意思是大脑的神经细胞随着时间的推移而逐渐死亡。
这个病通常在你30岁至50岁之间发病,但也可能在你更年轻的时候就发病。
HD会损害你的:• 运动能力• 行为举止• 思考、理解、学习、记忆能力• 性格得这个病后最常见的表现是你不受控制的要动,也就是所谓的像舞蹈一样的动作。
这个病引起的运动问题还包括说话和行走困难。
此外,你可能还会有以下这些症状:• 记忆力减退,注意力不集中,不能执行任务,冲动控制障碍• 情绪低落,对什么事情都不感兴趣• 睡眠改变• 性功能问题• 吞咽困难• 容易跌倒精神、情绪和行为举止方面的轻微变化可能在出现明显身体症状之前几年就会发生。
亨廷顿舞蹈病的病因是什么?HD是由一个基因的某部分异常扩增引起,这种扩增会导致大脑的神经细胞不断丢失。
扩增的重复次数越多,HD发病越早。
一旦基因检测发现这个基因异常就可以确诊HD。
HD是遗传性疾病。
你从父母那儿继承了一套基因,一半来自母亲,一半来自父亲。
如果你继承到了其中任何一方的异常基因,你就会得这个病。
如果父母中有一个有异常基因,那么子女遗传到HD的几率是50%。
有时这种遗传现象可能看不出来,比如在父母还没有到发病年龄就去世了的情况下。
亨廷顿舞蹈病是否可以治疗?目前还没有可以减慢或者逆转HD的发展的疗法。

亨廷顿舞蹈症1872年,英国外科医生George Huntington首次描述了亨廷顿舞蹈症(HD)。
亨廷顿舞蹈症(即Huntington Disease)是一种迟发性神经退行性遗传病,主要病因是患者第四号染色体上的Huntington基因发生变异,产生了变异的蛋白质,该蛋白质在细胞内逐渐聚集在一起,形成大的分子团。
一般科学家将这些不溶水的分子团称为“包涵体”。
一般患者在中年发病,逐渐丧失说话、行动、思考和吞咽的能力,病情大约会持续发展15年到20年,并最终导致患者死亡。
这种病的遗传几率为50%该病主要侵害基底节和大脑皮质,具有高度的区域选择性。
基底节运动通路受损引发运动过度,即亨廷顿舞蹈症的主要临床症状——舞蹈样动作;大脑皮层受损导致患者认知功能障碍,晚期亨廷顿舞蹈症患者多见痴呆。
该病在不同的国家和地区发病率是不相同的,在西欧为3-7/100000,而在某些种群中超过15/10000。
但亨廷顿舞蹈症在日本、中国、芬兰以及非洲黑种人中发生的概率较低。
因此在不同的地区应该采取不同的措施来预防及治疗亨廷顿病。
1983年亨廷顿病的致病基因首次通过连锁分析定位于第四号染色体。
1993年,亨廷顿舞蹈病协作研究外显子扩增和cDNA克隆技术,将HD基因it-15定位于染色体4p16.3,同时确认在患者it-15基因外显子1上CAG三核苷酸重复突变。
HD基因上的CAG重复序列编码一段多聚谷氨酰胺(PolyQ),正常人的PolyQ长度少于35个,而患者的PolyQ长度则超过36个。
HD的外线率依赖于CAG的重复个数,并且CAG的长度与发病年龄成负相关。
亨廷顿舞蹈症的临床表现可以分为早中晚三期。
早期:精神易激动、易怒、情感淡漠、焦虑、异常的眼运动、抑郁等。
中期:肌肉持续收缩引起的面部、颈部和背部的肌肉异位;身体不自主的运动;行走时出现平衡障碍;出现舞蹈样动作、扭动躯体动作、强直性抽搐、摇摆不稳不连贯的步态;做需要手灵巧读的动作产生困难,不能正常控制动作的速度和力量;反应迟钝;全身无力;体重减轻;语言障碍、脾气倔强。



亨廷顿舞蹈病一概述亨廷顿舞蹈病(Huntington’s disease, HD)是一种罕见的常染色体显性遗传病,又称慢性进行性舞蹈病、大舞蹈病。
患者一般在中年发病,出现运动、认知和精神方面的症状。
亨廷顿舞蹈病临床症状复杂多变,患者病情呈进行性恶化,通常在发病15~20 年后死亡。
起病隐匿,进展缓慢,以舞蹈样动作伴进行性认知、精神功能障碍终至痴呆为该病的主要特征。
病因是亨廷顿基因上多核苷酸重复序列的错误表达,从而影响不同的分子通路,最终导致神经功能失调和退化。
二病因亨廷顿舞蹈病是一种全外显性的常染色体显性遗传病。
在确认基因位点后,又经过多年研究才找到它的致病基因Htt(Huntingtin)。
这个基因编码 Htt 蛋白(Hunting tin protein),在它的第一个外显子中,包含了重复的 CAG 三联密码子。
在 HD 中,这个三联密码子的重复次数会出现异常增加。
拥有多36 次 CAG 重复三联子的个体会患病。
但如果重复次数为 36~39 个,则全外显性较低。
三联子重复次数不稳定,在遗传到下一代时次数可发生改变。
在大脑中表达的变异 Htt 蛋白通过不同分子机制导致神经功能退化。
变异蛋白不仅促使该蛋白的异常功能增加而且导致正常功能的丧失。
正常 Htt 蛋白本身具有多种细胞功能,Htt蛋白变异则导致这些功能障碍。
蛋白变异常常首先表现为相关基因的表达异常,已有研究显示HD 纹状体中有关神经传导的基因出现表达异常。
另外,CAG 的异常重复可以大规模影响分子间的相互作用,导致细胞内蛋白运输紊乱。
Htt蛋白变异不仅打乱线粒体功能相关蛋白的基因调节,而且还和线粒体膜表面的蛋白反应,损伤呼吸链功能,妨碍线粒体固定到微管,影响线粒体动态融合与分裂并使钙传输增加。
变异蛋白也可抑制自噬功能,促进凋亡,改变神经营养供能及细胞胞浆内的生物和信号合成。
HD的患病率在不同人群中变异很大,西方人口的患病率是十万人中有 4~8 例。

亨廷顿舞蹈症概述摘要亨廷顿舞蹈症(HD)是由携带了更多扩增的多聚谷氨酰胺的突变亨廷顿蛋白所造成的。
在神经细胞的水平,野生型亨廷顿蛋白功能的丧失与突变亨廷顿蛋白毒性功能的获得被认为是亨廷顿病的病因。
进一步而言,兴奋性毒性,多巴胺毒性,代谢损伤,线粒体功能紊乱,细胞凋亡以及自体吞噬涉及于亨廷顿病的渐进性病理发展过程。
尽管提出了多种治疗策略,目前对于这种破坏性的神经退行性病变还没有有效的治疗。
随着对亨廷顿病的病理机制的进一步认识,以及相关技术的进一步发展,我们可能会找到一种有效的治疗方案。
1.简介亨廷顿舞蹈症(HD)是一种渐进性的常染色体显性的神经退行性病变,是由在亨廷顿蛋白基因的CAG三核苷酸序列发生扩增所致(>35个重复序列)。
这就使亨廷顿蛋白N末端带有一个扩增的多聚谷氨酰胺束(形成突变亨廷顿蛋白)。
亨廷顿病最显著的特征是不能控制的舞蹈样运动,痴呆,精神异常,以及早期死亡,这通常发生在中年时期。
这些症状与在纹状体的中等棘状神经元(神经细胞)更倾向于发生退行性病变密切相关,当然这种病变在晚期也会累及其它脑区。
2.神经退行性病变的机制野生型亨廷顿蛋白(htt)被认为具有许多细胞内的功能,比如蛋白运输,囊泡转运,与细胞骨架的锚定等。
当它发生了突变(加上了一个扩增的多聚谷氨酰胺束),亨廷顿蛋白将赋予一个新的对细胞具有毒性的功能(毒性功能的获得),同时原有的功能丧失(野生型功能的丧失)。
相关的胞内信号通路的失调包括蛋白酶的活化[1],蛋白质错折叠与蛋白质降解途径的抑制[2],转录失调,轴突运输的干扰[3],以及突触功能紊乱[4]。
由突变亨廷顿蛋白介导的细胞内功能紊乱逐渐造成在不同脑区的神经元发生神经退行性病变与死亡,这包括纹状体。
已经发现多种机制涉及于亨廷顿病的病理过程,诸如兴奋性毒性,多巴胺毒性,代谢损伤,线粒体功能紊乱,细胞凋亡以及自体吞噬。
2.1 皮质纹状体功能紊乱与兴奋性毒性纹状体接收来自整个大脑皮质的兴奋性谷氨酸能信号输入,因此在亨廷顿病中所表现的纹状体神经元选择性的易损性可能归因于它们接收了大量的谷氨酸能信号输入,以及(或者)是由于这些细胞所表达的谷氨酸受体类型的特殊性。
亨廷顿病亨廷顿病(大舞蹈病,亨廷顿舞蹈病,慢性进行性舞蹈病,遗传性舞蹈病)【病因】(一)发病原因Huntington病是影响纹状体和大脑皮质的常染色体显性遗传病,呈完全外显率,受累个体后代50%发病。
HD为4号染色体短臂4p16.3的Huntingtin基因突变所致,基因产物为CAG三核苷酸重复扩增产生Huntingtin蛋白,正常人为11~34个CAG重复序列,HD为40个以上。
只要了遗传致病基因,或早或晚会出现症状,纯合子与杂合子的临床症状无明显差异,临床亦偶见散发病例。
根据发病年龄,HD可分为青年型(20岁前发病)及成年型。
本病遗传特点包括早发现象(anticipation),后代中有连续发病提前倾向;父系遗传(paternal descent)早发倾向更明显,这两种现象都与导致HD突变的不稳定性有关。
散发病例(即无阳性家族史)的HD约占整个HD患者的1%。
Huntington报告的病例均为移居美国的英国人后裔,约1000多例HD病人祖先可追溯到1630年自英国移民来的6个人,其中一个家系可上溯300年,共12代,每代都有HD病人。
美国的许多患者都是英国移民到美国长岛的两兄弟的后代。
Negretee(1958)在委内瑞拉San Luis小渔村居民中发现很多HD病人,所有病人都来自150年前患HD的一个妇女的后代。
突变基因的亲源性影响发病年龄,幼年型HD 多见于父系遗传,年长发病多为母系遗传。
另发现4对单卵双胎几乎同龄发病。
本病每代平均患病率为50%,男女同样受累,有些家族全部成员皆罹本病。
家族一旦发病,就要逐代无间断地相传。
(二)发病机制虽然基因突变点已经明确,但亨廷顿病发病机制还是不明确,有关发病机制的主要理论是脂质过氧化导致能量代谢的异常,后者进一步引起细胞的兴奋毒性和凋亡。
亨廷素和泛素一起出现在患者纹状体和皮质的神经细胞核内包涵体中,以及营养不良的轴突内,但亨廷素和这些发病因素存在什么关系,以及通过什么途径导致神经细胞凋亡,还不明确。
韦尼克脑病诊断标准全文共四篇示例,供读者参考第一篇示例:韦尼克脑病是一种罕见的神经系统退行性疾病,亦称为亨廷顿病(Huntington's disease,HD)。
该病通常在中年发作,会导致患者在生理和心理上产生各种严重障碍,最终导致残疾和病亡。
目前,韦尼克脑病的诊断还存在一定的难度,接下来我们将介绍韦尼克脑病的诊断标准。
一、家族史韦尼克脑病是一种遗传性疾病,患者通常有家族史。
如果患者的家族中有韦尼克脑病的病例,特别是一级亲属患病,那么患者本人也有可能患病。
家族史是诊断韦尼克脑病的第一步。
二、临床症状韦尼克脑病的临床表现主要包括运动障碍、认知障碍和精神障碍。
运动障碍表现为舞蹈样动作(chorea)、肌张力增高、不自主运动、肌肉僵直等。
认知障碍表现为记忆力减退、思维迟钝、决策能力下降等。
精神障碍表现为情绪不稳定、易激动、抑郁等。
医生在进行诊断时,会根据患者的临床表现来判断是否符合韦尼克脑病的诊断标准。
三、神经影像学检查韦尼克脑病的患者通常会出现大脑皮层和基底节的萎缩。
医生可以通过MRI、CT等神经影像学检查来观察患者大脑的结构,从而判断是否存在萎缩现象。
这些检查结果可以作为诊断韦尼克脑病的重要依据。
四、基因检测韦尼克脑病是由HTT基因的突变引起的,医生可以通过基因检测来确定患者是否携带有致病基因。
如果患者携带有突变的HTT基因,那么他有很大可能会发展成为韦尼克脑病。
基因检测是目前诊断韦尼克脑病最可靠的方法之一。
韦尼克脑病的诊断标准是一个综合性的过程,医生需综合家族史、临床表现、神经影像学检查和基因检测等多方面的信息来判断患者是否患有该病。
通过及早发现和诊断,可以帮助患者及时进行治疗和管理,减轻病情的发展和症状的加重。
希望未来科学界能够进一步深入研究,找到更有效的治疗方法,为韦尼克脑病患者带来更多希望。
第二篇示例:韦尼克脑病是一种罕见的神经系统疾病,也被称为TMEP (Toxic-Metabolic Encephalopathy with Inflammation in Chronic Alcoholism)。
亨廷顿舞蹈病1例及文献复习【摘要】亨廷顿舞蹈病(HD)是一种常染色体显性遗传的神经退行性疾病,由IT15基因外显子CAG三核苷酸重复突变所致,典型临床表现为不自主运动、认知功能减退及精神行为异常。
影像学检查发现有尾状核萎缩,额角扩大,部分伴有皮质萎缩,基因检测是该病重要的诊断方式。
但对早期或不典型HD的诊断,临床常出现漏诊和误诊。
为探讨HD 的临床特点,本文对1例临床表现疑似HD患者进行影像学及基因的CAG重复序列的检查,证实了临床推断。
并结合HD相关文献,阐述HD的发病机制、临床特点及治疗进展,提高临床医生对该病的认识。
【关键词】舞蹈样动作;基因检测;重复序列;异常扩增亨廷顿舞蹈病(Huntington disease,HD)是神经科比较罕见的缓慢起病的神经系统退行性疾病,是由于亨廷顿蛋白基因( huntingtin,HTT,又称IT15 )突变所致,该基因位于4 p16 .3,其1号外显子内存在( CAG )重复序列,该序列异常扩增是导致亨廷顿舞蹈病发生的原因[1]。
大多中年起病,起病隐匿,逐渐进展恶化,一般为10-20年后死亡。
本文收集了一个HD患者的完整的临床资料,总结HD临床特点及遗传规律以提升对疾病的整体认知,早诊断早治疗,提高生活质量,并提供生育指导。
1病例资料1.1 临床特点患者,男,58岁,因“渐进性言语不清、不自主活动9年”为主诉入院。
患者于9年前无明确诱因出现言语不清,表现为吐字不清,头CT脑萎缩,未进一步诊治。
后上述症状逐渐进展,言语不清明显加重,同时出现吞咽费力,双上肢不自主抖动,记忆力等认知症状明显下降,与家属沟通及交流减少,生活逐渐不能自理,需家人帮助完成日常活动。
近2年言语费力,且出现尿便失禁,活动减少,大部分时间卧床。
1.2 既往史双侧股骨头坏死病史27年,行手术治疗,输血,术后行走小碎步。
1.3 体格检查心肺腹查体无明显异常。
神经系统查体:神志清楚,言语不清及语言减少,构音障碍,查体欠合作。
亨廷顿病诊疗指南概述亨廷顿舞蹈病(Huntington’s disease,HD)又称亨廷顿病,是一种隐匿起病,以舞蹈样不自主运动、精神障碍和痴呆为特征的遗传性神经系统变性病,为常染色体显性遗传。
其致病是由位于4号染色体短臂的亨廷顿基因IT15(interesting transcript 15)上的CAG三核苷酸异常扩增突变所致。
病因和流行病学HD是常染色体显性遗传病,IT15基因(也称为HD基因或HHT基因)的表达产物为大小约3144个氨基酸的多肽亨廷顿(HTT)蛋白。
突变的亨廷顿蛋白含有扩增的谷氨酰胺残基链,病理改变主要局限于中枢神经系统,以尾状核和壳核(新纹状体)萎缩最为突出。
虽然目前认为HD的发病与突变HTT蛋白的毒性相关,但该病具体的病理生理学机制尚未明确。
全世界HD的患病率约为2.7/100 000,发病率约为每年0.38/100 000。
欧洲、北美、澳大利亚的患病率约为5.7/100 000,亚洲的患病率约为0.4/100 000。
临床表现HD的临床特征表现为运动障碍、精神症状和认知障碍三联征,通常隐匿起病,缓慢进展。
发病年龄从儿童期至79岁不等,最常见于30~50岁,20岁前诊断为此病的患者被称为青年型HD或Westphal变异型HD,但其所占比例不足全部HD的10%。
HD运动障碍的早期表现为舞蹈症,即累及面部、躯干和肢体的快速,不自主,无节律运动;早期异常动作轻微,患者可能难以意识到舞蹈症状的存在,或将舞蹈样动作整合到随意运动中,使得正常动作的控制出现困难或偏差;随着疾病的进展,舞蹈症的范围和程度常逐渐加重,甚至影响膈肌、咽和喉部肌肉,从而产生构音障碍、吞咽困难和不自主发声;疾病晚期舞蹈症常消失,代之以僵直、少动为主的帕金森症样表现,可伴有局灶性肌张力障碍;最后常导致卧床。
运动保持困难也是该病常见表现,即不能保持某些简单的自主动作,如保持伸舌动作困难等。
精神障碍可先于舞蹈症出现,常见症状包括情绪低落、抑郁、易激惹、淡漠和焦虑,也可出现偏执、妄想和幻觉;少见症状包括强迫行为和精神病表现,以上症状多呈进行性加重。
认知障碍最主要的特征是执行功能障碍,表现为做决定、执行多重任务和转换认知目标的能力下降。
患者通常对其认知缺陷缺乏自知力。
记忆减退或丧失多出现在病程晚期,随疾病进展,最终可发展为痴呆。
除以上三联征外,眼球运动异常也是亨廷顿病的一个突出表现。
早期表现为眼球扫视速度减慢,但眼球追随运动保留;晚期则眼球追随运动、自主扫视和再固定全部受损。
此外,体重减轻和恶病质也是亨廷顿病的常见特征,患者的不自主运动大量消耗能量可使体重明显下降,而通常无食欲减退。
睡眠和(或)性功能障碍也比较常见。
青年型HD表现为20岁前起病,临床表现可没有舞蹈症或仅有轻微舞蹈症,多有肌阵挛、癫痫发作、共济失调、认知和行为问题以及帕金森综合征等表现,认知障碍出现早且严重,病程进展更快。
运动和认知功能的逐渐恶化会导致显著的并发症,如咽喉部肌肉受累导致吞咽困难,运动障碍、活动减少甚至卧床可导致吸入性肺炎和其他感染、褥疮等。
辅助检查1.基因检测HHT基因检测是最重要的辅助检查,致病基因HTT的CAG重复拷贝数的阈值为36:小于36不致病,36~39不完全外显;大于39则完全外显。
基因检测敏感性98.8%,特异性100%。
HTT基因中CAG重复拷贝数是发病年龄的主要决定因素,重复拷贝数越高,发病年龄越早。
HTT基因也可作为有风险的家族成员的症状前检测,携带致病性HTT基因的患者可行产前检查。
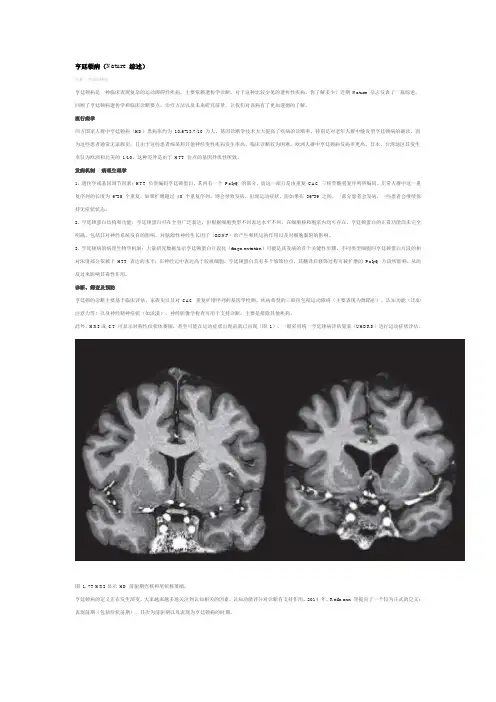
2.影像学早期HD的头影像多正常,中晚期HD患者头MRI/CT出现基底节萎缩,尾状核头萎缩最为显著;PET和SPECT也可显示尾状核代谢减低。
3.其他抗核抗体谱、抗磷脂抗体、ASO、血涂片、甲状腺功能及甲状腺抗体等检查常用于鉴别诊断,排除其他病因。
诊断亨廷顿病基于典型的临床三联征(舞蹈症、精神障碍、痴呆),结合家族史可初步诊断,基因检测HTT基因上有致病性三核苷酸CAG重复扩增可确诊,CAG重复拷贝数的阈值为36:小于36不致病,36~39不完全外显,大于39则完全外显。
表现为常染色体显性遗传方式的家族史是诊断的关键因素。
鉴别诊断HD的鉴别诊断包括遗传性和获得性病因的相关疾病。
1.遗传性病因的疾病包括一组与HD表型相似的遗传异质性疾病,有时单靠临床表现鉴别比较困难,需进一步依赖基因筛查。
这组疾病包括:(1)C9ORF72基因(GGGGCC)六核苷酸重复扩增所致的神经系统变性病:C9ORF72基因中(GGGGCC)六核苷酸重复扩增突变是家族性额颞叶痴呆(frontotemporal dementia,FTD)和家族性肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)的最常见原因,并且也已见于散发性FTD、ALS和帕金森综合征的病例中。
C9ORF72基因目前被认为是为HD拟表型综合征最常见的遗传原因。
(2)齿状核红核苍白球路易体萎缩症(dentatorubral pallidoluysian atrophy,DRPLA):是一种罕见的常染色体显性遗传疾病。
通常见于日本患者,表现为舞蹈症、共济失调和痴呆。
(3)神经棘红细胞增多症:是一种常染色体隐性遗传病。
临床表现包括舞蹈症、癫痫、精神症状、认知障碍等,与亨廷顿病相似,其中口-颊-舌肌张力障碍性运动和唇舌咬伤有重要的鉴别诊断价值,外周血涂片中可见棘红细胞。
(4)亨廷顿病样综合征2(Huntington disease-like syndrome 2,HDL2):是由染色体16q24.3上亲联蛋白-3基因(junctophilin-3 gene,JPH3)中(CAG/CTG)三核苷酸重复扩增导致的一种与HD相似的罕见疾病。
据报道,该病主要见于有非洲血统的患者,部分HDL2病例存在棘红细胞增多症。
(5)泛酸激酶相关性神经变性疾病:是一种存在脑部铁沉积的神经变性病。
在儿童中通常表现为肌张力障碍和基底节铁沉积。
它是由编码泛酸激酶2基因的突变引起的一种常染色体隐性遗传病。
(6)脊髓小脑性共济失调(spinocerebellar ataxia,SCA)17型、家族性朊蛋白病以及Friedreich共济失调等也可表现为类HD样的表型。
2.获得性病因的疾病包括药物及毒物中毒、迟发性运动障碍、小舞蹈病、克雅病(CJD)、自身免疫性脑炎等,鉴别诊断主要依据临床特点、疾病起病及演变过程、药物毒物接触史、影像、血和脑脊液抗体检查等。
治疗目前HD的治疗限于对症及支持治疗,尚无特异性治疗方法或对因治疗。
1.综合治疗(1)运动障碍的治疗:首先需防护舞蹈症导致的外伤,评估舞蹈症对HD 患者日常生活能力的影响,以确定药物治疗利弊以及是否启动药物治疗。
1)药物治疗:典型和非典型抗精神病药以及多巴胺耗竭剂(丁苯那嗪)。
初始药物治疗建议采用丁苯那嗪,该药可能触发抑郁或使其恶化,必须权衡自杀风险与舞蹈症治疗的必要性。
舞蹈症和精神病症状共存或丁苯那嗪无效者,可使用非典型抗精神病药作为初始治疗,包括奥氮平、利培酮或阿立哌唑,喹硫平通常无效。
非典型抗精神病药无效者,可试用典型抗精神病药如氟哌啶醇、氟奋乃静等。
丁苯那嗪联用一种抗精神病药可能对顽固的重度舞蹈症有效。
其他可能的替代治疗包括金刚烷胺、左乙拉西坦和托吡酯。
HD的僵直和运动迟缓一般不需治疗,如需要,可选用苯二氮zaozi003类及治疗帕金森病的药物如金刚烷胺和多巴丝肼等。
2)非药物治疗:包括康复治疗,生活辅助设备如软垫、躺椅和床垫等,减少外伤风险。
(2)精神障碍的治疗:精神行为异常若不伴舞蹈症,初始治疗建议采用喹硫平,奥氮平或利培酮可作为替代选择,但对伴重度舞蹈症的精神症状则可作为首选。
抑郁通常使用三环类抗抑郁药或选择性5-羟色胺再摄取抑制剂。
(3)认知障碍的治疗:目前尚无针对HD相关痴呆的有效疗法。
2.并发症治疗严重的吞咽障碍及体重减轻常需胃管鼻饲或经皮胃造瘘手术治疗。
运动障碍致活动减少甚至卧床可导致吸入性肺炎、其他感染及褥疮等,需相应的抗感染治疗和护理支持。
3.其他治疗饮食及物理支持治疗,对家庭护理要求较高。
HD患者代谢需求高,常需要高热量饮食。
应由物理治疗师对步态和平衡问题进行评估,选择助行器,以防跌倒;由于跌倒在疾病后期很常见,推荐采用髋关节保护器以降低髋部骨折风险。
同时进行患者教育,解决患者和家属的心理及社会需求。
诊治流程(图47-1)图47-1 亨廷顿病诊疗流程图参考文献[1]Pringsheim T, Wiltshire K, Day L, et al. The incidence and prevalence ofHuntington's disease: a systematic review and meta-analysis. Mov Disord, 2012, 27:1083-1091.[2]Kremer B, Goldberg P, Andrew SE, et al. A worldwide study of the Huntington'sdisease mutation. The sensitivity and specificity of measuring CAG repeats. N Engl J Med, 1994, 330:1401-1406.[3]Wild EJ1,Tabrizi SJ. Huntington's disease phenocopy syndromes. Curr OpinNeurol, 2007 , 20(6): 681-687.[4]Jankovic J,Roos RA. Chorea associated with Huntington's disease: to treat or not totreat? Mov Disord, 2014, 29(11): 1414-1418.[5]Armstrong MJ, Miyasaki JM,American Academy of Neurology. Evidence-basedguideline: pharmacologic treatment of chorea in Huntington disease: report of the guideline development subcommittee of the American Academy of Neurology.Neurology, 2012, 79 (6): 597-603.。