高中化学复习知识点:物质的量浓度概念、含义
- 格式:docx
- 大小:46.61 KB
- 文档页数:9

第2讲 物质的量浓度【核心素养分析】1.宏观辨识与微观探析:能从不同层次认识物质的多样性,能根据溶液的体积和溶质的物质的量浓度计算溶质的物质的量、溶质的微粒数目。
2. 科学探究与创新意识:能从问题和实际出发,确定探究目的,设计配制一定物质的量浓度溶液的实验方案,进行实验探究;在探究中学会合作与交流,能够正确分析实验过程中可能存在的误差问题。
[ 【核心素养发展目标】1.能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系。
2.了解容量瓶的特点、用途及使用注意事项,掌握配制一定物质的量浓度溶液的方法及操作,建立实验误差分析思维模型,并能应用模型解决实际问题。
【知识点解读】知识点一、物质的量浓度与溶质的质量分数 1.物质的量浓度(1)概念:表示单位体积溶液中所含溶质B 的物质的量。
(2)表达式:c B =n BV 。
(3)单位:mol·L -1(或mol/L)。
2.溶质的质量分数(1)概念:以溶液里溶质质量与溶液质量的比值表示溶液组成的物理量,一般用百分数表示。
(2)表达式:w (B)=m (B )m (aq )×100%。
3.物质的量浓度与溶质的质量分数【易错警示】 (1)溶液中溶质的判断(2)混淆溶液的体积和溶剂的体积①不能用水的体积代替溶液的体积,尤其是固体、气体溶于水,一般根据溶液的密度和总质量进行计算: V =m (溶液)ρ=m (气体或固体)+m (溶剂)ρ。
①两溶液混合,溶液的体积并不是两液体体积的加和,应依据混合溶液的密度进行计算。
(若题目说忽略体积变化,则总体积可由混合前体积直接相加)【随堂检测】在标准状况下,将V L A 气体(摩尔质量为M g·mol -1)溶于0.1 L 水中,所得溶液的密度为ρ g·cm -3,则此溶液的物质的量浓度(mol·L -1)为( )A .VρMV +2 240B . 1 000VρMV +2 240C .MV22.4(V +0.1)ρD .1 000Vρ(MV +2 240)【答案】B【解析】气体的物质的量为V22.4mol ,所得溶液的质量为⎝⎛⎭⎫V 22.4×M+100 g ,则此溶液的物质的量浓度为V 22.4mol÷⎣⎡⎦⎤⎝⎛⎭⎫V 22.4×M +100g÷1 000ρ g·L -1 = 1 000VρMV +2 240 mol·L -1。


物质的量浓度【学习目标】1•物质的量浓度的概念;2•物质的量、摩尔质量和物质的量浓度的关系。
【要点梳理】要点诠释:对于溶液,我们可用溶质的质量分数来表示溶液的组成。
而取用溶液时,一般是量取体积,并不是称量其质量。
如果知道一定体积的溶液中溶质的物质的量,那就方便多了。
要点一、物质的量浓度概念辨析从单位体积的溶液里所含溶质B的物质的量来表示溶液组成的物理量叫做溶质B的物质的量浓度。
符号为C(B),单位有mol/L (或mol ∙LT)等。
(1)溶液体积不能等同于溶剂体积,应是溶质在溶剂中溶解后的实际体积。
(2)溶质可以是物质,也可以是分子或离子。
(3)溶液具有均一性,即从一定物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度保持不变。
(4)溶质是用物质的量表示而不是质量表示;体积表示溶液的体积,而不表示溶剂的体积,并且体积单位为L。
(5)带结晶水的物质溶于水后,溶质是不含结晶水的化合物,溶剂中的水包括结晶水。
(6)从一定物质的量浓度溶液中取出任意体积的溶液,物质的量浓度不变,但随溶液体积的变化溶质的物质的量不同。
(7)气体溶于一定体积的水中,溶液的体积不等于溶剂的体积而应根据溶液密度和溶液质量求算。
(8)若浓溶液稀释或浓度差别较大的溶液混合,混合后溶液的总体积比原来的体积之和小。
要点二、物质的量浓度与溶液溶质的质量分数要点三、溶质的物质的量(n)、溶液的物质的量浓度、溶液的体积三者关系V—WoO EU(1)物质的量浓度与溶质质量分数的换算■- ■ (W 为溶质质量分数)(2)溶液的稀释规律:即稀释前后,溶质的物质的量不变,则有: C 1V 1=c 2V 2【高清课堂:物质的量浓度】N 、m 、V (气体)、C 之间的转换关系 :Brπn mWl nιol∕L)I溶如浓度I要点四、有关物质的量浓度的计算(1)溶液的稀释与混合① 稀释 溶质的质量不变C 1V 1=C 2V 2[C 1、C 2和V 1、V 2分别表示稀释前后溶液的物质的量浓度和体积 a. 稀溶液稀释时 V 2=V 水+V 1 b. 浓溶液稀释时 V 2≠V κ+V 1 ② 混合 C 1V 1+C 2V 2=C 混V 混a. 混合后溶液体积 V 混=V1+V2(两溶液浓度相同或差别较小或稀溶液混合I{T mol)× T ⅛α JT - J Z lPI[ + TAp2b.混合物溶液体积改变" '' (两溶液浓度差别较大[C1、C2 , P1、ρ, V1、V2分别表示混合前同一溶质溶液的物质的量浓度、密度、C混、P混、V混表示混合溶液的物质的量浓度、密度、体积](2)物质的量浓度C(B)与溶质质量分数(W)的换算于=1 (K)OanL∙Lii)p⅛mL=)w)体积,ΛJ r(gmol^l)-1M :溶质B 的摩尔质量 p:溶液密度(g mL ) 推导方法设溶液为1 L ,则JxBJ _PtgmT--Jxl OoomLxM i OoO{mL ∙l∕i)*p(g:IIL -I)订VA∕(g tno]T).V(g mol _:)饰= 用⑧ 1∩∩α 二>⅛产Vf_E(B)(mMLr)XILXM⅛ΠH ⅝Q)◎ W (SS) °^1 000 mL×p(g -mL^1)-P(S mL^)Xl OOOmL LUU"_城g mo 厂:)IOOO(InLT -I)-P (g mL^1)(3)饱和溶液物质的量浓度与溶解度 (S)的换算_ _1 Ooo(mL*L^1) -PtenIL -1) ■ ÷5⅛) CzB)= (S÷ IoO)(g>JΛ^tnoΓ1)―1― 1P :饱和溶液密度(g mL ) M :溶质B 的摩尔质量(g mol ) 注只适用于饱和溶液中的换算推导方法 设溶剂为100 g ,贝U B 为S g,溶液为(100+ S)g(4) 标准状况下气体溶于水所得溶液的物质的量浓度 标准状况下,V L 气体溶于V(H 2O)L 中,所得溶液密度为—1P (g ∙ m)则:②溶液椅宀話严丸占m ¾ιnL ∙LP■仇 gmLP ■珂 L)眩 g- moΓ ⅞'FtL)+22400( g-moΓ1> 巩 U OXL)用弟)「' 特别提醒 ①溶液体积的单位是 L , P 的单位是g mL -1时,利用算V(溶液)时注意单位换算。


高中化学物质的量浓度教案,知识点总结一、教学目标1. 掌握化学物质的量的定义、表示方法及量的计算方法;2. 熟练掌握溶液的浓度概念、表示方法及计算方法;3. 了解物质浓度的应用领域。
二、知识概述1. 化学物质的量(1)定义化学物质的量是对物质中所含粒子(原子、分子、离子或其他基本单元)数量的度量。
(2)表示方法化学式记法、分子式记法、通式记法等。
(3)化学计量关系化学计量关系是描述化学反应中不同化学物质的量之间的关系,如化学计量比、反应物与剩余量、限量与过量等。
2. 溶液的浓度(1)定义溶液中溶解质质量或体积与溶液总质量或体积的比值,即溶液中的单位质量或单位体积溶解质的含量。
(2)表示方法质量浓度C,单位为g/L。
摩尔浓度M,单位为mol/L。
体积浓度V,单位为mL/L。
(3)计算方法质量浓度:C=m/V摩尔浓度:M=n/V体积浓度:V1(C1)=V2(C2)(4)应用测定某些物质的含量或浓度、制备一些化合物、分析实验中的试剂等。
三、教学重难点及解决方法1. 重点掌握化学物质的量的定义、表示方法及量的计算方法。
2. 难点溶液浓度的计算方法和应用。
解决方法:(1)生动形象地举例说明概念和计算方法;(2)组织小型实验,培养学生实践操作能力,掌握实际应用方法;(3)多组织讨论,提高学生思维质量和学习兴趣。
四、教学步骤1. 课前预习(1)预习本课知识点;(2)学习相关参考书籍和资料。
2. 导入新课为学生提出问题,引导学生进入新课学习状态。
3. 新知习得(1)化学物质的量的概念、表示方法;(2)化学计量关系的概念及其应用;(3)化学物质浓度的概念、表示方法及计算方法;(4)化学物质浓度的应用领域。
4. 实践操作生动演示、组织小型实验、实践操作等方式,提高学生实际操作能力。
5. 总结归纳深入剖析知识点,将掌握的知识点进行总结归纳,梳理重难点,加深对知识点的理解。
6. 课后巩固让学生针对学习过程中理解不透彻的问题进行集中复习,并进行总结。


一、物质的量浓度的概念1.定义以1L 溶液里所含溶质的物质的量来表示的溶液组成的物理量。
2.表示方法物质的量浓度用_________表示,单位是_____________。
3.计算公式物质的量浓度(mol/L)=______________________________,即c(A)=___________。
注意:(1)体积是_____的体积,单位是________;溶质的量是物质的量的量而不是质量。
(2)溶质可以是化合物,也可以是离子或其他特定组合。
判断溶质时应具体情况具体分析:如:CuSO 4·5H 2O→____________、SO 3→___________等。
如:NH 3、Cl 2等物质溶于水后成分复杂,但计算浓度时,仍以溶解前的NH 3、Cl 2为溶质。
(3)带有结晶水的物质作为溶质时,其“物质的量”的计算或“质量”的计算要多加注意,如:n(CuSO 4·5H 2O)=n(CuSO 4)。
(4)同一溶液无论取出多少体积,其各种浓度(物质的量浓度、溶质的质量分数、离子浓度)均不变。
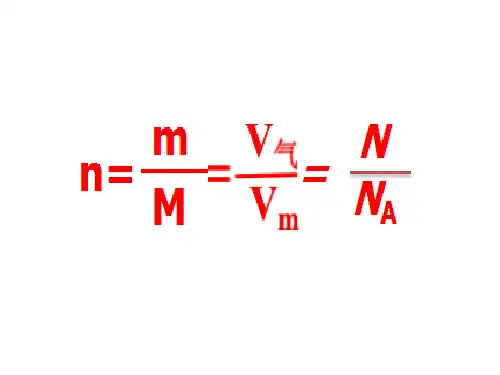
【答案】Cmol/L 或mol ·L -1溶质的物质的量溶液的体积()()mol L液()n A V 溶液 L CuSO 4H 2SO 4【练一练】下列各溶液中,溶质的物质的量浓度为1mol/L 的是 ()A .将25g 胆矾溶于100mL 水所得到的溶液B .将80gSO 3溶于水配成1L 的溶液C .将0.5mol/L 的NaNO 3溶液100mL 加热蒸发掉50g 水的溶液D .从100mL0.5mol/L 稀硫酸中取出50mL 溶液 【答案】B物质的量浓度知识梳理二、物质的量浓度的计算1.物质的量与其他公式之间的转换【思考】物质的量与质量、微粒个数、标况下的气体体积之间的关系?【答案】n=m/M=V/V m=N/N A【练一练】将8gNaOH溶于水配成250mL溶液,此溶液中N a OH的物质的量浓度是多少?取出10mL此溶液,其中含N a OH多少克?【答案】0.8mol/L;0.32g2.溶液中离子浓度的计算思考:如果已知某化合物的浓度,如何求出该化合物中某一离子的浓度呢?反之,已知某离子的浓度,怎样求化合物的浓度呢?【练一练】(1)0.3mol/L的Al2(SO4)3溶液中,铝离子、硫酸根的物质的量浓度分别是多少?答案:0.6mol/L0.9mol/L(2)Al3+物质的量浓度是0.8mol/L的Al2(SO4)3的物质的量浓度为多少?答案:0.4mol/L(3)0.5L1mol/L的FeCl3与0.2L1mol/L的CaCl2溶液中,Cl-物质的量浓度之比为______。


一定物质的量浓度溶液的配制与计算一、一定物质的量浓度溶液的配制 1.物质的量浓度定义用来表示单位体积溶液里所含溶质B 的物质的量的物理量,叫做溶质B 的物质的量浓度,符号为c B ,单位为mol/L(或mol·L −1)。
2.物质的量(n B )、物质的量浓度(c B )与溶液体积(V )之间的关系物质的量浓度(c B )=B n V 溶质的物质的量()溶液的体积(),即B B nc V。
(1)溶质是溶液中的溶质,可以指化合物,也可以指离子或其他特殊的组合。
分析溶质时要注意特殊情况下的溶液的溶质,如NH 3溶于水后所得氨水的溶质为NH 3·H 2O ,但习惯上认为氨水的溶质为NH 3;SO 3溶于水后所得溶液的溶质为H 2SO 4;CuSO 4·5H 2O 溶于水后所得溶液的溶质为CuSO 4。
(2)体积V 指溶液的体积而不是溶剂的体积。
3.一定物质的量浓度溶液的配制(1)主要仪器容量瓶(一定容积)、托盘天平(砝码)、烧杯、量筒、玻璃棒、胶头滴管等。
(2)配制步骤 ①过程示意图②配制步骤以配制500 mL 1.00 mol·L-1 NaOH溶液为例二、配制一定物质的量浓度溶液的误差分析1.误差分析的依据n mcV MV==若V不变,分析n的变化;若n不变,分析V的变化。
2.常见的实验误差分析可能引起误差的操作因变量c/mol·L−1 n/mol V/L天平砝码附着有其他物质或已生锈 增大 不变 偏大用量筒量取需稀释的溶液时仰视读数增大 不变 定容时俯视容量瓶刻度线 不变 减小 溶液未冷却就转入容量瓶进行定容不变 减小 砝码残缺减小 不变 偏小药品和砝码位置颠倒(使用游码)减小 不变 没有洗涤烧杯 减小 不变 定容时仰视容量瓶刻度线 不变 增大 溶质已潮解或含有其他杂质 减小 不变 定容摇匀后又加蒸馏水 不变 增大 用量筒量取需稀释的溶液时俯视读数 减小 不变 定容时蒸馏水加多后用吸管吸出 减小 不变 转移时有少量液体洒在容量瓶外减小不变图1使所配溶液体积偏大,浓度偏小;图2使所配溶液体积偏小,浓度偏大。
高中化学66专题16 物质的量的浓度1.复习重点1.物质的量浓度的概念及有关计算;2.溶解度的概念及有关计算;3.物质的量浓度、质量分数和溶解度之间的相互换算;4.配制一定物质的量浓度溶液的方法和技能。
5.高考的热点是物质的量浓度的概念及其计算,一定物质的量浓度的溶液的配制方法。
2.难点聚焦1.物质的量浓度。
浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。
常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
物质的量浓度是以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量。
符号用c B表示,(2)表达式:C B 单位常用mol/L或mol/m3,注意:①单位体积为溶液的体积,不是溶剂的体积。
②溶质必须用物质的量来表示。
计算公式为概念中的单位体积一般指1升,溶质B指溶液中的溶质,可以指单质或化合物,如c(Cl2)=0.1mol/L,c(NaCl)=2.5mol/L;也可以指离子或其它特定组合,如c(Fe2+)=0.5mol/L, c(SO42-)=0.01mol/L等。
2.溶液的稀释与混合(1)溶液的稀释定律由溶质的质量稀释前后不变有:m B =m浓×ω浓=m稀×ω稀%由溶质稀释前后物质的量不变有:C B =c浓×V浓=c稀×V稀%(2)溶液在稀释或混合时,溶液的总体积不一定是二者混合的体积之和。
如给出溶液混合后的密度,应根据质量和密度求体积。
3.物质的量浓度与溶质质量分数ω%的换算(ρ为该溶液的密度)4.一定物质的量浓度溶液的配制(1)仪器:容量瓶,容量瓶有各种不同的规格,一般有100mL、250mL、500mL和1000mL等几种。
(2)步骤:①计算:计算所需固体溶质质量或液体溶质的体积。
②用托盘天平称量固体溶质或用量筒量取液体体积。
③溶解:将溶质加入小烧杯中,加适量水溶解。
④移液洗涤:将已溶解而且冷却的溶液转移到容量瓶中,并用玻璃棒引流,再洗涤烧杯和玻璃棒2—3次,将洗涤液倒入容量瓶中。