高考化学一轮总复习第七章第二节水溶液酸碱中和滴定课件
- 格式:ppt
- 大小:1.78 MB
- 文档页数:62




第二节水溶液酸碱中和滴定1.了解水的电离、离子积常数。
2.了解溶液pH的定义。
3.了解测定溶液pH的方法,能进行pH的简单计算。
4.分析或处理实验数据,得出合理结论。
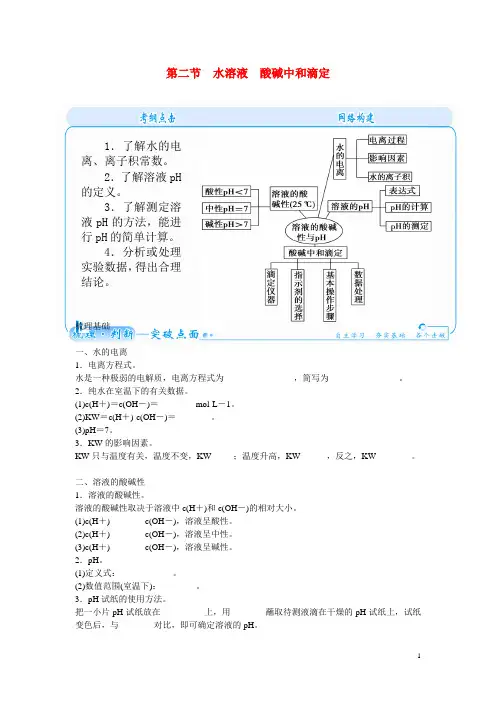
梳理基础一、水的电离1.电离方程式。
水是一种极弱的电解质,电离方程式为________________,简写为________________。
2.纯水在室温下的有关数据。
(1)c(H+)=c(OH-)=________ mol·L-1。
(2)KW=c(H+)·c(OH-)=________。
(3)pH=7。
3.KW的影响因素。
KW只与温度有关,温度不变,KW_____;温度升高,KW______,反之,KW________。
二、溶液的酸碱性1.溶液的酸碱性。
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
(1)c(H+)________c(OH-),溶液呈酸性。
(2)c(H+)________c(OH-),溶液呈中性。
(3)c(H+)________c(OH-),溶液呈碱性。
2.pH。
(1)定义式:____________。
(2)数值范围(室温下):________。
3.pH试纸的使用方法。
把一小片pH试纸放在__________上,用________蘸取待测液滴在干燥的pH试纸上,试纸变色后,与________对比,即可确定溶液的pH。
4.pH 简单计算:解答有关pH 的计算时,首先要注意温度,明确是25℃还是非25℃,然后判断溶液的酸碱性,再根据“酸按酸”,“碱按碱”的原则进行计算。
(1)强酸溶液:如浓度为c mol/L 的HnA 溶液,c(H +)=_______,所以pH =________。
,(2)强碱溶液:如浓度为c mol/L 的B(OH)n 溶液,c(OH -)=________,c(H +)=___________,所以pH =________。
(3)酸碱混合溶液pH 的计算:两强酸溶液混合:c 混(H +)=_________;两强碱溶液混合:c 混(OH -)=________________;强酸、强碱溶液混合:若酸过量:c 混(H +)=______________,若碱过量:c 混(OH -)=_______________。